概要
一般的にタンパク質の結晶構造解析をおこなう際には、継続的に数ミリグラムの目的タンパク質が精製できる系の構築が求められる。とくに目的とするタンパク質がほ乳類の培養細胞でなければ生理活性が保持されない場合、リポフェクションによる一過性発現、ジヒドロ葉酸レダクターゼ(DHFR)法による遺伝子増幅、アデノウイルス感染を利用した発現系などを選択せざるを得ない。しかしながら、これらの方法はいずれも作業量が多い、導入できる細胞が限られている、または精製タンパク質を得るまでの期間が長いと、不利な点を抱えている。
本プロトコールでは、多コピーの遺伝子をゲノムに組み込むことができ、従来の安定発現株を得る方法と同じ作業期間で、数十倍から百倍の目的タンパク質を発現する高発現株が得られることが期待される (1)。原理的にはどのほ乳動物培養細胞にも適用でき、これまでHeLa、HEK293、HEK293GnTI(-)、CHO各細胞で、生理活性をもった分泌型糖タンパク質、Gタンパク質共役型受容体、膜貫通型タンパク質等を発現する、安定発現株の樹立に成功している (2)。
装置・器具・試薬
- IR/MARプローブ(DNA試薬)(トランスジェニック)(図1)
- 制限酵素(各社)
- サーマルサイクラー(各社)
- 恒温槽(各社)
- DNA精製試薬(Gel extraction kit)(キアゲン)
- リポフェクション試薬(リポフェクトアミン2000)(インビトロジェン)
- 細胞保存試薬セルバンカー(日本全薬工業)
- 倒立顕微鏡(オリンパス)
- 血球計数板(ディジタルバイオ)
- 細胞培養用クリーンベンチ(サンヨー各社)
- 細胞培養用二酸化炭素ガスインキュベーター(ナプコ、サーモ各社)
- 二酸化炭素ガスボンベ(藤田酸素)
- 細胞培養用培養皿(コーニング、イワキ)
- マルチウェルプレート(コーニング、イワキ)
- 12連マルチピペッター(エッペンドルフ、サーモ)
- ほ乳動物培養細胞(ATCC)
- 培養液(DMEM、MEMα、opti-MEM(インビトロジェン)
- ウシ胎仔血清(FBS)(ナカライテスク)
- リン酸緩衝液(PBS)(インビトロジェン)
- 細胞解離緩衝液(トリプシンEDTA)(シグマ)
- 発現ベクター(ほ乳動物細胞で発現可能なもの、薬剤耐性遺伝子を含む)(各社)
- 選択用抗生物質(ピューロマイシン、G418、ハイグロマイシン、ブラストサイジンS)(ナカライテスク、インビボジェン)
- プレートリーダー(バイオラッド)
- 目的タンパク質の検出抗体、またはタグ抗体(各社)
実験手順(図2)
第1日目
1)目的遺伝子を発現するプラスミドベクターの直鎖化、ほ乳動物培養細胞の準備
第2日目
2)直鎖状プラスミドベクターとIR/MARプローブを細胞へ導入
第3日目
3)遺伝子導入細胞株の選択開始(低濃度の選択マーカー)
第4日目
3)遺伝子導入細胞株の選択開始(高濃度の選択マーカー)
第11日目
4)限界希釈法によるシングルコロニー取得のため96穴プレートへのまき込み(1回目)
第20–22日目
5)定量的PCRまたはタンパク質の発現量の比較による細胞株の選択(1次スクリーニング)
第23日目
4)限界希釈法によるシングルコロニー取得のため96穴プレートへのまき込み(2回目)
第32–34日目
5)定量的PCRまたはタンパク質の発現量の比較による細胞株の選択(2次スクリーニング)
第35日目
6)選択された細胞株の培養
第42日目までに
7)細胞株の保存
第45日目以降
8)目的タンパク質の精製
実験の詳細
1)目的遺伝子を発現するプラスミドベクターの直鎖化
ゲノムに組み込まれる際に、発現が得られない断片に切断される確率を減らすために、あらかじめ発現プラスミドベクターを、発現に影響のない部位で、制限酵素反応により切断する。大腸菌の複製開始点領域内にあるApaLI配列が良く用いられている。
反応後の切断された直鎖状プラスミドDNAをアガロースゲル電気泳動で分離し、市販のキットを用いてゲルからDNAを単離・精製する。
ほ乳動物培養細胞の準備
遺伝子導入時に90%コンフルエントとなるように、ほ乳動物培養細胞を35 mm培養皿(6穴プレート)へ播種する。血球計数板で細胞数を計る。HeLa細胞やCHO細胞なら3×105個/ウェルで、HEK293細胞ならコラーゲンコート済みの培養皿(6穴プレート)に4~6×105個/ウェルでまく。
2)直鎖状プラスミドベクターとIR/MARプローブの遺伝子導入
リポフェクションをおこなう4~6時間前に培地を交換すると、導入効率が上がる。直鎖状プラスミド(1~2 μg)とIR/MARプローブ(1~2 μg)を混ぜて、添付のプロトコールに従い細胞へリポフェクションする。切断するプラスミドの量や、加えるIR/MARプローブの量を調節して、同一のプラスミドベクターにつき複数の、条件の異なるウェルを作っておくと、第11日目に発現株が全く得られないという結果になりにくい。
3)遺伝子導入細胞株の選択開始
トランスフェクション後24時間時点に10 cm培養皿1~2枚にまき込む。このときから、低濃度の選択マーカーを加える。IR/MARプローブにはブラストサイジン耐性遺伝子が含まれている。発現プラスミドベクターに含まれている耐性遺伝子(ピューロマイシン、ネオマイシン、ハイグロマイシンなど)とともに、遺伝子が導入された細胞株の選択を開始する。この際は、10 μg/mlのブラストサイジン、1 μg/mlのピューロマイシン、1 mg/mlのG418、50 μg/mlのハイグロマイシンと、通常用いられている濃度で加える。
トランスフェクション後48時間時点から、細胞に合わせて抗生物質の濃度を上げる。HEK293細胞とCHO細胞であれば、100 μg/mlのブラストサイジン、10~100 μg/mlのピューロマイシン、3 mg/mlのG418、200 μg/mlのハイグロマイシン等で選択する。また、HeLa細胞は10 μg/mlのブラストサイジン、3 μg/mlのピューロマイシン、1 mg/mlのG418、100 μg/mlのハイグロマイシン等、比較的低濃度で選択する。初めて実験を行うときは、これらの濃度をスクリーニングする。
4)限界希釈法によるクローニング(シングルコロニー取得のため96穴プレートへのまき込み)
トランスフェクション後7~10日程度で細胞がコロニーを形成してくる。各コロニーを形成する細胞数が、20~200個になった時点(トランスフェクション後10日前後)で、1ウェルあたり1細胞以下になるように96穴プレートにまき込む。細胞をまき込んでから5日目前後に培地を追加する。
5)定量的PCRまたはタンパク質の発現量の比較による細胞株の選択
任意の方法で目的タンパク質の発現量を定量し,取得する発現株を選択する。GFP融合タンパク質であれば、蛍光顕微鏡観察等で、培養容器のままで直接定量できるので便利である。分泌型タンパク質であれば、融合タグもしくは目的タンパク質そのものに対する抗体を用い、培養上清からのエライザ、表面プラズモン共鳴、ウェスタンブロットなどで定量を行う。
これらの方法は、培養している細胞を維持したまま行うことが可能であるため、選択・継代が容易である。上記以外の方法で発現株を選択する場合、シングルコロニーを含むウェルから、培養用プレート(96穴プレート、24穴プレート、6穴プレートなど検出の目的に合わせて)に一方を発現確認用に、一方を継代用に、分割して継代する。非分泌型タンパク質であれば、細胞ライセートを使ったウェスタンブロットによって,細胞表層に発現している膜タンパク質であれば、抗体を用いたフローサイトメトリーによって、適当な抗体がなければ、細胞ライセートを用いたmRNAの定量的PCRによって定量を行う。株を選択する際には、発現量が多いウェルから複数ロット選抜する。
6)選択された細胞株の増殖開始
選択した細胞株を、10 cm培養皿で増やす。100枚程度まで増殖させ、発現しているタンパク質の量を見積もる。
7)細胞ストック
タンパク質の発現量が、培養期間中維持されていることを、前述した方法で確認したのち、細胞のストック(6~12バイアル程度)を作る。
8)目的タンパク質の精製
10 cm培養皿50~100枚程度から精製する。精製されるタンパク質の量と、その生理活性を確認する。
工夫とコツ
本プロトコールを用いたタンパク質の大量発現
細胞培養のための施設が整っていれば、株式会社トランスジェニックより市販されているIR/MARプローブさえ入手すれば本方法をすぐに導入できる (3)。遺伝子導入から平均して2ヶ月程度で数ミリグラムの精製タンパク質が得られている。
クローンの選択
1細胞あたりの発現量が多い株よりも、増殖速度が速くウェルあたりでの発現量が多い株を優先的に選択している。長期培養における産生の安定性も考慮し、複数の株(2種類で十分である場合が多い)を選択すると良い。たとえば、αクロトータンパク質や、線維芽細胞増殖因子(FGF23)の場合では、シングルコロニーのスクリーニングは、1次スクリーニング終了時で約60%の陽性率、2次スクリーニング終了時で約90%以上の陽性率であった(図2)(4,5)。これらのタンパク質の場合をふくめて経験的に、3次スクリーニング以上繰り返しても、発現量が飽和していたため、2次スクリーニング終了時の細胞株を用いている。
プラスミドベクターの直鎖化
ゲノムDNAへの組み込まれる際に、組み込む遺伝子中で切断されるのを防ぐため、プラスミドを直鎖化しておくが、この際、組み込みたい部分から離れた部位を切断した方が、発現効率が高かった。一例をあげると、pcDNA3.1(+)ベクターの場合、NruI制限配列(CMVプロモーター領域より約30塩基対5’側)よりも、BglII制限配列(同領域より約220塩基対5’側)で直鎖化したときの方が、発現陽性率、および発現量ともに高かった。また、多くの発現ベクターでは大腸菌の複製開始点領域内にApaLI制限配列を持つため、プラスミドデザインの際にApaLI制限配列で他の部位が切れないように心掛けている。ちなみに、ApaLI制限配列(同領域より約490塩基対5’側)とBglII制限配列で直鎖化したものとの比較では、発現陽性率、および発現量ともに同程度であった。このことから、組み込みたい部分から、切断部位が約220塩基対以上離れていれば、高い発現陽性率や、発現量を得るのに十分であることが推し量られる (6)。
トランスフェクション
プラスミドベクター1 μgおよび2 μgを、制限酵素で切断して直鎖化する。プローブをそれぞれ1 μgおよび2 μg加え、同じプラスミドベクターで2ウェル分トランスフェクションする。複数の条件でトランスフェクションすることで、1週間かけた選択マーカーでの培養後に、コロニーがまったく得られないことを避ける。とくに初めての抗生物質や細胞を用いる場合など、細胞によっては耐性濃度が異なるため、複数の濃度で調製して選択培養する。
選択培地と細胞ストック
HEK293細胞では100 μg/mlのブラストサイジン、もしくは3.0 mg/mlのG418でも細胞は死滅しない。2次スクリーニングで確立された株であれば、10 μg/mlブラストサイジンのみでも発現量の低下はあまり見られないため、薬剤の消費量を抑えるためにも、それ以降の抗生物質濃度は低めに抑えると良い。ストックした細胞株1バイアルから培養させるのは、10 cm培養皿500枚未満までなどと、継代を多数回繰り返さないことで、毎回安定したタンパク質量を得ることができる。
タンパク質の生理活性
本プロトコールで作製した細胞株から得られるタンパク質の生理活性を、リポフェクションなどで一過性過剰発現して得たタンパク質のそれと比較した(図3)(4,5)。細胞質タンパク質、1回膜貫通型タンパク質、4回膜貫通型タンパク質、7回膜貫通型タンパク質、分泌型タンパク質において、これまで試した限り、どちらの方法でも同等の生理活性を有している (7)。
実験の安全
人体に毒性があるため、高濃度の選択マーカー(ブラストサイジン、G418、ピューロマイシン、ハイグロマイシンなどの原液)を扱う際には手袋を用いる。
文献
- 株式会社トランスジェニックホームページ:http://www.transgenic.co.jp/products/antibodies-service/protein.php
- 前田良太ら, 細胞工学, 30, 252–9 (2013)
- Shimizu N., Cancer Res., 61, 6987–90 (2001)
- Maeda R., Contrib. Nephrol., 180, 25–46 (2013)
- Tomiyama, K. et al., PNAS, 107, 1666–71 (2010)
- 浅野竜太郎, 蛋白質科学会アーカイブ, 2, e050 (2009)
- 橋口隆生ら, 蛋白質科学会アーカイブ, 1, e017 (2008)
-
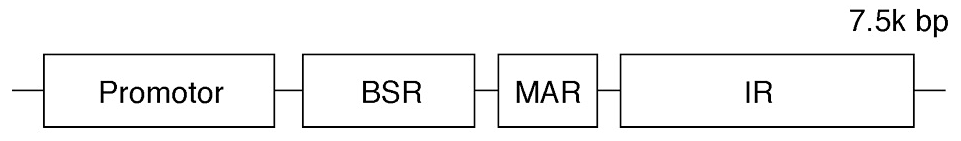
図1:IR/MARプローブの構造
BSR:E coli由来ブラストサイジン性遺伝子(ブラストサイジンSデアミナーゼ)。MAR:マトリックス結合領域。IR:ほ乳動物の複製開始点。なお、このDNAプローブを株式会社トランスジェニックより購入する際には、下記のライセンス契約事項を締結する。- 本試薬の使用は、購入者の自施設内での研究の目的に限る。
- 本試薬を複製、第三者に譲渡、配布、再販してはならない。
- 本試薬を用いて得られた発現細胞、産生蛋白質等の成果物の知的財産権は購入者に帰属する
- 本試薬を用いて得られた発現細胞、産生蛋白質等の成果物を商業利用する場合は、別途、株式会社トランスジェニックとの間に商業ライセンス契約を締結する。
-

図2:発現プラスミドベクターとIR/MARプローブのトランスフェクションから、タンパク質の精製までに要する各段階での一般的な期間。スクリーニングに要する日数(培養上清のエライザなら1日、細胞ライセートのウェスタンブロットなら7日など)により異なるが、約2ヶ月程度で数ミリグラムの精製タンパク質が得られる。 -
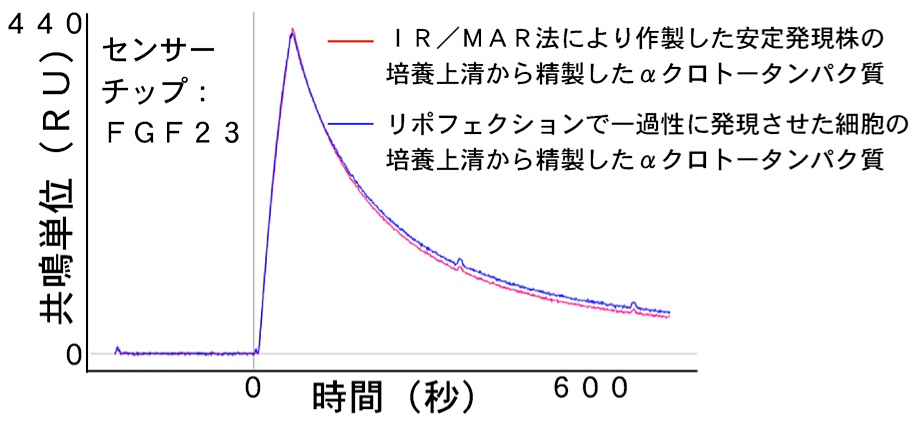
図3:本方法で作製したタンパク質の生理活性と、リポフェクションで得られた同一タンパク質のそれとの比較。ヒト分泌型αクロトータンパク質を上記の2つの方法で精製した。線維芽細胞増殖因子(FGF23)との結合を、プロテオン表面プラズモン共鳴法で測定し比較した。FGF23をセンサーチップに垂直方向に貼付け、等濃度の2種類のαクロトータンパク質を水平方向から流路に2分間加えた。プロテオン表面プラズモン共鳴(SPR)測定装置を用いた、多検体SPR法は、同一条件のセンサーチップで最大6種類の検体を、再生することなく比較することができる。RU:Resonance units。


