概要
超遠心分析法は1920年代にSvedbergにより開発された手法であり、遠心力場における粒子の沈降挙動から分子量や分子形状を解析する手法である(1)。その後1970年代半ばまでにSchachman、Williams、Yphantis、van Holdeらがタンパク質などの生体高分子の測定手法と解析法を発展させた(2,3)。また超遠心分析の数学的な取り扱いは藤田らにより発表され、現在でも解析の際に利用されている。市販の装置は1947年にSpinco社(Beckman社)から分析用超遠心機Model-Eが最初に発売され、最も盛んな時期には日立製の装置も含めると日本にも約100台の装置が設置されていた。しかしながら、1980年代頃からSDS電気泳動やゲル濾過法の台頭により超遠心分析法が利用されることが急激に少なくなった。1990年代に入り、Beckman Coulter社からModel-Eの後継機であるXL-AとXL-Iが発売され、再び使用されるようになった。こうした超遠心分析装置の歴史については、既に執筆された文献を参考にされたい(5,6)。更に、近年はコンピューターの発展に伴い数値解析が可能となったため、従来は難しかった沈降挙動の直接解析がDemelerやSchuckらにより実現され、一層頻繁に用いられる機会が増えてきた。超遠心分析の理論は熱力学および流体力学に基づく厳密なもので、解析に際しての仮定が少なく、分子の溶液中での物性解析において極めて有効な手法である。ただし、濃厚溶液や複数の構成要素からなる系の解析の場合には一般的な超遠心分析の理論式(希薄溶液中における分子の挙動に関する式)は成立しない場合が多く、慎重な判断が必要となる。
超遠心分析には沈降平衡法と沈降速度法があり(図1)、それぞれ特徴があり溶液中の分子の物性について多数の情報が得られる。具体的には、溶液中における平均分子量(分子量数百~150 MDa程度の範囲)、分子形状(流体力学的形状)、分子量分布、分子間相互作用の程度(解離会合定数、ビリアル係数)が解析可能である。本プロトコルでは超遠心分析から適切な結果を得るために必要なポイントを論ずるとともにそれぞれの測定方法について述べる。なお、解離会合定数の決定など分子間相互作用解析のプロトコルは別の稿に記載する。
超遠心分析装置にはBeckman社製Model-E(1947年~)、Beckman Coulter社製XL-A(1991年~)およびXL-I(1995年~)、日立製282型が存在する(図2)。これらの装置の基本的な測定原理、装置制御や測定光学系は同じであるが、XL-AとXL-Iは装置制御およびデータ取得の部分が高度に電子化およびコンピューター化されており、駆動部や温度の安定性、測定可能濃度範囲、再現性、そして操作の簡便さの面で優れている。測定セルの構成や形状は以前からほとんど同じで、Model-EのセルはXL-AやXL-Iでそのまま用いることが出来る。XL-AとXL-Iの違いは、XL-Aでは紫外および可視領域(現実的には225 nm~700 nmの範囲)における吸光度からセル中の各位置における溶液中の分子の濃度を測定する “UV光学系” のみを有するのに対し、XL-IではXL-Aと同様のUV光学系に加え “Rayleigh(レイリー)干渉光学系“ を有している点である。レイリー干渉光学系では、1つの光源から発した光は2つのスリットを通過した後に干渉縞を形成する性質と溶液の屈折率は溶質の濃度に比例する(dn/dcは一定)性質を利用し、セル中の溶質濃度の変化を干渉縞の移動度として測定する。一般に溶液の屈折率は溶質の濃度変化に対してそれ程大きくは変化しないため、レイリー干渉光学系は高い濃度での測定に適している。また、解析対象が紫外可視領域に吸収を持たない場合や、溶媒中に大きな吸収を持つ低分子化合物(ATPや酵素のインヒビターなど)が存在する場合にも有効である。ここでは、タンパク質の測定で用いられることが多いXL-Aを用いる場合を中心に解説する。
なお、超遠心分析の原理、詳細な解析理論については優れた書籍が複数ある(7–12)ので、こうした文献をご参考頂ければと思う。
実験手順
- <セルの組み立てから3000 rpmでの測定まで(沈降平衡法・速度法共通)>
- セルの組み立て準備
- セルの組み立て
- サンプル準備およびセルへの注入
- セルのローターへのセット
- ローターおよび分光器の装置へのセット、3000 rpmでの測定
- 3000 rpmの測定結果における確認事項
- <沈降速度法の測定と解析>
- 沈降速度法の測定
- 沈降速度法の解析
- <沈降平衡法の測定と解析>
- 沈降平衡法の測定
- 沈降平衡法の解析
実験の詳細
1. セルの組み立て準備(図3参照)
解析を成功へと導くためにはきれいなセルを組み立てることが重要である。洗浄のためにウィンドウを洗剤等の液体に浸している場合は、ウィンドウを水道水で洗った後、精製水、アルコールで洗う。ウィンドウを丁寧に拭き、汚れやゴミが付着していないことを確認する。特に手の皮脂による汚れはつきやすいので注意する。センターピースもウィンドウと同様に使用する前に十分水道水で洗った後、精製水、エタノールで洗う。センターピースには、多くの種類があるが、42,000 rpmまでの実験であればチャコールエポンまたはアルミニウムエポン製のダブルセクターセンターピースを使用する。さらに高回転(42,000 rpm以上)の場合にはアルミニウム製のセンターピースを用いる。従って、沈降平衡法の場合にはエポン製センターピースを用いる場合がほとんどで、一方、沈降速度法では沈降係数(\(s\) 値)が小さい分子の場合にはアルミニウム製のセンターピースを、\(s\) 値が大きい場合にはエポン製のセンターピースを用いることが多い。その他、合成界面セル、同時に複数の試料測定が可能な6穴セルなど幾つか異なるセンターピースが販売されているので目的に応じて使用する。
2. セルの組み立て(図3参照)
今回のプロトコルでは通常最もよく用いられるダブルセクターのセンターピースを用いる場合について記述する。まず、センターピースを両側から挟むウィンドウアセンブリを以下の手順で組み立てる。ウィンドウホルダーに白色(透明の場合もある)なガスケットを入れる。次にウィンドウライナーをセットする。ウィンドウライナーの円の切れ目は、ウィンドウホルダーの外側にある溝と反対に位置するようにする。引き続いて、ウィンドウをセットする。ウィンドウの表面には線で印が刻んである面があるので、印のある面を手前にして、印がウィンドウホルダーの外側の溝に位置するようにセットする。なお、ウィンドウ面の向きは逆でも良いが、実験毎に同じ向きでセットする方が好ましい。
組み立てたウィンドウアセンブリのうちの一方について、ウィンドウ面を触らないように、ウィンドウ面を上にして、セルハウジングの溝にそってセットする。次にセンターピースをセットする。エポンタイプのセンターピースであればそのままセットすれば良いが、アルミのセンターピースを用いる場合には上下に専用のガスケットをセットしたのちセットする(ガスケットをセットしないと確実に液漏れを起こす。図3)。なお、センターピースがセルハウジングに入りにくい場合にはセルアライングで押す。次に、もう一つのウィンドウアセンブリをウィンドウ面を下にセットする。茶色のスクリューワッシャの片面にスピンコート潤滑油を極少量塗り、塗った面を上にしてセットする。最後にスクリューリングをOUTと書いてある面を外側になるようにセットし、まずはセルアライングを用いて手で締める。次に専用のトルクレンチを用い、120 inch-poundで締める。
3. サンプル準備およびセルへの注入
ダブルセクターのセンターピース(12 mmタイプ)であれば、沈降速度法は400 μL、沈降平衡法では最低100 μLの試料を用いる。なお、セルの容量は450 μLである。沈降速度法も沈降平衡法の場合も、対照液は試料よりわずかに多い液量(通常は10 μL多い液量)を注入する。セルに試料を入れる際にセンターピースの表面を傷つけないよう十分気をつける。なお、セルの注入にはGel loaderなど先端が長いチップを用いると良い。スクリューリングを手前にセルを置く。このとき左側の注入口から対照液を、右側の注入口から試料を入れることになる。まず対照液を注入し、注入後に対照液が漏れていないかセルを見て確認する。試料側に液が漏れている場合にはすぐに判断できるが、この場合にはセルを組み直すこととなる。次に試料を注入する。それぞれの注入口にプラグガスケットをのせ、ハウジングプラグをマイナスドライバーで締める。このときにプラグを締めすぎるとセンターピースの形状がわずかに変形し漏れやすくなる。一方、締め方が弱いと液漏れしやすく、適度な締め具合となるようにする。
4. セルのローターへのセット
ローターには4穴のAn-60Tiと8穴のAn-50Tiがある。どちらのローターの場合にも、測定時に位置校正のためのカウンターバランスを1つ入れる必要がある。従って同時にセットできるセルの数はAn-60Tiでは3つ、An-50Tiが7つである。測定可能な最大回転数はAn-60Tiが60,000 rpm、An-50Tiが50,000 rpmである。セルの1つ(An-60Tiの場合は2番の穴にセットするセル、An-50Tiの場合は4番の穴にセットするセル)とカウンターバランスの重さをアンバランスが0.5グラム以内になるようにカウンターバランス用の錘を用いて調整する。次にカウンターバランスを矢印が外側を向くようにAn-60Tiの場合は4番、8穴のローターの場合は8番の穴に入れる。試料を入れたセルを、試料の注入口がローターの中心に向くようにセットする。ローターを下からのぞき(またはローターの下に鏡を置き)、セルの底面にある印とローターに刻んである印が正確に一致するようにセルアライングを用いて向きを微調整する。カウンターバランスについても同様に向きを微調整する。カウンターバランスのねじを締め固定する。
5. ローターおよび検出器の本体へのセット、3,000 rpmでの測定
本体の電源を入れ、ローターを本体にセットする。検出器をセットする。検出器側の端子が本体側の穴に確実にはまったことを確認してからLOCKの矢印の方向に回し、検出器を固定する。このとき、少しねじが硬く感じるときに無理してねじ込むと接続部のネジ山を破損するため注意が必要である。検出器がぐらついていないことを確認する。ローターを手で軽く回転させ検出器とローターが接触しないことを確認する。本体のふたを閉め、バキュームボタンを押す。
沈降速度法または沈降平衡法の測定にあたっては、まず3,000 rpmで試運転を行って液漏れ等の異常がないことを確認する。回転数(3,000 rpm)、測定を行う温度を設定(0~40℃で設定可能である)する。なお、3,000 rpm以下であれば、真空度に関わらずローターは回転し、測定が可能である。一方、3,000 rpmより高速の場合には真空度が50 mPa以下にならないと加速が始まらず、一定の真空度に達するまで回転数が3,000 rpmに自動的に維持され、所定の真空度に達した後に加速が始まる。
遠心条件に関する設定は遠心機本体の操作パネルからもXL-A(XL-I)制御ソフトウェアからも可能である。測定に際してコントロールソフトウェア上でそれぞれのセルについて設定する。試料を入れていないセルについては、測定する必要がないのでチェックをはずしておく。すべてのセルについてセル1と同一の設定内容とする場合には、“All Settings Identical To Cell 1” のチェックボックスをチェックすれば良い。またセル毎に異なる設定をする場合にも、このチェックボックスにチェックを入れた後、各セルの試料名や測定条件等を個別に変更すると便利である。
ダブルセクターセルを用い、280 nmの吸収を利用して測定を行う場合には、まずは5.9~7.25 cm(400 μLの試料を用いた速度法を行う場合)または6.7 cm~7.25 cm(100 μLの試料を用いた平衡法を行う場合)の範囲でContinuousモード(Stepモードでも良い)、ステップサイズ0.001 cm(0.003 cmでも構わない)でラジアルスキャンを実行する。この3,000 rpmのスキャンの際にOptionのRadial calibrationのチェックボックスをチェックし、位置校正を行うと良い。
6. 3,000 rpmのデータにおける確認事項
得られたデータにおいて、以下の全てが満たされていれば、サンプルは適切にセットされ、沈降平衡または沈降速度測定のための準備が整った状態であるといえる(図4参照)。
① 溶媒-空気のメニスカス、下に凸(溶媒の液面での光の乱反射による)が観測されているか?
② 溶媒-溶液のメニスカス、上に凸(溶液の液面で光の乱反射による)が観測されているか?
③ セットした溶媒と溶液の量を反映した結果となっているか(スキャン0.1 cmは約30 μL程度に相当する)?
④ ①と②の間隔がセットした溶媒と溶液の液量の差を反映しているか?
⑤ セル底(7.15 cm付近)部分での吸光度の急激な変化(セルの底)が観測されているか?
⑥ セットした溶液の吸光度(超遠心分析の前に分光器で測定しておく)と観測された吸光度(比較の際は12 mmでの値に換算すること)は一致しているか?
⑦ 溶媒そのものに吸収がないか(2つのメニスカスの間の吸光度から判断できる)?
7. 沈降速度法の測定
3,000 rpmでの測定の後、沈降速度測定を開始する。ただし、一定温度での正確な測定のためにはチャンバー内が十分に減圧され、ローターの温度が十分に一定となるまで待つことが重要で、温度が一定になった後に加速を開始し測定を行う。もし、3,000回転で沈降してしまうような大きな成分がある時は一度セルを取り出し振って溶液を均一にしたのち、0 rpmでEnterボタンを押し、真空度表示が0になり温度が安定したら目的の速度で測定を開始する。沈降速度法から得られる情報は沈降係数 \(s\) と拡散係数 \(D\) であり、これらの数値から分子形状、分子量を得ることが出来る。複数成分の混合系の場合でも、各成分間の交換速度が遅ければ、解析により各成分について同様の情報が得られそれぞれの存在比も知ることができる。
回転数は分子量、成分数によるが、可能な限り速い回転数でありながら多くのスキャンが取得できる回転数とする。まずは、最高回転数である60,000 rpmで4~5分間隔で測定を行い、もし40–50スキャン分のデータが取得できなければ(40–50スキャン分のデータを取得する前に分子の沈降が完了するようであれば)一度回転を止め、セル中が均一になるように振り、低い回転数に設定して、再び測定を行う。60,000 rpmにおいてContinuousモード、Step0.001 cm間隔で400 μLの溶液全体をスキャンするには1セルあたり約2分を要する。測定時間が経過する(スキャンが進む)につれて吸光度がほぼ0のベースライン領域(図4を参照)が観測される一方でプラトー領域(吸光度一定の部分)も観測されているスキャンを出来るだけ多く取得できる回転数が好ましい。また、界面の勾配が急すぎると適切なデータが得られない場合があるので、分子の拡散が遅い場合は、拡散の広がりがモニター可能な低い回転数で沈降させる。
8. 沈降速度法の解析
本プロトコルではIgGを対象に沈降速度実験を行った例を用いて説明する。pH 6.8で保存していた試料AとpH3.0にて酸処理を行った後、pH 6.8に溶媒を置換した試料Bの2つの異なる試料についての測定結果(図5)を用いた。
理想溶液中の分子の沈降挙動は、以下のLamm方程式によって示される。
\[\left( \frac{\partial C}{\partial t} \right) = - \frac{1}{r} \cdot \frac{\partial}{\partial r} \left\{ \left[ sr\omega^{2}C - Dr \left( \frac{\partial C}{\partial r} \right) \right] \right\} \tag{1}\]ここで、\(s\) は沈降係数、\(D\) は拡散係数である。また、\(r\) はローターの中心からの距離、\(C\) は分子の濃度である。なお、\(s\) と\(D\) は
\[\begin{align} s &= M(1 - vbar\rho) / Nf \tag{2} \\ D &= RT / Nf \tag{3} \end{align}\]で表される。ここで \(M\) は溶質の分子量、\(vbar\) は溶質の偏比容、\(\rho\) は溶媒の密度、\(f\) は摩擦係数、\(R\) は気体定数、\(T\) は測定温度、\(N\) はアボガドロ数である。従って、\(s\) 値は溶質の分子量に比例し、摩擦係数に反比例する。\(D\) は温度が一定であれば摩擦係数に反比例する。なお、摩擦係数は分子の大きさと形状によって変化し、分子が大きくなる(球体の場合には半径が大きくなる)と増加し、球体よりも楕円体や棒状分子の方が大きい値を持つ。
Lamm方程式は質量保存の条件下での分子の遠心力による流れと拡散による流れから導出される微分方程式であるが、一般解は存在しないことが知られている。しかしながら、沈降速度法の解析は工夫された方法がいくつも提案されている。ここでは近年良く用いられ、有効な解析結果を与える以下の解析法を紹介する。
- (Enhanced)van Holde–Weischet法(図6)-セル内の複数の位置における \(s\) 値の時間変化(\(t^{-1/2}\))をプロットし、\(s\) 値の分布を得る。移動境界面の広がりは拡散と不均一性に由来するが、このプロットによりこの2つを分離することが出来る。従って、溶質の均一性が簡便に判断できる。また、\(s\) 値の大まかな上限と下限を知るためにも最初に行うと良い。
- time-derivative(DC/DT)法(図7)-ごく短い時間範囲における沈降パターンの差分をとり \(s\) 値と \(D\) 値を求める。ウィンドウのキズ等など特定の位置におけるノイズの影響を受けにくい解析法であるが、多成分系にはあまり向いていないこととC(s)および2DSA解析の発展により用いられることが少なくなった。
- C(s)解析(図8)-各時間における沈降パターンに対してLamm方程式を用いた数値解析を行い \(s\) 値と \(D\) 値を得る。また、分子量や分子形状も同時に得られる。この方法は複数成分が混在する場合には複数成分に対してそれぞれの解析値と存在比を与えるため分散度解析が可能である。ただし、C(s)解析では各成分の形状因子(\(f/f_{0}\)、\(f\) は溶質分子の摩擦係数、\(f_{0}\) は同じ分子量と偏比容を持つ仮想球状粒子の摩擦係数で \(f/f_{0} = 1\) であれば球状粒子であることを示し、これより大きい場合は球状からずれて長細いまたは扁平な粒子を意味する。図9)を同一として扱う。各成分の分布は \(f/f_{0}\) の影響を受けにくいため分布解析においてしばしば用いられるが、形状が異なる成分を同一として取り扱う事による誤差が生じる場合も報告されている。
- 2DSA解析、GA-MC解析法(図10)-C(s)解析と同様、各時間における沈降パターンに対してLamm方程式を用いた数値解析を行い \(s\) 値と \(D\) 値を得る。数値解析は有限要素法を利用した二次元スペクトル解析(2DSA)、遺伝的アルゴリズム-モンテカルロ(GA-MC)解析があり、何れも最適解を得るための手法である。これらの解析法では各成分の形状因子(\(f/f_{0}\))を別々の値として取り扱うため、計算量が膨大であるが、マイナー成分の解析などで特に威力を発揮する。複数のアルゴリズムを用いて解析を行うことで信頼性の高い結果が得られる。
単一成分であればどの解析手法を用いても概ね良好な解析結果が得られる。類似の \(s\) 値を持つ成分を多数含むような場合(クロマチンなど)にはvan Holde–Weischet法が有効である。
簡単なvan Holde–Weischet法とtime-derivative法による解析は、ベックマンコールター社の解析ソフト(Origin,XLI/XLA Data Analysis Software)により可能である。C(s)解析、Enhanced van Holde–Weischet法、2DSA解析法などはSedfitあるいはUltrascanといったフリーソフトを利用する。ただし、複数の成分が混在する場合には、どの解析法を用いるとしても得られた解析結果についての慎重な検討が必要であり、特に存在比率が小さい成分の解釈には注意が必要である。例えば、プラトー部分はノイズによる影響を受けやすく、本来は存在しないピークを生み出す事がある。また、\(s\) 値が小さい分子の場合には十分に沈降することなく拡散しベースラインが観測されない結果となるため、\(s\) 値等を得るためにはLamm方程式を用いた数値解析を行うこととなる。
9. 沈降平衡法の測定
3,000 rpmでの測定の後、沈降平衡測定を開始する。回転数は分子量、成分数によるが、10,000–30,000 rpmで行うことが多い。濃度ゼロのベースライン領域を形成させるmeniscus depletion法の場合にはより高回転での実験となる。
十分な時間が経過すると平衡に達し濃度勾配が形成される。この濃度勾配は分子にかかる遠心力(\(F_{C}\))と拡散力(\(F_{D}\))との釣り合いに従った勾配であり、分子の形状には依存しない。
\[F_{C} = F_{D} \tag{4}\]遠心力と拡散力は以下の式で表される。
\[\begin{align} F_{C} &= M(1 - vpar\rho)r\omega^{2} \tag{5} \\ F_{D} &= \frac{\partial \mu (r)}{\partial r} \tag{6} \end{align}\]ここで \(\mu\) は \(r\) の位置における溶液の化学ポテンシャルであり希薄溶液であれば、
\[\mu = \mu^{0} + RT \ln c(r) \tag{7}\]である。ここで、\(\mu^{0}\) は標準化学ポテンシャルである。式7を式6に代入し式4の釣り合いの式を解くことで、以下の溶質の濃度勾配を表す式が得られる(図11参照)。
\[\begin{align} A(r) &= A(r_{0}) \exp [ M_{w,app}H(r^{2} - r_{0}^{2}) ] + baseline \tag{8} \\ H &= (1 - vbar \rho) \omega^{2} / 2RT \tag{9} \end{align}\]ここで、\(r\) はローターの中心からの距離、\(A(r)\) は \(r\) の位置での吸光度、\(vbar\) は溶質の偏比容、\(\rho\) は溶媒の密度、\(\omega\) は角速度、\(R\) は気体定数、\(T\) は測定温度である。また、\(r_{0}\) は濃度勾配中の任意の位置(固定値)である。実験で得た濃度勾配を式8を用いて解析することで溶液中での分子量が得られる。また、平均分子量(数平均分子量、重量平均分子量、Z平均分子量)の他に、解離定数(解離会合系の場合)、ビリアル係数(非理想系の場合)などを得ることが可能である。ただし、ある測定濃度の溶液の沈降平衡から得られる分子量は、その測定濃度における見かけの分子量(\(M_{w,app}\))である。一般にタンパク質などの高分子は分子間相互作用の影響により見かけの分子量は濃度に依存する。従って、異なる濃度で見かけの分子量を測定し、見かけの分子量を濃度ゼロへ外挿することで分子量を得ることになる。また、濃度依存性から相互作用力(解離会合定数やビリアル係数)が得られる。
なお、解離会合定数やビリアル定数を含んだ式を用いて濃度勾配に対して直接非線形フィッティングを行う相互作用解析も可能である。
沈降平衡法では最低でも3点の異なる濃度の試料について測定を行う(図12)。3点の濃度は可能な限り大きく異なる濃度とすると良い。
沈降平衡に適した回転数は予想される分子量に基づいて設定するが、原則的には溶液の濃度が最も薄い部分(溶媒-溶液メニスカスの右側)とセル底の濃度比が3倍以上となるようにする。測定開始後、一定時間(測定温度や分子量にもよるが数時間)が経過した後の濃度勾配が、小さい(大きい)場合には平衡に達するのを待たずに設定回転数を高く(低く)なるように設定を変更する。解離会合系の場合などは、濃度比が大きい(勾配がきつい)濃度勾配を形成させると、より精度の高い解析が出来ることが多い。なお、最低でも2種類以上の異なる回転数で測定を行い測定結果が一致するか確認することが好ましい。
目的の回転数に達した後、2時間毎に測定を行い6~8時間前の濃度勾配と変化がないことを確認する。測定回転数や測定間隔は装置のコントロールソフトのMethod Scan設定ファイルにより設定可能である。なお、装置の波長再現性を考慮すると、平衡に達するまでは測定に用いる設定波長を1波長に限定し、波長の変更は行わない方が良い。濃度勾配が平衡に達したかどうかは付属の解析ソフトを用い、2つのデータの差をとることにより判別できる。最新のデータから2時間前、4時間前、6時間、および8時間前のデータを差し引いた場合に系統的な変化が確認される場合には平衡に達していないと判断できる。平衡に達するまでの時間は拡散速度によって決まり、温度が低い場合、分子量が大きな(拡散係数が小さい)分子の場合、あるいは溶媒粘度が高い(溶媒にグリセロールなどが添加されている)場合など、は長い時間が必要である。平衡への到達が確認できたら、各セルについて可能な限りノイズが少なく、ラジアル方向のステップが詳細なデータをステップスキャンにより取得する。積算回数は各装置のS/N比によって異なるが、一般に8~16回程度の積算を行えば解析に適したデータが得られる。一般の分光器と同様、吸光度が高すぎると検出器(この場合フォトマル)が飽和する。従って、測定波長と装置の状態により異なるが、概ね吸光度1.2~1.5程度を測定の上限とすることが好ましい。
10. 沈降平衡法の解析
各濃度での見かけの分子量(\(M_{w,app}\))を求める。いわゆるグローバルフィッティングを最初から行うと、濃度変化や回転数変化に伴う分子の挙動の把握が難しくなるので、最初から行うことはお薦めしない。各濃度で得られたデータに対して式8を用いた非線形フィッティングにより \(M_{w,app}\) が得られる(図12、13、14)。\(vbar\) と\(\rho\) は計算または密度測定等により得られ、その他の数値は測定時の設定値であるから、\(H\) は定数となる。従って、\(A(r_{0})\)、\(M_{w,app}\) および \(baseline\) を未知数としたフィッティングとなる(図11左)。この解析は装置に標準で添付のOrigin, XLI/XLA Data Analysis Software以外にも、KaleidagraphやOrigin等の非線形フィッティングが可能なプログラムであれば大抵は可能である。筆者は沈降平衡の解析は、解離会合系を含めて理論式との比較が理解しやすいMathematicaを用いて行っている。溶媒に吸収が無ければ \(baseline\) はほぼゼロになるはずである。また、平衡時での濃度勾配を測定後に可能な限り高い回転数に設定し溶質を沈降させることにより \(baseline\) を実験的に求めることも可能であり、解離会合系の解析などより高い精度が要求される場合には有用である。
濃度に対して各濃度の見かけの分子量の逆数(\(1/M_{w,app}\))をプロットし、\(1/M_{w,app}\) の濃度ゼロ外挿から平均分子量 \(M_{w}\) を得る(図13、14、15)。このプロットで \(1/M_{w,app}\) が濃度の増加に伴い増加する(右上がり)の場合は非理想的挙動を示す系であり(勾配が第二ビリアル係数である、図15左)、逆に \(1/M_{w,app}\) が濃度の増加に伴い減少する(右下がり、図15右)の場合には解離会合系であると判断できる。
なお、各濃度での濃度勾配からフィッティング結果の濃度勾配を差し引いた残差プロットが、非理想的挙動を示す試料の場合には上凸になる。一方、解離会合系、または不可逆であっても異なる分子量を持つ複数の分子を含む混合系の場合には残差プロットが下凸になる(図11)。これは半径が大きくなると濃度が上昇するために解離会合系であれば会合状態の分子の割合が増えるためである。
以上は、複数の回転数で濃度勾配を取得し、各データに対して解析を行い、総合的に判断するのが良い。
別の稿に記載するが、解離会合系の場合には、複数濃度および複数回転数での濃度勾配データに対して同時に非線形フィッティング(グローバルフィッティング)を行うことにより、解離定数などの数値を得ることができる。
工夫とコツ
ウィンドウについて
ウィンドウにはサファイアと石英の二種類がある。サファイアウィンドウは強度が強く割れることはまず無いが石英は遠心中に割れることがある。レイリー干渉光学系による測定では、歪みが生じにくいサファイアウィンドウを使う。一方、UV吸収による測定の場合には石英ウィンドウでもサファイアウィンドウでも構わないが、サファイアウィンドウを用いる場合には230 nm付近より短波長側にウィンドウ自身が吸収を持つことに注意する。
センターピースについて
センターピースの汚れがひどいときは中性洗剤を加え超音波洗浄機で洗浄しても良い。 ベックマンコールター社以外にもセンターピース等を販売している会社があるが、そうした製品を用いた測定により装置の故障や事故が生じた場合にはメーカー保障の適用外となるので各自で注意が必要である。また、センターピースの強度や薬品耐性(Chemical Resistance)についてはベックマンコールター社のウェブサイトに情報があるので、そちらを参考にされたい。
溶媒の塩濃度について
超遠心分析の解析では、溶質分子にかかる拡散力、遠心力および摩擦力(速度法の場合)に基づいた解析式により行う。もし、分子が無視できないほどの電荷を持ち、静電反発を生じる、あるいはセル内に電気的な勾配を生じる状況になると解析は極めて複雑になる。そのため、溶媒に最低でも50 mM以上(100 mM以上が好ましい)の塩を添加し、分子表面の電荷を遮蔽し分子間の静電反発を低減させた条件で測定を行うことが必要である。
溶質の偏比容(\(vbar\))と溶媒密度について
超遠心分析の解析では溶質の偏比容と溶媒密度が必要である(式9参照)。タンパク質の場合構造変化に伴う偏比容の変化は微小である場合が多いため、アミノ酸組成とCohnとEdsallによる各アミノ酸の偏比容の値を用いて、計算により偏比容を精度良く推定することが可能である(13,14)。また、溶媒密度は溶解している塩やバッファーの値に基づいて推定可能な場合が多い。SEDNTERP(15)やULTRASCANではタンパク質の偏比容や溶媒密度を推定できる。これらのプログラムではアミノ酸構成や溶媒組成を入れれば機械的に推定値が得られるが、基本的には構成要素の重量平均から推定しているシンプルな内容でありエクセル等を用いても数値を得ることは可能である。偏比容や密度について理解を深めるためにも一度は各自で数値を求めてみることをお薦めする。なお、\(vbar\) は解析の際に \(1 - vbar\) として効くため、例えば0.73 cm3/gと0.72 cm3/gの場合を比べると、\(vbar\) の差は約1.4%であっても分子量は約3.7%の差となる。従って、より正確な解析には振動式密度計を用いて実測を行い、正確な数値を用いることが望ましい。また、解析対象のタンパク質が糖鎖修飾を受けている場合なども実測により偏比容を求める必要がある。
測定波長の選択について
超遠心分析では吸光度と濃度との間に直線関係があれ(Lambert-Beer則が成立していれ)ば、測定波長は溶液の濃度にあわせて決めればよい。ただし、Xeランプの強度が低い波長ではS/Nが高いデータが得られないので注意が必要である。一般にタンパク質の吸光スペクトルは280 nm付近に吸収ピークを持つが、これはトリプトファン、チロシン、フェニルアラニン、S-S結合の吸収による。しかしながら構成アミノ酸にこれらのアミノ酸が少ない場合には、280 nm付近ではほとんど吸収が観測されない。そういったタンパク質の測定には230 nm付近から立ち上がるペプチド結合による吸収が利用できる。また、濃度が低い(薄い)溶液の場合にも、230 nm近辺での測定が有効である。ただし、230 nmで測定を行う場合には、230 nm付近より短波長に大きな吸収を持つTris、酢酸系バッファーなどは使用できない。リン酸系バッファー、MOPS、MES等は比較的吸光度が小さいため利用できる。また、280 nmでの測定の場合でも還元剤存在下での測定の場合には注意が必要である。DTTなどは酸化に伴い吸収を持つため、特に長時間測定を行う沈降平衡法での使用は避ける方がよく、かわりに吸収が小さいTCEPを用いる方が良い。
適切な波長の選択のために測定前に分光器で吸収スペクトルを測定しておくことが望ましいが、装置内で吸収スペクトルを測定することも可能である。沈降速度法の場合、超遠心機にセルをセットした後、3,000 rpm、7.0 cm付近で波長スキャンを実行し、吸光度が1.0付近となる波長を実験的に求め、その後その波長でのラジアルスキャンを行う。沈降平衡法では、平衡到達後にセンターピースの底に近い部分(7.10~7.15 cm付近)で波長スキャンを行い、この付近での吸光度が最大でも1程度となるような波長を実験的に求め、その波長でラジアルスキャンを行う。
真空ポンプについて
沈降係数は温度に敏感であるので測定は温度一定のもとで行う必要がある。一方、大気圧条件で高速遠心を行うと、遠心ローターと空気の衝突により温度が上昇する。分析用超遠心機では、真空ポンプを用い真空度を高め、ペルチェ素子を用いて温度制御を行っている。真空度は自動的に制御されており特に設定を行う必要はないが、真空制御について簡単に説明を記載する。最初にロータリーポンプ(RP)により100 mPa程度まで減圧(粗引き)され、その後オイル拡散ポンプ(DP)が加熱され1 mPa以下にまで減圧される。DPはオイルを加熱しジェット状の拡散オイル蒸気を発生させ、空気中の分子を捕捉して真空度を達成する。測定が終了し回転数が0 rpmになってもすぐにチャンバーの蓋を開くことが出来ないのは、DPのオイルの温度が十分に下がるまで装置が蓋をロックしているためである(もし、オイルが十分に冷却されないまま大気圧に戻るとチャンバー内にオイルが拡散する)。しかしながら、多少のオイルが残りチャンバー内が汚れる事が多くあるので可能な限り頻繁にチャンバー内をペーパータオル等で拭くと良い。
なお、装置のVacuumボタンを押しただけではDPの加熱は起こらず、真空度表示が0になるまでの減圧は出来ない。回転数0 rpmあるいは3,000 rpmを入力しEnterを押し、しばらく待つと真空度表示が0になるまで真空度を高める事が出来る。
レイリー光学系について
高濃度溶液や溶媒中に大きな吸収を持つ低分子化合物(ATPや酵素のインヒビターなど)が存在する場合にも有効であるが、測定に用いる溶媒(センターピースの溶媒側に用いる対照液)は透析外液またはゲル濾過の溶出液など、溶液と化学ポテンシャルが釣り合っている溶媒を用いる必要がある。
\(s_{w,20}\) と \(D_{w,20}\) について
\(s\) 値や \(D\) 値は溶液濃度、溶媒密度、溶媒粘度、温度等に依存するため、異なる条件での実験の結果の比較はそのままでは出来ない。特定の溶媒条件で得られたみかけの \(s\) 値や \(D\) 値を20℃の水中での値である \(s_{w,20}\) と \(D_{w,20}\) に換算し、評価に用いるまた、論文等には \(s_{w,20}\) と \(D_{w,20}\) を掲載するのが一般的である。解析手法および解析ソフトによっては見かけの \(s\) 値や \(D\) 値を与えるので、得られた数値が見かけの数値なのか20℃の水中での値であるか注意が必要である。SedfitやULTRASCANは測定条件を入力すれば \(s_{w,20}\) と \(D_{w,20}\) を与える。また、SEDNTERPでも見かけの \(s\) 値を \(s_{w,20}\) に変換可能である。さらに濃度をゼロに外挿して右肩に0を付けたものがその分子の固有の沈降係数、拡散係数になる。
平均分子量と分子量分布について(図16参照)
タンパク質の場合はほとんどの場合鎖長が揃っており分子量は揃っているが、合成高分子などの場合には分子量分布を持っている。ただし、タンパク質の場合でも会合体を形成する場合には分子量分布を持つことになる。物理化学的な手法により溶液中での分子量を求めた場合の “分子量” とは平均分子量を意味し、用いる手法によって得られた分子量の種類が異なる。ここでは、数平均分子量と重量平均分子量について説明する。
① 数平均分子量 \(M_{n}\) … 最も直感的な分子量で、ある系に分子量 \(M_{i}\) の分子が \(N_{i}\) 個存在する場合以下の式で与えられる。分子の個数についての平均であり、低分子量の分子の影響を敏感に受ける。浸透圧測定や凝固点降下のような束一性を測定する方法により得られる。
\[M_n = \frac{\text{全重量}}{\text{分子量}} = \frac{\sum M_i N_i}{\sum N_i}\]② 重量平均分子量 \(M_{w}\) … 重量分率による分子量の平均であり、高分子量分子の平均分子量への寄与を重視した値である。光散乱、超遠心分析、ゲル浸透クロマトグラフィー(GPC)などにより得られる。
\[M_w = \frac{\text{全重量}}{\text{分子量}} = \frac{\sum M_{i}^{2} N_i}{\sum M_i N_i}\]分子量分布指数 \(M_{w}/M_{n}\) は分子量分布の広がりの目安となる。分子量分布がない場合には、この値は1となり単分散と呼ばれる。この値が大きいほど分子量の広がりが大きい事を意味し、この比が大きい場合を多分散と呼ぶ。各手法から得られる分子量がどの分子量に相当するか理解しておくと良い。
なお、Z平均分子量は重量平均分子量よりも更に高分子量分子の平均分子量への寄与を重視した値であり超遠心分析により測定可能である。
ローターについて
ローターはチタン製であるため強度は高いが、キズが入ったまま高速回転させると遠心機内で破裂する可能性がある。従って、ローターを何かしらの理由で落下させたり、キズをつけた場合には絶対に回してはいけない。
超遠心分析を進める際に有用なサイト
- 超遠心分析の総合サイトRASMB(Reversible Associations in Structural and Molecular Biology)
http://www.bbri.org/RASMB/rasmb.html - 東工大有坂先生による超遠心分析クラブメーリングリスト
http://www.farisaka.bio.titech.ac.jp/aucforum/aucclub.html - SEDFIT(NIH,Dr. Peter Shuck開発)
http://www.analyticalultracentrifugation.com/default.htm - ULTRASCAN(University of Texas,Dr. Borries Demeler開発)
http://www.ultrascan.uthscsa.edu/ - SEDNTERP(Alliance Protein Laboratory,Dr. John Philo開発)
http://www.jphilo.mailway.com/download.htm - Beckman Coulter社
http://www.beckmancoulter.co.jp/product/product01/ProteomeLab_XL-A_XL-I.html
文献
- Svedberg, T. and Pederson, K. O.: The ultracentrifuge. Oxford University Press (1940).
- Schachman, H. K.: Ultracentrifugation of Biochemistry. Academic Press, New York and London (1959).
- Williams, J. W.: Ultracentrifugation of macromolecules. Academic Press, New York and London (1972).
- Fujita, H.: Mathematical theory of sedimentation analysis. Academic Press, New York and London (1962).
- 高木俊夫,蛋白質核酸酵素,39, 1339–43 (1994).
- 有坂文雄,東工大クロニクル, 404 (2005).
- Cantor, C. R. and Schimmel, P. R. Biophysical Chemistry, PART II, 591–642, W. H. Freeman and Company, New York (1980).
- van Holde, K. E., Johnson, W. C. and Ho, P. S. Principles of Physical Biochemistry, 213–48, Pearson Education, Inc, New Jersey (2006). 「物理生化学」(田之倉優・有坂文雄監訳)(医学出版, 2003)14章。
筆者注、(8)の第一版の翻訳書。 - 林 勝哉,蛋白質の分子量・分子形,生化学実験法,学会出版センター (1971).
- 有坂文雄,蛋白質核酸酵素,43, 2067–79 (1998), 43, 2024–32 (1998), 43, 2238–44 (1998), 44, 82–91 (1999)
- 小林祐次,八田知久,西義則,内山進,プロテオミクスの最新技術,シーエムシー出版,39–48 (2001).
- 内山 進,生物工学ハンドブック, 213–6 (2005).
- Durschlag, H.: Thermodynamic Data for Biochemistry and Biotechnology (Hinz, H.-J., ed) , 45–128, Springer Verlag, Berlin (1986).
- Laue, T.M., Shah, B.D., Ridgeway, T.M., and Pelletier, S.L.: Analytical Ultracentrifugation in Biochemistry and Polymer Science (eds. Harding, S.E., Rowe, A.J., & Horton, L.C.), 90–125, Royal Society of Chemistry, Cambridge (1992).
-
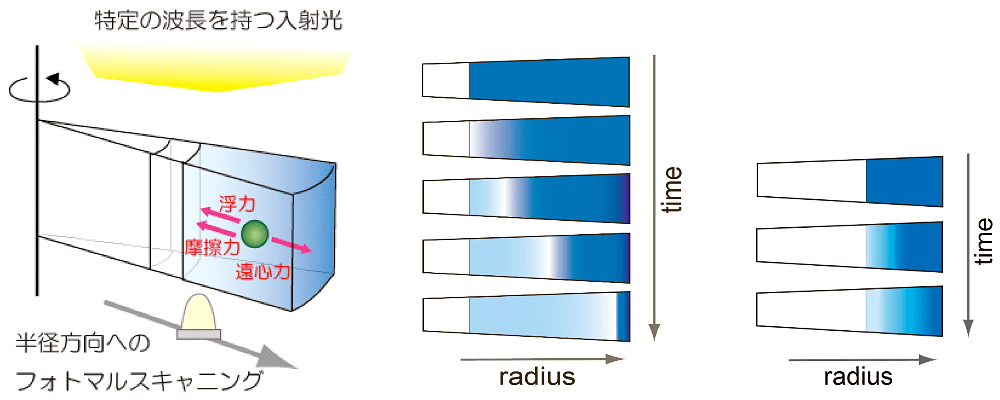
図1:超遠心分析の概要。
(左)遠心力場における溶液中の沈降挙動を分析する。(中央)沈降速度法では速い回転数で分子を沈降させ、沈降挙動を解析する。分子には摩擦力、遠心力、浮力が働く。界面付近で分子の拡散も観測される。(右)沈降平衡法では比較的遅い回転数で分子の濃度勾配を形成させる。平衡時には分子にかかる遠心力、浮力、および拡散力が釣り合っている。 -

図2:歴代の超遠心分析装置。
(左)Model-E とXL-A、(中央)XL-I、(右上)XL-I のレイリー干渉光学系による濃度勾配の測定結果、(右下)ローターの断面とXL-Iの検出器部分。XL-Iは紫外可視吸収光学系とレイリー光学系を備えている。 -

図3:超遠心分析に用いるセル。セルアセンブリー(左)をセルハウジング(真中右)にセットし、プラグで蓋をする。(最上)ローターへのセルのセットや位置合わせ、セルハウジングから各パーツの押し出しなどに使うセルアライング。(右下)センターピースの代表例。42000 rpm よりも高速の回転の場合にはアルミニウムのセンターピースを用いる。6欠セルは同時に3種類の試料が測定できる。 -
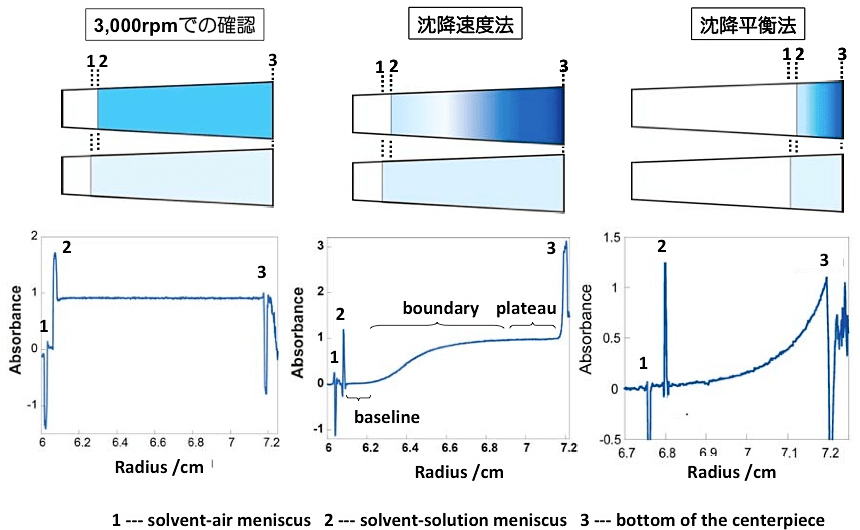
図4:スパイクとして観測される2つのメニスカスとセルの底。沈降速度法におけるベースライン(baseline)、界面(boundary)、プラトー(plateau)領域も示した。 -
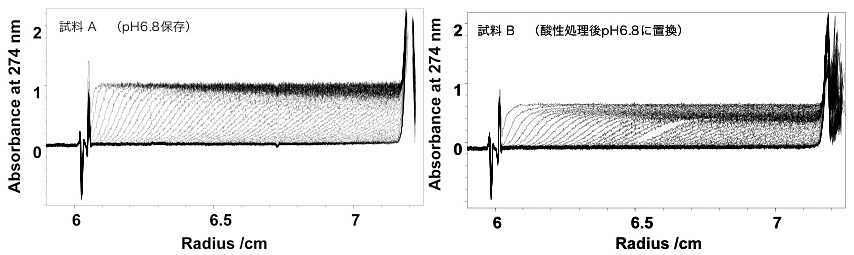
図5:IgGの沈降速度法の測定結果。
アルミダブルセクターセルを用いて45,000 rpm、20℃、5分間隔で約6時間測定を行った。(左)pH 6.8の中性条件で保存していたIgG(試料A)の結果。(右)pH 3 での酸処理を行った後pH 6.8の中性条件に戻したIgG(試料B)の結果。以降の速度法の解析結果はこの測定データを用いて行った結果を示した。 -
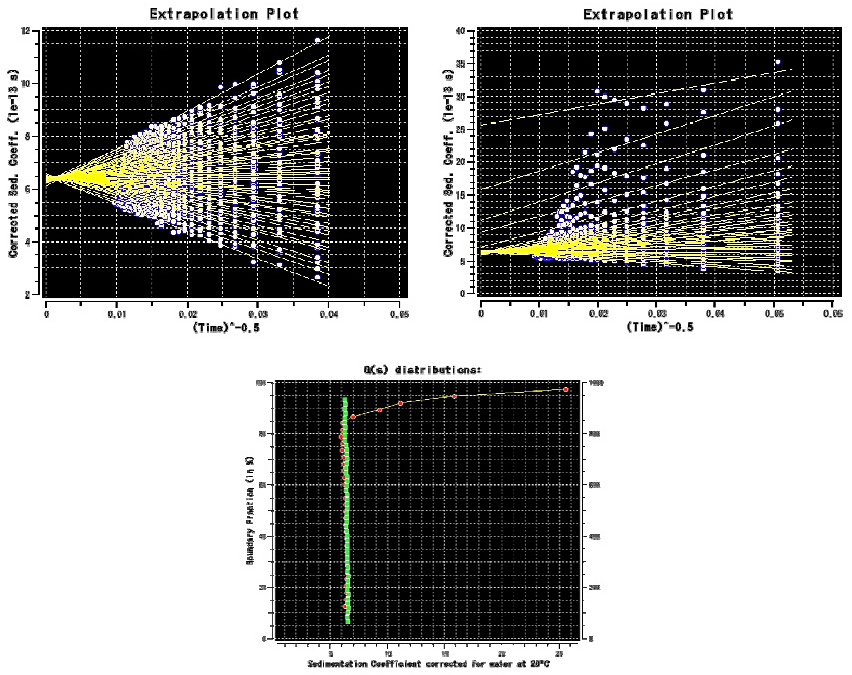
図6:Ultrascanを用いたEnhanced van Holde–Weischet法によるIgGの沈降速度実験の解析。
(上)\(s\) 値の外挿プロット(左が試料A、右が試料B)。(下)\(s\) 値の分布を比率としてプロットした図(緑丸が試料A、赤丸が試料B)。いずれにおいても、試料Aでは \(s\) 値が収束しているが、試料Bでは \(s\) 値が広く分布しており、大きな \(s\) 値の成分が存在することが一目瞭然でわかる。 -
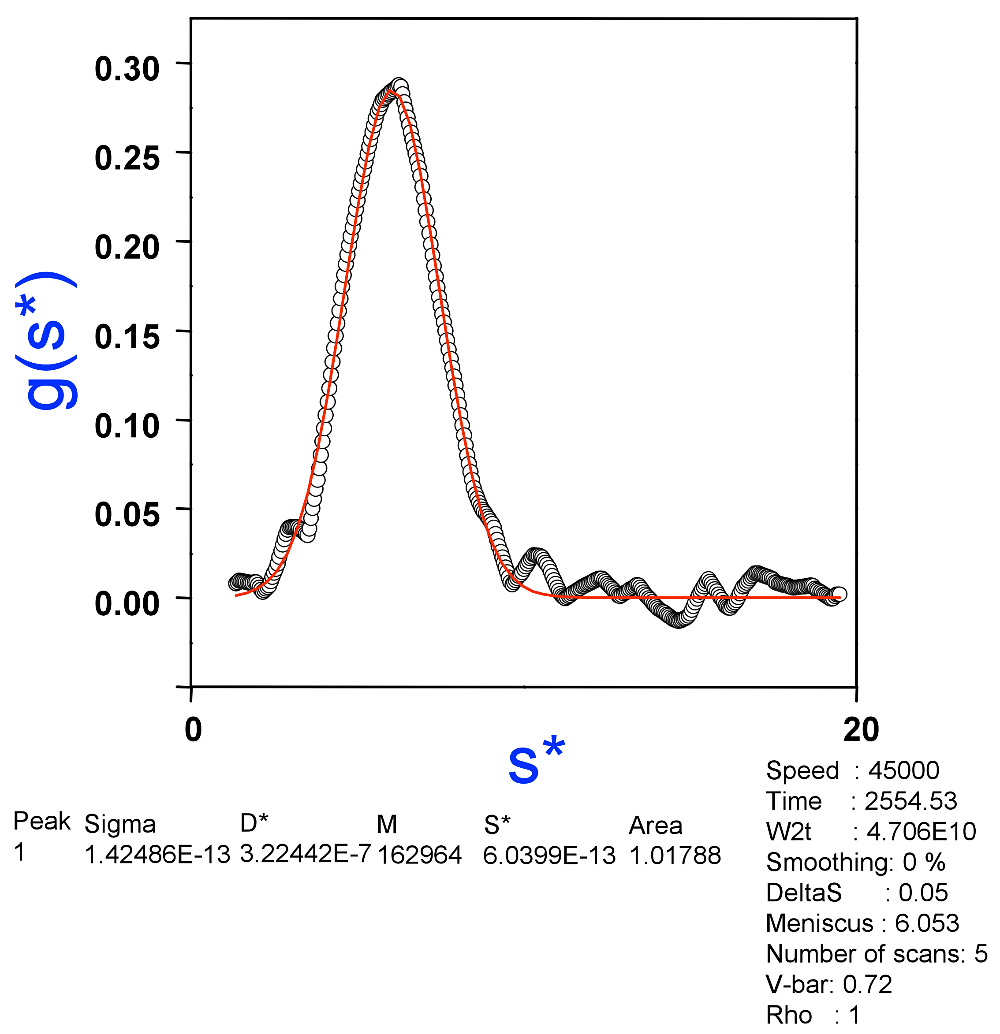
図7:Originを用いて試料Aの沈降速度法の実験結果についてtime-derivative法による解析結果。分子量はIgGの値である150 kDaに近い163 kDaが得られた。ピークは単一であり単分散の特徴を示している。 -
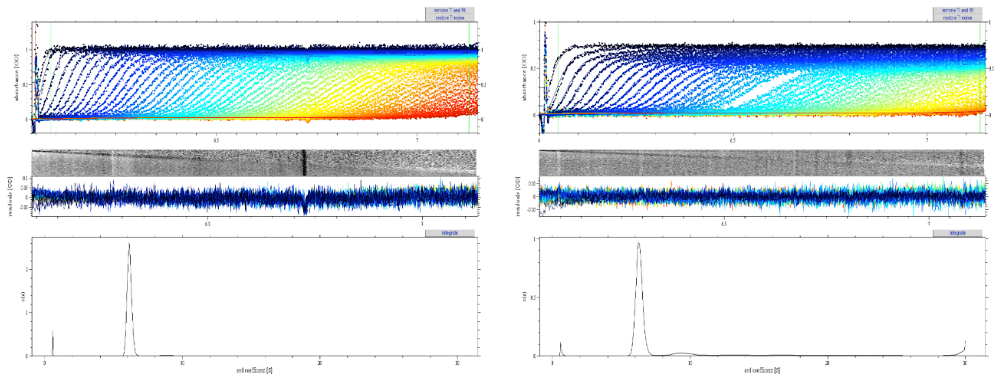
図8-1:IgGの沈降速度分析の測定結果とSedfitによるC(s)分布解析。
(左)試料Aの測定結果と解析結果。(右)試料Bの測定結果と解析結果。
左右両図とも実験結果(点)と解析して得られた数値を用いて作成された理論曲線(線)が一番上(横軸は半径、縦軸は吸光度)に、実験結果と理論曲線の差である残差が中央(横軸は半径、縦軸は実測値と理論値の差)に、\(s\) 値の分布(横軸は \(s\) 値、縦軸は比率)が一番下に表示されている。 -
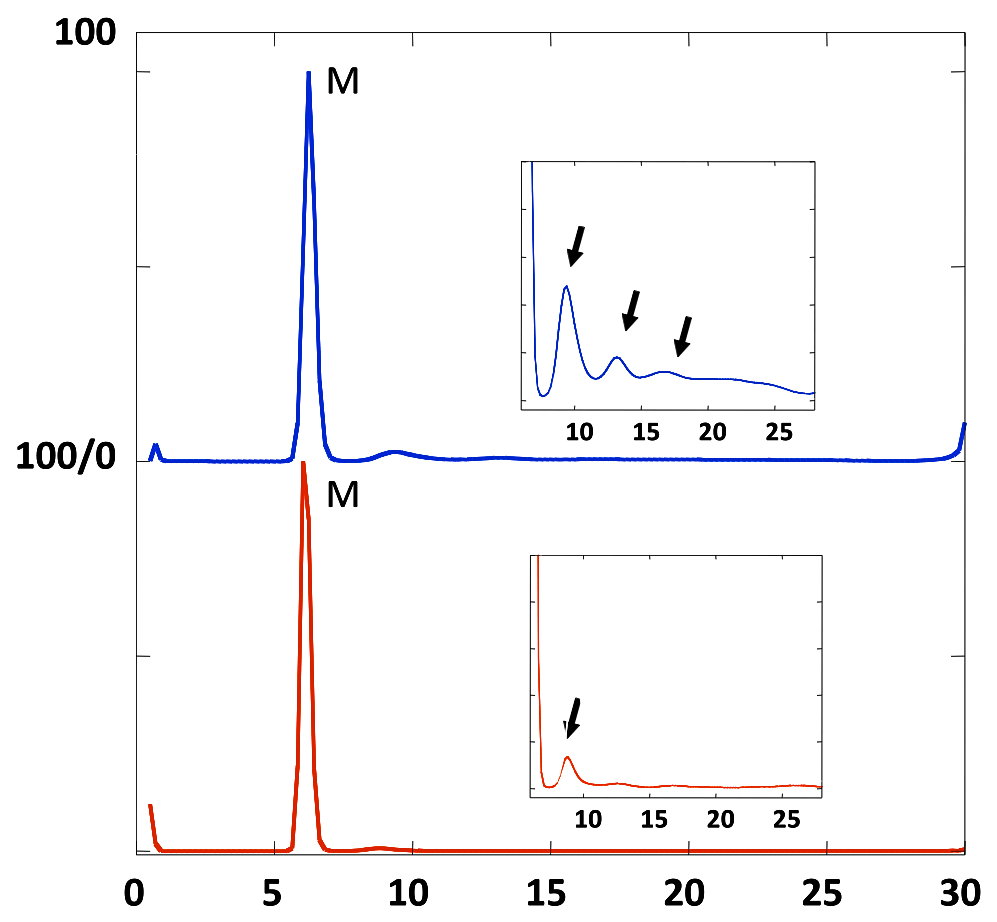
図8-2:図8-1の \(s\) 値の分布の比較(上が試料A、下が試料Bの解析結果)。矢印部分に小さなピークが確認できる。このピークは単量体よりも \(s\) 値が大きく凝集体に相当すると考えられるが、確実に存在すると結論づけるには実験と更なる解析の両面から検証が必要である。 -
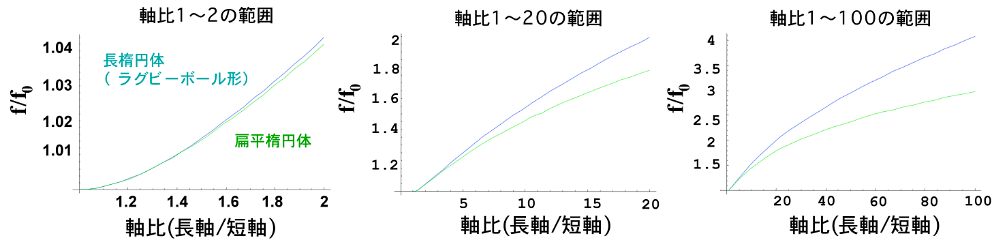
図9:分子形状と形状因子(\(f/f_{0}\))の関係。Perrinの式による。なお、水和水を考慮した計算を行うと同一の \(f/f_{0}\) でも軸比は小さくなる。 -
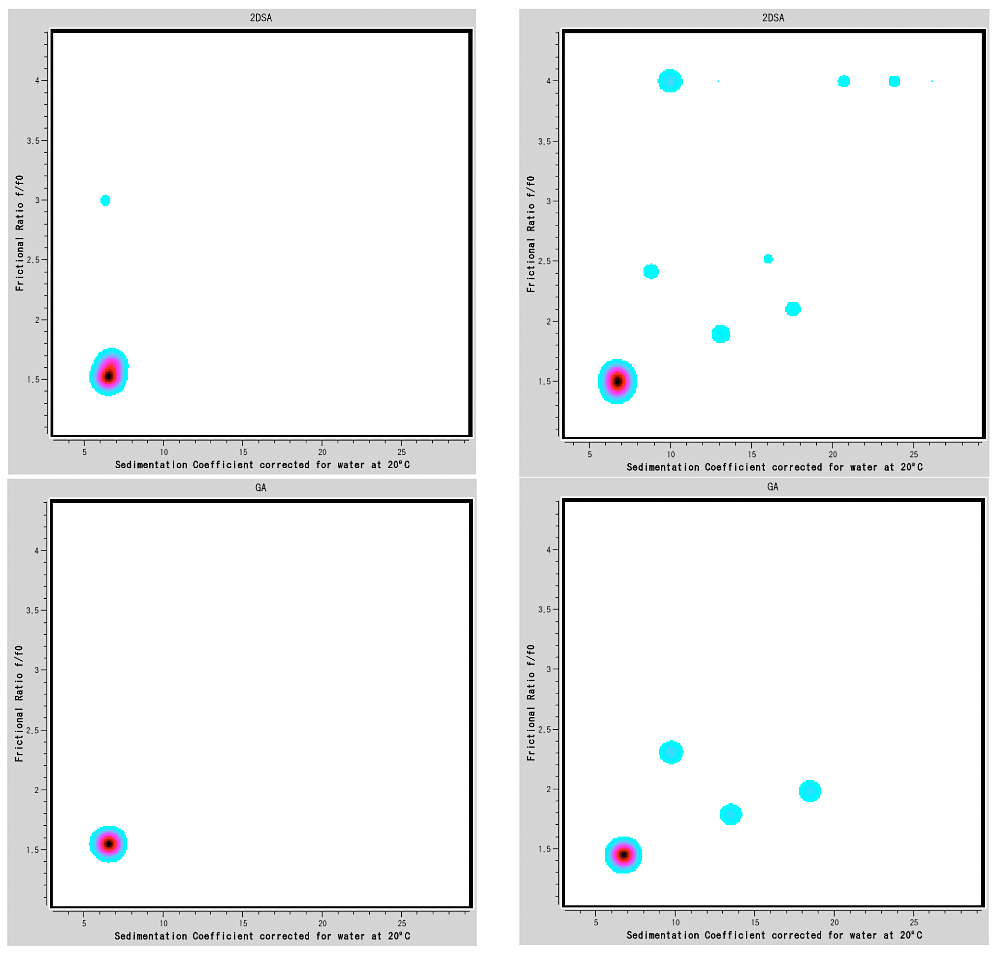
図10:Ultrascanによる2DSA法およびGA-MC法を用いた解析結果。
(上)2DSA法による解析結果(左)試料A(右)試料B。(下)(左)試料A(右)試料BのGA-MC法による解析結果。全て横軸が\(s_{w,20}\)、横軸が \(f/f_{0}\) である。試料Aは2DSAでの解析結果では、比較的形状因子が小さい(\(f/f_{0}\) が1.5)で \(s\) 値が6.5の分子(IgGの単量体)に加え、\(f/f_{0}\) が約3の成分がわずかに存在するように見えるが、GA法ではこのマイナー成分は消失しており、単量体のみからなる試料であると結論できる。試料Bでは単量体に加え、\(s\) 値が大きい成分が複数観測された。単量体より \(s\) 値が大きい1.5~2.5の範囲に位置する3つの成分は、2DSAでもGAでも観測されるため存在すると結論づけられる。一方、2DSAで観測された \(f/f_{0}\) が約4の成分はGA-MCでは消失しており、また \(f/f_{0}\) が4という極端な棒状の分子が混在しているとは考えにくいことから、存在しないと考えられる。
沈降速度法の実験結果のLamm方程式による直接解析は、解が得られていない数値解析であるため、上記のように適切なモデルを用いた複数の解析法による検証が必要である。 -
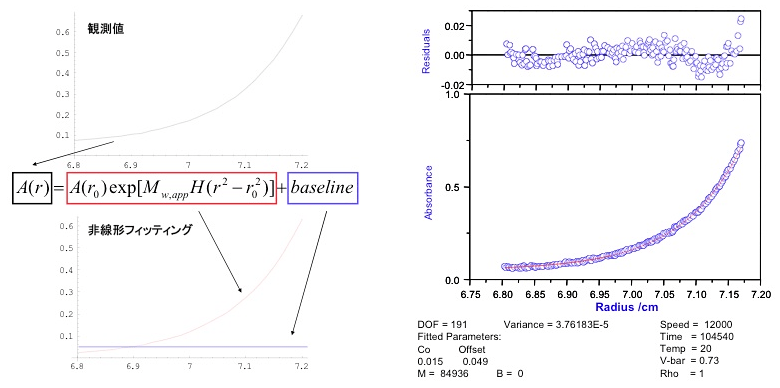
図11:沈降平衡の解析例。
(左)観測値と非線形フィッティング(一成分)、ベースラインの関係。(右)沈降平衡法における典型的な解離会合系の例。一成分の理論式である式8を用いて解析した。残差プロットをみるとセルの底付近で下凸になっていることがわかる。 -
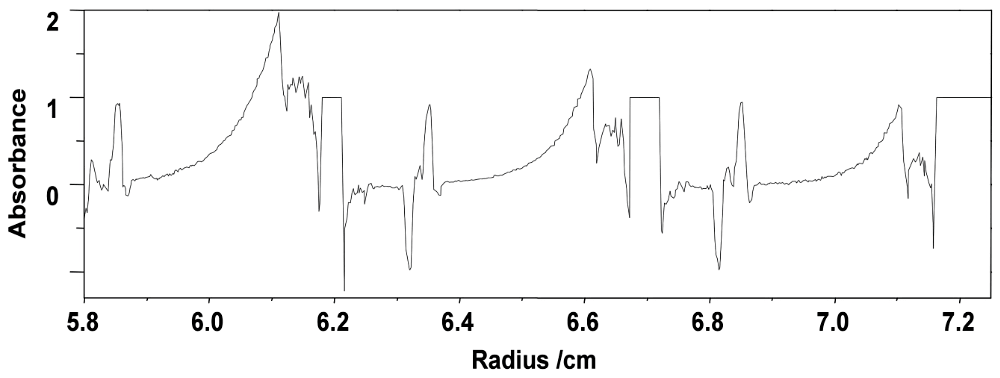
図12:濃度が異なる3つの溶液の沈降平衡。条件は6穴センターピース、24,000 rpm、20℃。半径が小さい場所に濃度が濃い溶液を入れ、半径が大きい場所に濃度が薄い溶液を入っている。本データは超遠心分析用のOrigin XLI/XLA Data Analysis Softwareのサンプルデータとしてソフトウェアインストール時から収納されている。 -
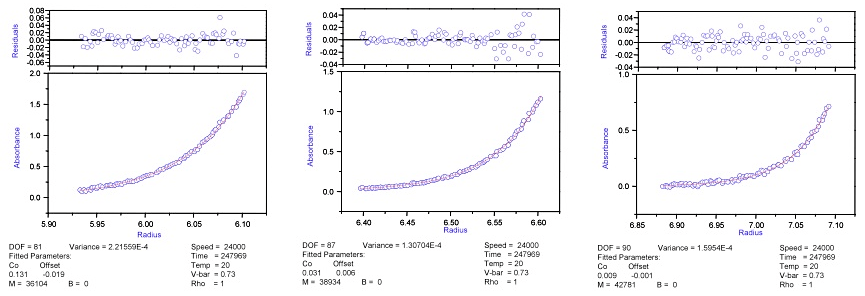
図13:若干の非理想性を示す試料(分子量47,000)の沈降平衡(UV光学系での観測結果)。式6を用いて非線形フィッティングを行った。残差は0を中心にランダムに分布しており、フィィッティングは良好であるように見えるが得られた見かけの分子量(\(M_{w,app}\))は濃度依存を示している。濃度に対して \(1/M_{w,app}\) をプロットすると顕著にその傾向が分かる(図15左参照)。 -
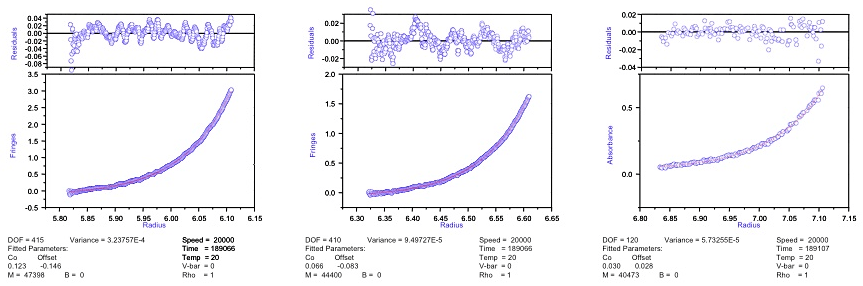
図14:解離会合の傾向を示す試料の沈降平衡(レイリー干渉光学系での観測結果)。式2を用いて非線形フィッティングを行った。残差をみるとわずかに会合系の様相を呈している(セルの底に近い部分の残差がわずかに下に凸)が、フィッティングは概ね良好であるように見える。しかしながら得られた見かけの分子量(\(M_{w,app}\))は濃度依存を示している。濃度に対して \(1/M_{w,app}\) をプロットすると顕著にその傾向が分かる(図15右参照)。 -
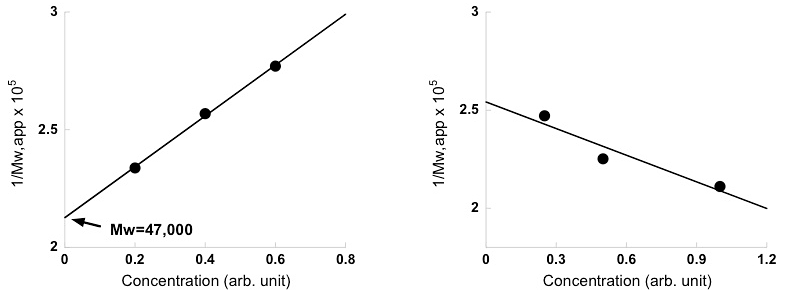
図15:図13と図14の各濃度における見かけの分子量。
(左)若干の非理想性を示している。\(1/M_{w,app}\) の濃度ゼロ外挿値から平均分子量 \(M_{w}\) として47,000が得られる。(右)解離会合系の傾向を示している。 -
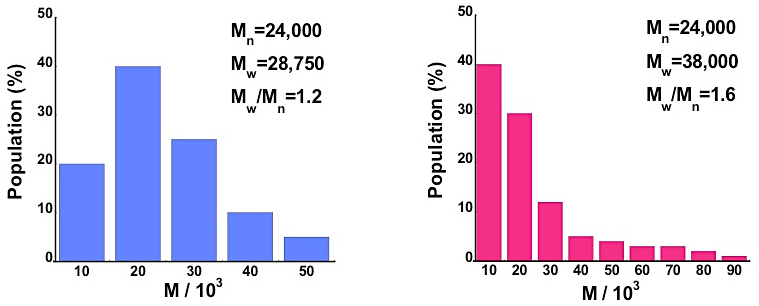
図16:異なる分子量の分子が図の割合で混在している場合の数平均分子量 \(M_{n}\) と重量平均分子量 \(M_{w}\) の値。分子量分布指数 \(M_{w}/M_{n}\) は左の場合では1.2であるが、右の場合では1.6であることから、左の場合の方が分子量分布が小さい事が分かる。


