概要
グラム陰性細菌の外膜は、細胞の環境適応や抗菌薬耐性に重要な構造であり、外膜タンパク質はBAM(β-barrel assembly machinery)複合体によって組み込まれる。この過程の品質管理に、亜鉛メタロプロテアーゼBepAが中心的な役割を果たす。BepAは基質である外膜タンパク質LptDの成熟を促進するとともに、その異常中間体を分解する二重機能を有する。本稿では、結晶構造解析・機能解析およびAlphaFoldによる構造予測の知見を基に、BepAによるLptD品質管理機構を概説した。BepAは、活性部位を覆うα6-loop、H246を介した “Hisスイッチ”、基質認識に関与するエッジストランドなどの可動領域を協調的に制御し、機能を切り替えると考えられる。これらの構造変化が活性部位の露出や基質アクセス制御に関与することが示唆された。BepAの構造変化と機能切り替えの理解は、外膜形成および外膜タンパク質品質管理の全体像の解明に寄与すると期待される。
1. はじめに
大腸菌をはじめとするグラム陰性細菌の表層は、内膜(IM: Inner Membrane)と外膜(OM: Outer Membrane)の二重の生体膜およびそれらの間に存在するペリプラズム空間から構成される [1]。ペリプラズムには細胞骨格としてペプチドグリカン層が敷き詰められており、この構造は細菌の環境適応や形状維持に重要である [1]。さらにOMは、抗生物質などの有害化合物から細胞内部を保護する重要なバリア機能を担っている [2]。
OMの機能発現には、βバレル構造を有する外膜タンパク質(OMP: Outer Membrane Protein)およびOM外葉に局在するリポ多糖(LPS: Lipopolysaccharide)が中心的な役割を果たしている [3]。βバレル構造をもつOMPが適切にフォールディングされ、機能的なβバレルを形成しながらOMへ正しく組み込まれる過程には、BAM(β-barrel assembly machinery)複合体が中心的な役割を果たす(図1A)[4]。BAM複合体は、生物種を超えて保存されたβバレル型OMPであるBamAと、リポタンパク質BamB、BamC、BamD、BamEから構成される [4]。OMP前駆体は細胞質で合成されたのち、アンフォールド状態を保ったままSecY/E/Gトランスロコン、SecA、SecD/F複合体 [5]、PpiD/YfgM複合体 [6] などを介してIMを通過する(図1A)。その後、SurA、DegP、SkpなどのペリプラズムシャペロンによってBAM複合体へ運ばれ、アッセンブリを経て成熟体となる(図1A)[7]。
LPSはIMの細胞質側で合成され、MsbAによってIM外葉へ輸送される [3]。IMからOMまでのLPS輸送は、Lptタンパク質群から構成されるLpt(LPS transport)複合体が担う(図1B、緑)[3]。最終段階では、OMPであるLptD/E複合体 [8] が関与し、LPSをOM外葉へと輸送する(図1B)。LptDもβバレル型OMPであり、その成熟過程は詳細に解析されている。まず、LptD成熟中間体(LptDC)が形成され、BAM複合体上でアッセンブリが進行するにつれてLptEと相互作用し、成熟型LptD(LptDNC)へと変換される [8-10]。このLptDの成熟過程には、亜鉛メタロプロテアーゼBepAが関与することが明らかとなってきた(図1C)[11]。さらに、BepAが作用した後の段階で、OMリポタンパク質LptMがLptD/E複合体と相互作用し、安定な成熟体であるLptD/E/M複合体を形成する(図1C)[12]。
BepAはM48メタロプロテアーゼファミリーに属する亜鉛メタロプロテアーゼであり、OMPの品質管理に重要な役割を果たす [11]。BepAはBAM複合体近傍でLptD成熟中間体と相互作用し、分子シャペロンのようにその適切な成熟を促進する一方で、BAM複合体上で異常に停滞したLptD成熟中間体は分解・除去する(図1C)[11,13]。しかしながら、BepAがどのようにLptDを認識し、どのようなメカニズムでシャペロン機能とプロテアーゼ機能を切り替えているのかは、いまだ明らかでない。
本稿では、これまでに報告されたBepAに関する研究を概説し、BepAによるLptD成熟中間体の認識および品質管理機構について考察する。さらに、AlphaFold3による構造予測を活用し、BepAの機能切り替えに関与する構造変化に着目して、基質認識機構についても議論する。
2. BepAの全体構造と活性部位
BepAは、N末領域側のプロテアーゼドメインとC末領域側のテトラトリコペプチドリピート(TPR)ドメインから構成されるタンパク質である(図2A、B)。大腸菌由来BepAについては、これまでにTPRドメイン単独構造(PDB ID: 5XI8)および全長BepAの結晶構造(PDB ID: 6AIT、6SAR)が報告されており [14–16]、これらの結晶構造解析に基づき、プロテアーゼドメイン(D28–G288)とTPRドメイン(V305–M487)がαヘリックス(α12)によって連結されていることが明らかにされている(図2A、B)[15]。これらの立体構造情報は、BepAがOMPの品質管理を担うプロテアーゼ/シャペロンとしての機能や、基質認識の分子機構を理解する上で重要な手がかりを提供してきた。
C末領域側のTPRドメインは、10本の逆平行αヘリックス(H1–H10)から構成される(図2A、B)[15]。このTPRドメインは、BAM複合体構成因子であるBamA、BamC、BamDに加えて、LptDとも相互作用することが部位特異的光架橋解析により示されている [14]。特に、TPRドメイン中のF404残基はBamAおよびLptDとの相互作用部位として同定されており、この残基の変異によりLptDの成熟促進および分解といったBepA機能の低下が報告されている [14]。さらに、TPRドメイン内部には負に帯電した親水性の凹み(Pocket)が存在する(図2D)[15]。Pocketからは、活性部位近傍へ(図2D左では上方向へ)と通じる負電荷を帯びた溝が形成されている(図2D)[15]。Shahrizalらは、プロテアーゼドメインのα2ヘリックス上に位置するD69、H1ヘリックス上のE321、H3ヘリックス上のD347およびD351、さらにH6–H7ループ上のD408およびD409といった酸性残基がPocketに存在し、基質中の正電荷を帯びた領域との相互作用に関与する可能性を指摘している [15]。さらにBryantらは、Pocketに加え、プロテアーゼドメイン近傍に存在する正電荷を帯びたCavityの存在を示した(図2D右)[16]。また、Pocketに位置するα11ヘリックス上のR280およびH3ヘリックス上のD347、ならびにCavityに位置するH10ヘリックス上のR466およびR470に変異を導入すると、BepAによるOMバリア機能の維持とプロテアーゼ機能が低下すると報告されている [16]。これらの結果から、TPRドメインを介したBAM複合体およびLptDとの相互作用が、BepAによるLptDの品質管理に重要な役割を果たしていると考えられる。
N末領域側のプロテアーゼドメインは、11本のαヘリックス(α1–α11)および3本のβストランド(β1–β3)から構成される(図2A、B)[15]。活性部位には亜鉛イオンが存在し、亜鉛メタロプロテアーゼに保存されたHEXXHモチーフ中のH136およびH140に加え、α7ヘリックス上のE201が亜鉛イオンに配位している [15,16]。一般的な亜鉛メタロプロテアーゼでは、亜鉛イオンは3つのアミノ酸残基と1つの水分子によって配位されるが、BepAでは水分子の代わりにα9-loop(P239–P247)内のHis-246が配位している(図2C)[15-17]。通常、この水分子は近くのGlu残基によって極性化され求核性が高まり、基質ペプチド結合のカルボニル炭素を攻撃することで加水分解反応が起こる [18]。そのため、BepAの結晶構造は、基質が活性部位にアクセスできない「不活性型」を示している(図2A、C)[15,16]。この構造により、BepAは基質の状態にかかわらず無秩序な分解を起こさないよう自己抑制されている。H246はこの抑制機構の中心であり、プロテアーゼ活性のON/OFFを切り替える “Hisスイッチ” として機能するとされている [17]。実際、H246変異体やH246を含むα9-loop領域を欠失した変異体(Δα9)では、BepAのプロテアーゼ活性が異常に亢進し、正常にアッセンブリされたLptD成熟中間体さえも分解された [17]。これらの結果は、H246を含む構造変化によりBepAが基質の状態に応じた活性制御を行うことを強く示唆している。
BepAのプロテアーゼ機能とシャペロン機能の双方に関与する要素として、活性部位に隣接する「エッジストランド」と呼ばれるβ2ストランドがある(図2A–C)[13]。このエッジストランドはLptD成熟中間体と直接相互作用し、BepAの両機能に関与することが報告されている [13]。Miyazakiらは、この領域を構成する残基N105–F109の変異体で、LptDに対する分解活性および成熟促進機能のいずれもが低下することを示し、この領域の二次構造が機能発現に重要であることを明らかにした [13]。さらに、部位特異的光架橋およびジスルフィド架橋解析により、BepAのエッジストランドがLptDのβバレル形成ドメインN末領域にあるY331残基と直接接触することが示された [13]。また、BepAがBAM複合体上でアッセンブリ途上のLptD成熟中間体と相互作用することも明らかとなり、BepAがLptDの成熟段階に応じて認識を切り替えている可能性が示唆される [13]。
BepAの結晶構造(PDB ID: 6AITおよび6SAR)には、モデル化されていないDisorder領域が存在する [15,16]。6AIT構造ではα5–α6間(Q153–L159)およびα6–α7間(G178–Q191)に対応する電子密度が観測されず、これらの領域はモデル化されていない(図2A左)[15]。一方、6SAR構造ではさらに広範囲の残基L146–I194がモデル化されていない(図2A中央)[16]。α6–α7間のDisorder領域およびα6ヘリックスを含むα6-loop(W161–I194)領域は、活性部位を覆う位置にあると推定されるが、高い柔軟性のため電子密度が観測されなかったと考えられる。
近年、AlphaFoldをはじめとするAIによるタンパク質立体構造予測ツールが構造生物学で重要な役割を果たしている [19–22]。筆者らは、BepAの結晶構造(6AIT、6SAR)でモデル化されなかったDisorder領域を補うため、AlphaFold3(https://alphafoldserver.com/)を用いてBepA単体の構造予測を行った(図2A右、E)。予測構造では、α6-loop領域がαヘリックス構造をとり、活性部位およびエッジストランドを覆う位置にあることが示された(図2A右、E)。しかし、構造信頼度を示すpLDDT(predicted Local Distance Difference Test)スコアは低く(図2E)、一定の構造をとっていないと考えられる。BepAのプロテアーゼ活性は、H246による化学的制御に加え、α6-loop領域が活性部位へのアクセスを物理的に阻害する “活性部位の蓋” として機能することで、基質アクセスやプロテアーゼ活性を調節している可能性が示唆される [15–17]。
3. BepAの構造変化についての考察
BAM複合体によるLptDの膜組み込み過程において、BepAはLptDの構造状態に応じて成熟促進あるいは分解を担う [13]。この機能の切り替えは、2章で述べた複数の領域が協調的に構造変化を起こすことによって実現されると考えられる。特に、(ⅰ)活性部位を覆うα6-loop、(ⅱ)H246が関与するHisスイッチ、(ⅲ)基質と相互作用するエッジストランドの三つの領域が重要である。本章では、このうち(ⅰ)活性部位を覆うα6-loopおよび(ⅱ)H246が関与するHisスイッチに焦点を当て、AlphaFoldによる構造予測を考慮しつつ、それぞれの領域が果たす役割について考察する。
3.1. α6-loopの開放による活性部位の露出
α6-loopはBepAの活性部位を覆い、基質のアクセスを制御する「活性部位の蓋」として機能すると考えられている(図2A右)[13,15]。結晶構造ではこの領域に関する十分な構造が得られていないものの、AlphaFoldは構造未決定の柔軟性の高い領域について予測が可能であり [19,20]、BepAに関してはGaoらの研究が興味深い結果を示している [23]。
GaoらはAF2Complexを用いてBamA/BepA複合体およびBAM(BamA–E)/BepA複合体モデルを予測し、結晶構造で未モデル化であった領域を “active-site lid” と定義して、その開閉状態を評価した(図3)[23]。この “active-site lid” は、本稿で定義するα6-loopに相当する領域である。これらの予測構造において、BepAはいずれのモデルでもBamAのPOTRA1–5(P1–P5)領域と近接しており、TPRドメインはPOTRA1–2に沿って、プロテアーゼドメインはPOTRA3–4に沿って位置していた(図3)。BamA/BepA複合体モデルでは、α6-loopは活性部位を覆っていたのに対し(図3A)、BAM/BepA複合体モデルではα6-loopが開いて活性部位が露出した構造が予測された(図3B)。この「開いた」状態では、α6-loopが直立し、BamAのLateral gateに沿うような位置をとり、OM内葉へ差し込まれるような配置をしていた(図3B)。これらの結果からGaoらは、BepAの基質認識において、通常はα6-loopが活性部位を覆うことで不要な分解を防ぐ一方、基質のフォールディングが停滞した場合にはα6-loopが開いて活性部位を露出させ、基質分解を誘導するという仮説を提唱している。
3.2. H246によるHisスイッチ解除とα9-loopの構造変化の可能性
2章で述べたように、H246は第4配位子として亜鉛イオンに結合し、“Hisスイッチ” として機能すると考えられている(図2C)[17]。本節では、このHisスイッチがどのように解除されるのかを考察するため、AlphaFold3を用いた構造予測によりα9-loopの構造変化を解析した。
BepAのスイッチ解除状態を模倣するため、α9-loop上のH246をアラニンに置換し、亜鉛イオンとの配位を阻害した。また、基質アクセスを容易にするため、活性部位の蓋として機能するとされるα6-loopを削除した。これらの変異を組み合わせたBepA(Δα6-loop/H246A)と基質断片ペプチドとの複合体をAlphaFold3により予測した。用いた基質断片ペプチドは、LptDのβバレルドメインの配列(I230–L784)をN末端側から15残基ごとに分割した37種類のペプチドである。
その結果、結晶構造(PDB ID: 6AIT)のBepAと比較して、α9-loopが外側に移動した構造がいくつか予測された(図4A、B)。図4は、MiyazakiらによってBepAとの相互作用が報告されたLptD領域(L440-L454)を基質とした予測構造の一例であり [13]、その中でも最も大きくα9-loopが移動した構造を示している。予測したすべての構造について、活性部位中心に存在する亜鉛イオンと246残基のCα原子との距離を測定したところ、距離は3.83–14.0 Åの範囲にあり、中央値は7.20 Åであった。結晶構造ではこの距離が4.26 Åであるため、変異体の導入によりα9-loopが外側へ移動し、亜鉛イオン近傍への基質アクセスが容易になったと考えられる。また、多くの複合体予測ではpLDDT値が低いものの、図4Aに示すように亜鉛イオン近傍に断片ペプチドが位置していた。これらの結果から、α9-loopの構造変化が亜鉛イオンを露出させ、基質ペプチドの分解を可能にするために重要であると考えられる。さらに、BepAがBAM複合体や基質と相互作用することでα9-loopの動きを促進し得ることから [13,17]、AlphaFoldによる予測は基質依存的な構造変化の一部を再現している可能性がある。今後は、どのような条件でα9-loopの開放が誘導され得るのかを詳細に検討する必要がある。
4. BepAによるLptD品質管理モデル
BepAによるLptDの品質管理機構は、結晶構造解析と機能解析、さらにAlphaFoldを用いた構造予測により、複数の領域が連携してLptDの成熟促進と分解を担うことが明らかになってきた [11,13,15,17,23]。また、LptDの品質管理には、前期にDegP、中期にYcaL、後期にBepAが関与することが報告されている [24]。本節では、これまでに報告された知見ならびに筆者らが行ったAlphaFold3による構造予測の結果を統合し、BepAによるLptD品質管理モデルを示す(図5)。
未成熟LptDがBAM複合体に到達した段階では、(ⅰ)BepAはH246が亜鉛イオンに配位した抑制状態にあり、活性部位はα6-loopによって覆われている [13,17]。このときBepAは不要な分解を行わず、LptDの成熟過程を監視していると考えられる [13,17]。(ⅱ)BAM複合体あるいは基質からのシグナルによりα6-loopが開放すると、エッジストランドおよび活性部位が露出し、エッジストランドを介してLptD成熟中間体を認識する [13]。正常なLptDの成熟が進行すると、LptD成熟中間体はBepAから解離する [13]。一方で、正常に成熟できない異常LptDがBAM/BepA上で停滞する場合には、(ⅲ)α9-loop内のH246が亜鉛イオンから外れてHisスイッチが解除され、LptD成熟中間体は分解に導かれる [17]。BepAによる選別を経たLptD成熟中間体は、(ⅳ)LptEと複合体を形成する [11,13]。LptEはLptD成熟中間体のβバレル内部に収まり、その折りたたみおよび構造安定化に関与することで、複合体の成熟を完成させる [8–10]。形成されたLptD/E複合体はBamAからOMへと放出され、その後、OMリポタンパク質LptMが結合し、複合体のさらなる安定化に関与する [12]。
これまで述べてきたように、BepAはLptDおよびBAM複合体と連携し、OM形成の品質管理を担っている。先行研究から、BepAはOMの恒常性維持に寄与し、その機能不全変異株では抗菌薬感受性が上昇することが報告されている [11]。したがって、BepAはOMの透過障壁を制御する調節因子として、有望な創薬ターゲットの候補である。構造予測で示されたモデルを手がかりに、BepAがBAM複合体およびLptD成熟中間体とどのように相互作用し、どのように構造変化と機能切り替えを行うのかを明らかにすることは、今後の重要な課題である。本稿で紹介したBepAに関する知見が、BepAのみならず、OMおよびOMPの生合成機構全体の理解を深める一助となれば幸いである。
参考文献
- Miller, S. I. & Salama, N. R., PLoS Biol., 16, e2004935 (2018)
- Nikaido, H., Microbiol. Mol. Biol. Rev., 67, 593–656 (2003)
- Sperandeo, P., et al., J. Biol. Chem., 292, 17981–17990 (2017)
- Diederichs, K. A., et al., J. Mol. Biol., 433, 166894 (2021)
- Tsukazaki, T., FEMS Microbiol. Lett., 365, fny112 (2018)
- Miyazaki, R., et al., J. Biol. Chem., 298, 102572 (2022)
- Combs, A. N. & Silhavy, T. J., Annu. Rev. Microbiol., 78, 191–211 (2024)
- Qiao, S., et al., Nature, 511, 108–111 (2014)
- Chng, S.-S., et al., Science, 337, 1665–1668 (2012)
- Chimalakonda, G., et al., Proc. Natl. Acad. Sci. USA, 108, 2492–2497 (2011)
- Narita, S., et al., Proc. Natl. Acad. Sci. USA, 110, E3612–E3621 (2013)
- Miyazaki, R., et al., Cell Rep., 44, 116013 (2025)
- Miyazaki, R., et al., eLife, 10, e70541 (2021)
- Daimon, Y., et al., Mol. Microbiol., 106, 760–776 (2017)
- Shahrizal, M., et al., J. Mol. Biol., 431, 625–635 (2019)
- Bryant, J. A., et al., J. Bacteriol., 203, e00434–20 (2020)
- Daimon, Y., et al., Proc. Natl. Acad. Sci. USA, 117, 27989–27996 (2020)
- Klein, T., et al., Chem. Rev., 118, 1137–1168 (2018)
- Jumper, J., et al., Nature, 596, 583–589 (2021)
- Abramson, J., et al., Nature, 630, 493–500 (2024)
- Chai Discovery Team, bioRxiv, 2024.10.10.615955 (2024)
- Passaro, S., et al., bioRxiv, 2025.06.14.659707 (2025)
- Gao, M., et al., eLife, 11, e82885 (2022)
- Soltes, G. R., et al., J. Bacteriol., 199, e00418–17 (2017)
-
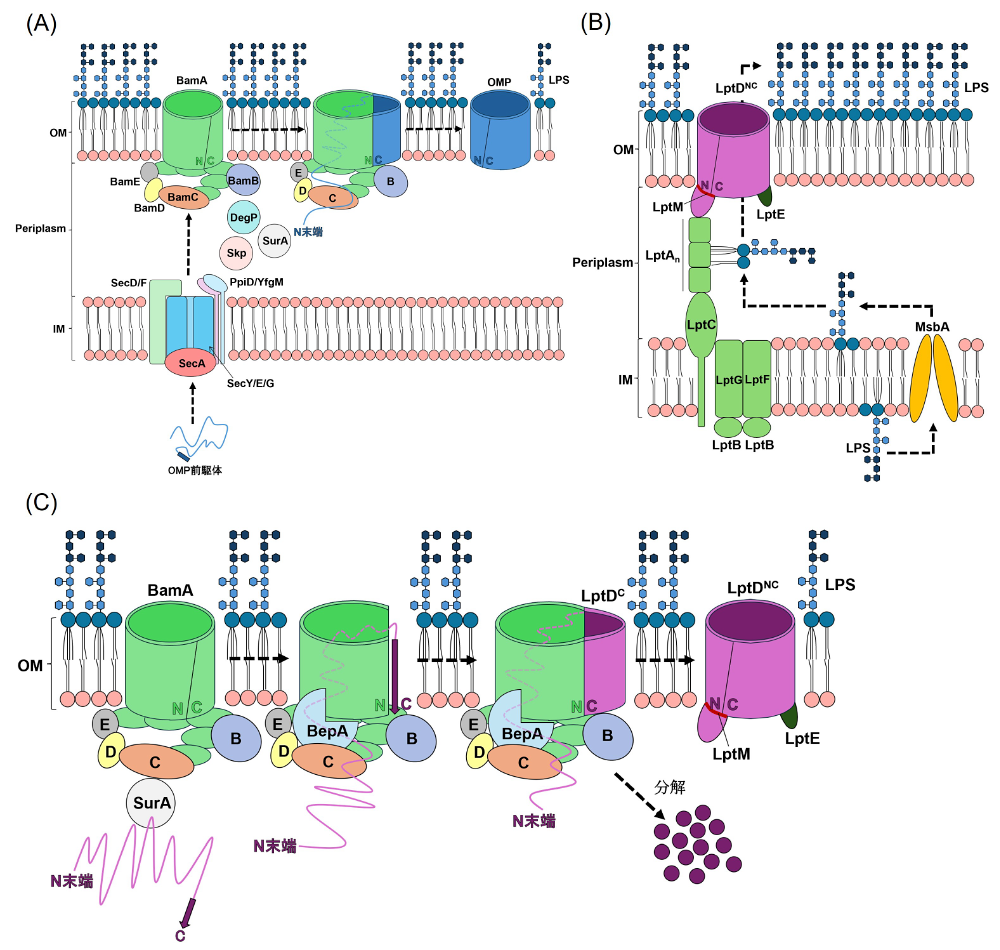
図1:BAM複合体、Lpt複合体および関連因子の概略図
(A)BAM複合体とOMPアッセンブリ。BAM複合体はBamA、BamB、BamC、BamD、BamEから構成され、OMPのアッセンブリに重要である。OMPは細胞質で合成され、Sec経路を介してIMを通過した後、SurAやSkpなどのペリプラズムシャペロンによってBAM複合体へと運ばれ、OMに組み込まれる。(B)LPS輸送経路。LPSはLpt複合体(緑)を介してOMに輸送される。輸送の最終段階にはLptD/E複合体が関与する。(C)LptD成熟過程におけるBepAとLptMの役割。LptDの成熟過程では、BepAとLptMがそれぞれ異なる段階でLptD成熟中間体と相互作用して成熟体の形成を助ける。BepAは、異常に停滞したLptD成熟中間体を分解する。図中のNとCはβバレルドメインのN末、C末を表す。 -
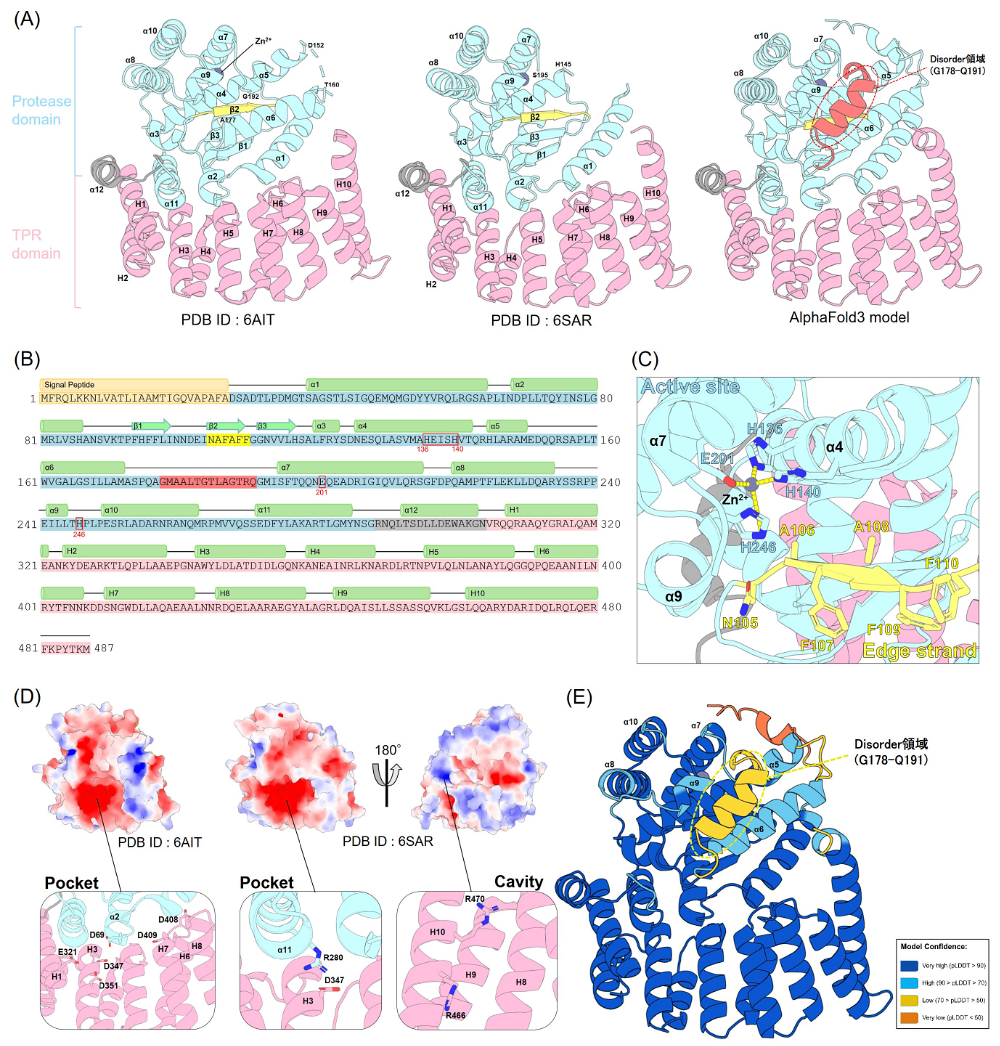
図2:BepAの構造
(A)BepAの結晶構造とAlphaFold3による予測構造。プロテアーゼドメインをシアン、TPRドメインをピンクで示す。両ドメイン間のα12ヘリックスはグレーで示した。活性部位の亜鉛イオンは、グレーの球で示した。AlphaFold3モデルでは、結晶構造解析でモデル化されていないα6–α7間領域(G178–Q191)が、活性部位を覆う形で予測された(赤)。(B)BepAのアミノ酸配列。αヘリックス構造の領域をα1–12およびH1–10で、βストランドの領域をβ1–3で示した。HEXXHモチーフおよび、亜鉛イオンに配位するアミノ酸残基(H136、H140、E201、H246)を赤枠で表示した。β2ストランド(エッジストランド)は黄色で示し、活性部位の蓋と予測されるDisorder領域は赤色で示した。(C)活性部位周辺の構造(PDB ID: 6SAR)。亜鉛イオン(グレーの球)に、H136、H140、E201、H246が配位している。β2ストランド(エッジストランド)を黄色で示した。(D)TPRドメインの表面静電ポテンシャルマップ。表面は静電ポテンシャルに基づいて着色しており、赤は負に帯電した領域、青は正に帯電した領域を示す。左と中央の図は、(A)と同じ向きから見た構造である。結晶構造(PDB ID: 6AITおよび6SAR)では、TPRドメイン内に負に帯電したPocketおよびプロテアーゼドメイン側に開口する溝が存在する。中央の図を180度回転させた右図では、正に帯電したCavityが見られる。拡大図は、それぞれの領域に含まれる特徴的な親水性残基の側鎖を示した。(E)AlphaFold3予測構造。BepAのpLDDTスコアを色分け表示して示した。 -
![BepAにおけるα6-loopの開閉状態(A)AF2ComplexによるBamA/BepA複合体の予測構造 [23]。BepAのTRPドメイン(ピンク)はBamAのPOTRA1-2に沿って配置され、プロテアーゼドメイン(シアン)はPOTRA3-4側に位置する。α6-loop(赤)は活性部位を覆う位置状態にある。(B)AF2ComplexによるBAM(BamA-E)/ BepA複合体の予測構造 [23]。α6-loopは直立し、BamAのLateral gate(オレンジ)に向かって伸びており、OM内葉を向く配置を示す。](/archives/images/BepA_01/BepA_01_Fig_03.png)
図3:BepAにおけるα6-loopの開閉状態
(A)AF2ComplexによるBamA/BepA複合体の予測構造 [23]。BepAのTRPドメイン(ピンク)はBamAのPOTRA1-2に沿って配置され、プロテアーゼドメイン(シアン)はPOTRA3-4側に位置する。α6-loop(赤)は活性部位を覆う位置状態にある。(B)AF2ComplexによるBAM(BamA-E)/ BepA複合体の予測構造 [23]。α6-loopは直立し、BamAのLateral gate(オレンジ)に向かって伸びており、OM内葉を向く配置を示す。 -
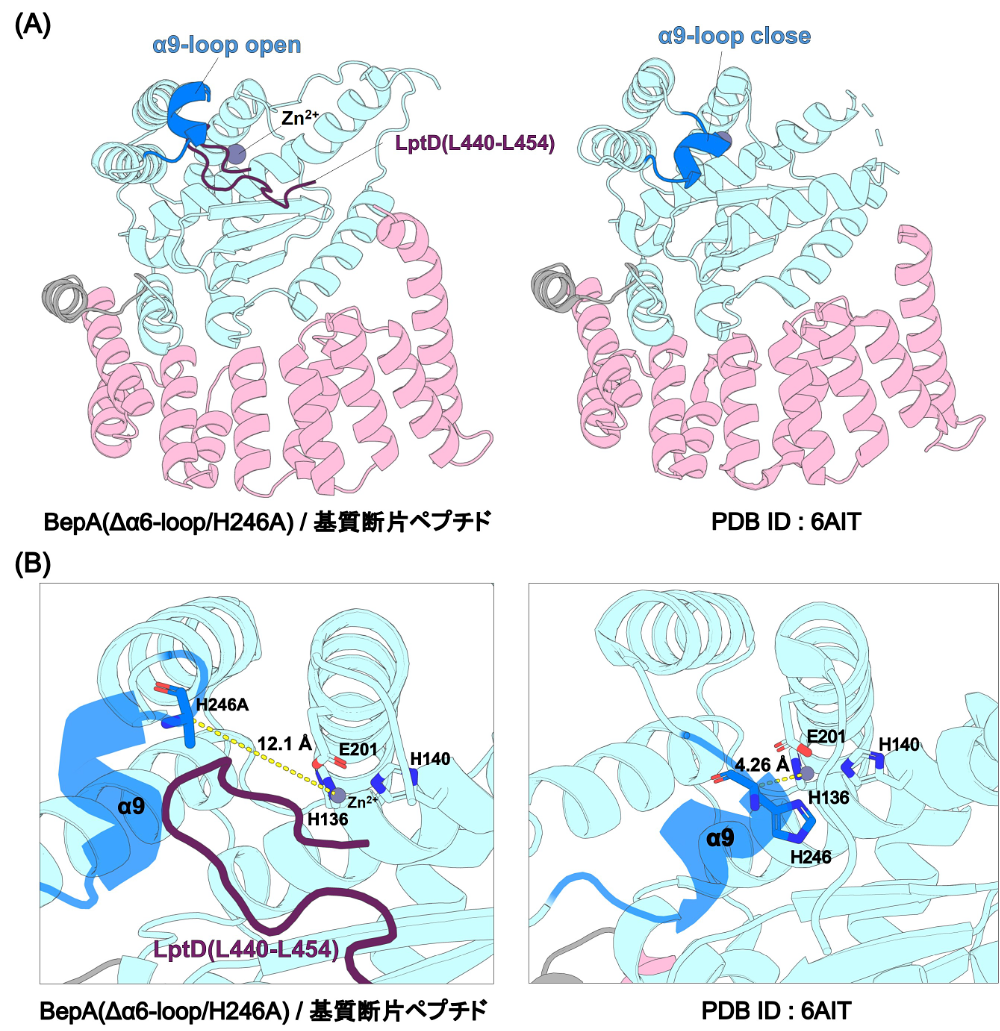
図4:H246によるHisスイッチ解除に伴うα9-loopの構造変化
(A)AlphaFold3により予測されたBepA(Δα6-loop/H246A)/基質断片ペプチド複合体の予測構造(左)および結晶構造(PDB ID: 6AIT、右)。亜鉛イオン近傍にある基質断片ペプチドLptD(L440-L454)は紫で示した。(B)BepA(Δα6-loop/H246A)/基質断片ペプチド複合体の予測構造(左)および結晶構造(PDB ID: 6AIT、右)の活性部位の拡大図。亜鉛イオンと、246残基のCαとの距離を示した。 -
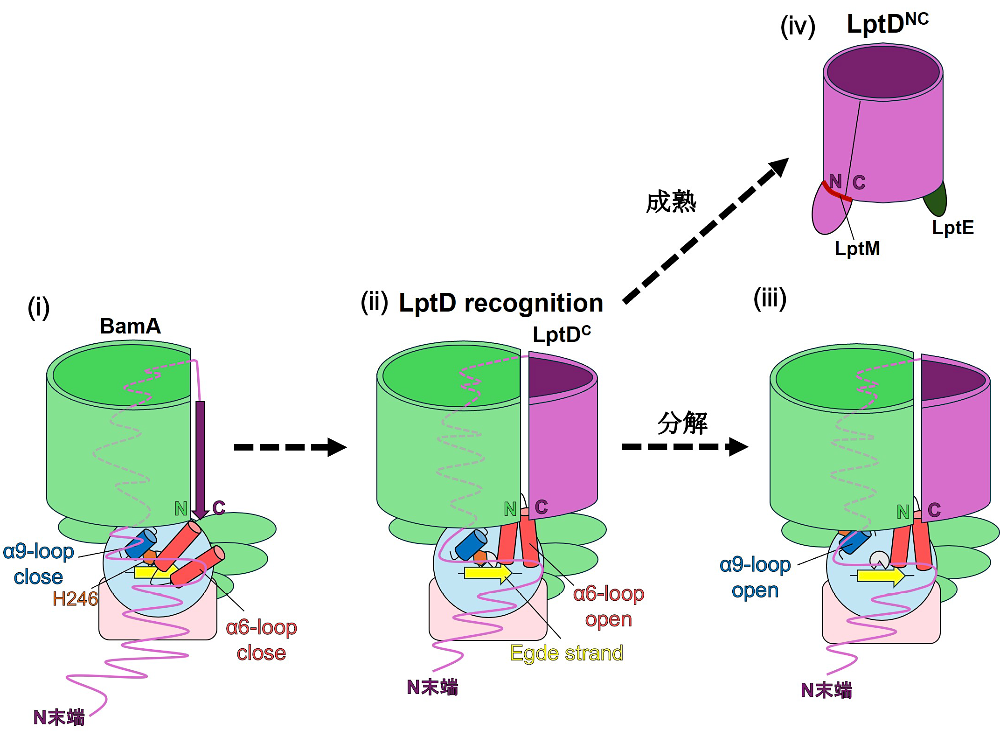
図5:BepAによるLptD品質管理の構造変化および機能切り替えモデル
LptD成熟中間体がBAM複合体に到達すると、BepAはα6/α9-loopの構造変化を介してプロテアーゼ活性を調節しつつ、エッジストランドを通じてLptD成熟中間体を認識する。この状態を経て、LptD成熟中間体は分解または成熟促進の経路へ進む。


