二種類のプロテオリポソームを用いたグラム陰性細菌リポ多糖膜間輸送の再構成
大阪大学大学院・医学系研究科- 奥田傑, 蛋白質科学会アーカイブ, 12, Essay 08 (2019)
- https://www.pssj.jp/archives/essay/Es_08/Es_08.html
この度は、若手奨励賞優秀賞を頂きまして大変光栄に感じております。本学会には、私が研究を始めたばかりの学生の頃に参加していた研究会や特定領域研究の班会議などでご一緒させていただいた先生が多く所属しており、そのような学会で賞を頂けたことを何より嬉しく思っております。この賞を叱咤激励と受け止め、今後より一層精進いたします。
若手奨励賞ではグラム陰性細菌の表層を覆うリポ多糖(LPS)の細菌内での輸送を担う因子群の精製・再構成について発表を行ったが、本研究を達成する鍵となったのは部位特異的光架橋法である。この手法については、2016年度に若手奨励賞優秀賞を受賞した塩田先生が、酵母での蛋白質間相互作用解析を行った際の詳細なプロトコールを書かれているため (1)(実験ノートはアメリカに置いてきてしまって、手元にないことも理由の一つではあるが)、私は本研究に至った経緯などをまとめた「エッセイ」を書かせていただく。
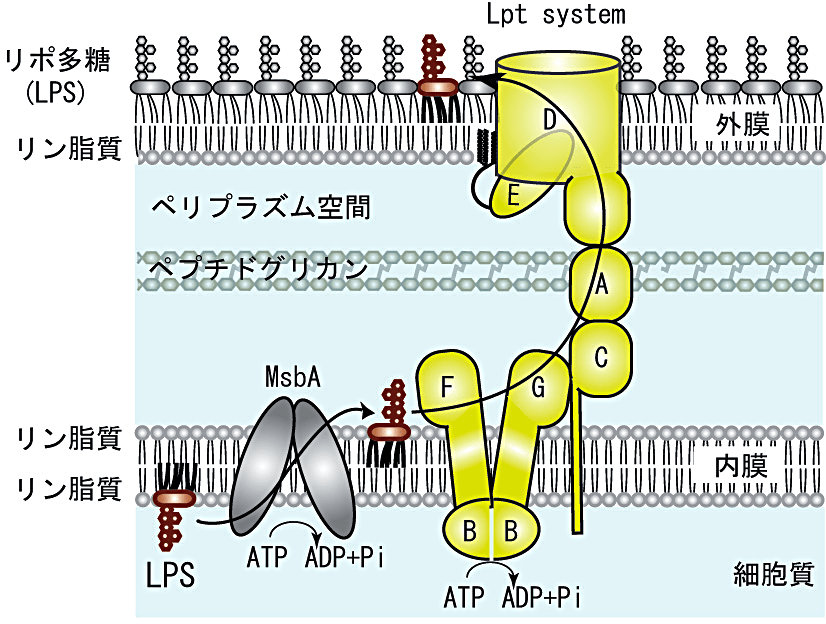
大腸菌を含むグラム陰性細菌は細胞膜(内膜)の外側にもう一つの膜構造(外膜)を持つ。内膜がリン脂質の二重層で構成されているのに対し、外膜は内側がリン脂質、細胞表層である外側が LPS で構成されている(図1)。LPS は脂肪酸鎖、糖鎖、リン酸基で構成されているが、その構造は一様ではなく、例えば大腸菌では6本の脂肪酸鎖に、多いものでは数百の糖が結合している。この両親媒性の構造は、疎水性、親水性、両方の分子の侵入を妨げるため、グラム陰性細菌に対して抗菌薬が効きにくい大きな要因の一つとなっている。本研究の目的は、細胞質内で合成された LPS が細胞表層まで輸送される分子機構を解析する実験系を確立し、この輸送機構を標的とした新規抗菌薬開発に役立てることである。私が細菌内での LPS 輸送機構に関する研究を開始した2009年当時は、内膜から細胞表層への LPS 輸送に関わる Lpt(Lipopolysaccharide transport)システムを構成する7つの因子がようやく出そろった頃であった。学生時代に、リポ蛋白質という脂質修飾された蛋白質の細菌内での輸送を担う Lol(Localization of lipoproteins)システムの機能解析という、比較的近い分野の研究を行っていたこともあり、Lpt 因子を同定したグループの一つである Harvard 大学の Daniel Kahne 研究室に博士研究員として加わる機会に恵まれた。細胞質で合成された LPS は、内膜上の ABC(ATP-binding cassette)トランスポーター MsbA の作用によって内膜の細胞質側からペリプラズム側へと反転し、その後 Lpt システムによって細胞表層へと輸送される(図1)。ABC トランスポーターである LptBFG と1回膜貫通型の膜蛋白質 LptC は内膜で複合体を形成しており、外膜ではβ-バレル蛋白質 LptD とリポ蛋白質 Lpt Eが複合体を形成している (2)。また、内膜と外膜の間のペリプラズム空間には水溶性蛋白質 LptA が局在している。どの因子を欠損させても外膜の形成に異常が見られ、また内膜上に LPS が蓄積するという現象が観察されることから、Lpt システムが内膜から細胞表層へのLPS輸送に関与していることが示唆されていたが、その輸送中間体は観察されたことがなかった (3, 4) 。輸送中間体の観察には細菌内での直接的な相互作用を検出する必要があるが、LPS は非常に大きな疎水的領域を持ち、様々な蛋白質に非特異的に吸着しやすい性質を持つことから、特異的な相互作用の検出は困難であった。この問題を解決するために用いた手法が in vivo 光架橋法である。この手法は、任意の部位に光架橋性のアミノ酸を導入した蛋白質を細菌内で発現させ、その後 UV 照射により蛋白質に取り込まれた光架橋性のアミノ酸とその近傍の分子との間に共有結合を形成させる。生じた複合体を Western blotting などで検出することで、細菌内での特異的な相互作用およびその部位の解明が可能となる (5, 6) 。蛋白質間のみではなく蛋白質–脂質間の相互作用解析も可能であることは、Lol 因子とリポ蛋白質の相互作用解析で確認済みであったため (7) 、LPS の脂質部分と結合すると考えられていた Lpt 因子に光架橋性のアミノ酸を導入し、LPS–Lpt 因子間の相互作用を解析したところ、細菌内での Lpt システムの関与を裏付ける LPS 輸送中間体が検出された (8) 。また、この際に明らかになった LPS との相互作用部位に光架橋性アミノ酸を導入した Lpt 変異体を大腸菌で発現させ、外膜を破壊してスフェロプラストを調製し、その細胞質を ±ATP のバッファーに置換した right-side out の膜小胞を用いて、内膜上から LptC、そして外部から加えた LptA へと ATP 依存的に LPS が輸送される過程を観察する in vitro の実験系を構築した (8) 。しかしながら、この画分に、LPS との相互作用部位に光架橋性アミノ酸を導入した LptD 変異体を発現させた外膜画分を LptA と共に加えても、LptD への LPS 輸送は観察されなかった。
そこで次に取り組んだのが、今回発表させていただいた7つの精製 Lpt 因子を用いた再構成系での LPS 輸送解析である。膜小胞を用いた実験では各因子の発現量の調節が難しく、不完全な複合体が存在してしまう。例えば、LptC と複合体を形成していない LptBFG 複合体は膜から LPS を受け取れるが、LptC に LPS を受け渡せないため、そこで輸送が止まってしまう。精製因子による実験系は膜小胞を用いた実験とは異なり、正しい分子比の複合体を精製して用いるため、より高効率な LPS 輸送が可能となる。また、Lpt 以外の因子は存在しないため、阻害剤の評価などにも応用可能な利点がある。本研究では、内膜から外膜への LPS 輸送機構解析のために、LPS と内膜複合体 LptBFGC を組み込んだリポソーム、および外膜複合体 LptDE を組み込んだリポソームの二種類を作製し、そこにペリプラズム因子 LptA を加えることで、内膜から外膜への LPS 輸送を観察した (9) 。輸送観察には、in vivo 光架橋法により同定した LPS と相互作用する部位に光架橋性アミノ酸を導入した LptC、LptA、LptD の変異体を用いた。LptA を外膜リポソームと反応させて LptDE-LptA 複合体を形成させた後、過剰な LptA を取り除き、内膜リポソームを加えることで LptBFGC-LptA-LptDE 複合体が形成され、内膜リポソームから LptD までの LPS 輸送を観察することに成功した。2012年の論文 (8) では公表を控えたが、当時すでに LptBFGC を組み込んだ内膜リポソームからペリプラズム因子 LptA への LPS 輸送を観察する、5つの精製因子による再構成は完成していた。また、外膜への輸送を観察するために必要な LptD の LPS との相互作用部位の解析も in vivo 光架橋法により明らかにしていたが、この LptD の in vivo 光架橋の結果に関しては残念ながら我々が7つの精製因子による再構成を発表する前に、他のグループによって発表されてしまった (10) 。このこともあり、研究の方向性に修正が必要となり、精製因子を用いた再構成系による機能解析に加え、この系を用いて内膜と外膜を繋ぐ7因子複合体の存在証明に取り組むことになった。当時、LptA はペリプラズム空間を浮遊するシャペロンか、それとも内膜複合体 LptBFGC と外膜複合体 LptDE を繋ぐ橋の一部なのかという議論の結論はまだ出ていなかった。二種類のリポソームを使った機能解析の際に、7因子は複合体を形成しているであろうことは強く示唆されていたが、それを確認すべく蛍光標識した脂質を用いてリポソームを作製し、フローサイトメトリーや蛍光顕微鏡を用いた解析を行った。その結果、LptA 依存的に内膜と外膜のリポソームが繋がれることが明らかになり、またセルソーターによって分取した、LptA によって繋がれた二種のリポソーム結合体において ATP 依存的な LPS 輸送が確認された。これらの結果から、Lpt システムは、内膜、ペリプラズム空間、外膜に局在する計7つの因子が1つの複合体を形成することで、内膜から外膜へと効率よく LPS を輸送することが示唆された (9) 。なお、この複合体内の LptA の分子数についてはまだ答えは出ていない。
私が Lpt システムの研究を始めた頃、構造が解かれていた因子は LptA と LptE の2つのみであったが、それから10年も経たない現在、7因子全ての構造が明らかになっている。構造解析技術の進展も大きな要因ではあるが、LptD を標的とした抗菌薬の候補が開発されたことで (11)、Lpt システムが新規抗菌剤の標的として注目を集めたことも要因の一つであると考えられる。本研究で完成させた7つの精製 Lpt 因子による LPS 輸送の再構成系は、LPS 輸送阻害剤の評価を行う際にも非常に有用なツールとなる。現在は細菌の研究から少し離れて、アミノ酸トランスポーターを標的とした抗がん薬に関連した研究などを行っているが、こちらの分野でも蛋白質科学的手法によるトランスポーターの分子機構解析や薬剤との相互作用解析など、新規抗がん薬の開発へと繋がるような研究を行っていきたい。
文献
- 塩田拓也, 蛋白質科学会アーカイブ, 9, e085 (2016).
- Okuda, S. et al., Nat Rev Microbiol., 14, 337–345 (2016).
- Sperandeo, P. et al., J. Bacteriol., 190, 4460–4469 (2008).
- Ruiz, N. et al., Proc. Natl. Acad. Sci. U.S.A., 105, 5537–5542 (2008).
- Ryu, Y. & Schultz, PG., Nat Methods, 3, 263–265 (2006).
- Mori, H. & Ito, K., Proc. Natl. Acad. Sci. U.S.A., 103, 16159–16164 (2006).
- Okuda, S. & Tokuda, H., Proc. Natl. Acad. Sci. U.S.A., 106, 5877–5882 (2009).
- Okuda, S. et al., Science, 338, 1214–1217 (2012).
- Sherman, DJ.,† Xie, R.,† Taylor, RJ.,† George, AH.,† Okuda, S.,† et al., Science, 359, 798–801 (2018) (†equal contribution).
- Li, X. et al., Sci Rep., 5, 11883 (2015).
- Srinivas, N. et al., Science, 327, 1010–1013 (2010).