ミトコンドリアタンパク質輸送ゲート TOM 複合体の立体構造が解けるまで
金沢大学・医薬保健研究域・保健学系- 荒磯裕平, 蛋白質科学会アーカイブ, 13, Essay 10 (2020)
- https://www.pssj.jp/archives/essay/Es_10/Es_10.html
はじめに
この度は、第20回日本蛋白質科学会年会にて若手奨励賞優秀賞に選んでいただき、誠にありがとうございました。また、新型コロナウイルスの感染拡大の中、Zoom を用いたオンライン発表という初めての試みによる若手奨励賞シンポジウムを開催していただき、ご尽力いただいた先生方、学会スタッフの皆様に厚く御礼申し上げます。
オンライン・シンポジウムでは、ミトコンドリアへのタンパク質輸送ゲート TOM 複合体の立体構造から明らかになったタンパク質輸送機構について発表いたしましたが、本稿では、シンポジウムではお話しできなかった TOM 複合体の構造決定に至るまでの軌跡について、当時のエピソードも交えて紹介したいと思います。
TOM 複合体の構造解析
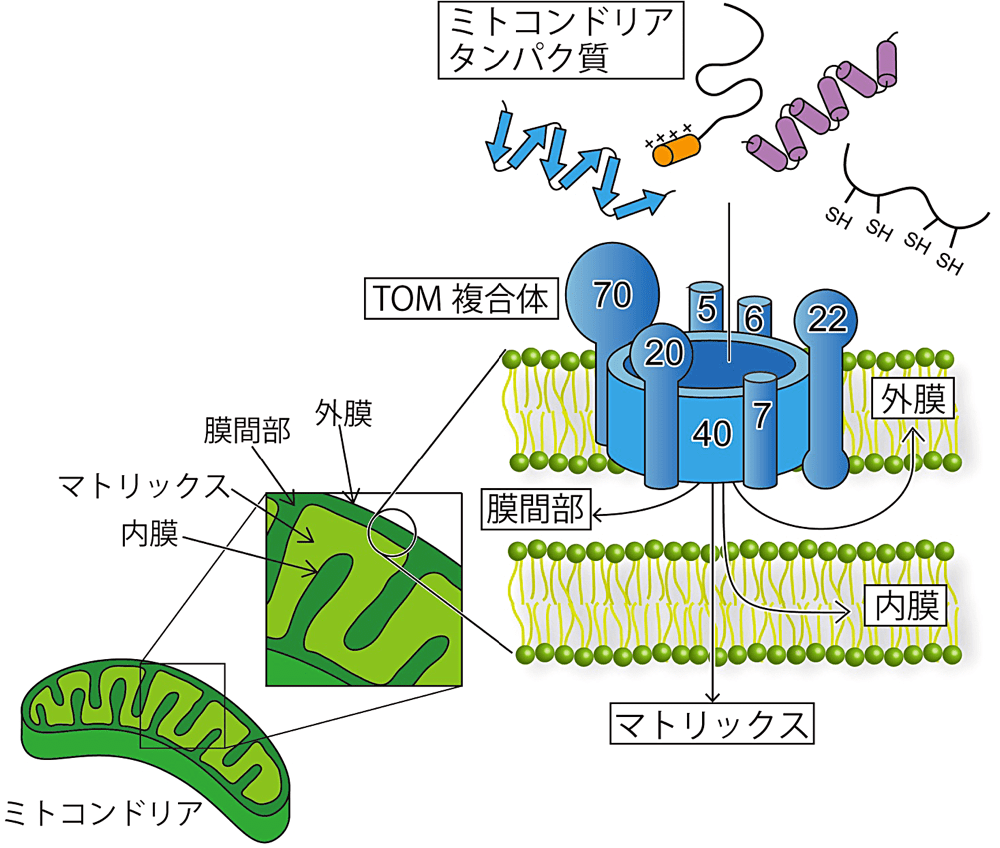
ミトコンドリアは、エネルギー生産をはじめ、様々な代謝反応やシグナル伝達に深く関与し、細胞が恒常性を維持するために重要な役割を担う細胞小器官(オルガネラ)です。ミトコンドリアで働くタンパク質は約1,000種類にも及び、そのうち約99%はサイトゾルで合成された後にミトコンドリアへ輸送されます(1)。Translocase of the outer mitochondrial membrane(TOM)複合体はミトコンドリア外膜に存在する膜透過装置(トランスロケータ)で、ミトコンドリア内へのタンパク質の取り込みと仕分けを担うタンパク質輸送ゲートです(図1)。TOM 複合体には、多様な性質を持つミトコンドリアタンパク質を認識し、目的地へ正しく輸送するための巧妙な仕組みが備わっているはずですが、その分子メカニズムには不明な点が多く残っています。私たちは、こうした問題に切り込み、TOM 複合体を中心としたミトコンドリアタンパク質輸送機構を理解するため、TOM 複合体の立体構造解析に挑戦しました。TOM 複合体は、β バレル型チャネル Tom40 と6つの α ヘリカルなサブユニットで構成されるヘテロ膜タンパク質複合体であり、ミトコンドリア膜上では構成サブユニットの出入りや空間配置の変化が起こり、複数の会合状態を取ると考えられています(2)。そのため、膜貫通領域を含む全長での発現・精製が非常に難しく、私が京都産業大学 遠藤 斗志也先生のもとで本研究を開始した2014年春の段階では、構造解析はおろか試料調製の方向性も定まっていない状況でした。そこでまずは、TOM 複合体の精製方法の検討に着手しました。
TOM 複合体を構成する遺伝子群は1990年頃から次々と同定され生化学解析が盛んに行われてきました。2000年前後にはドイツの2つの研究グループから、それぞれアカパンカビ、出芽酵母由来 TOM 複合体のネガティブ染色による電顕像が報告され(3,4)、さらに2008年には Model らによって~18Å 分解能の TOM 複合体の電顕構造が解明されました(5)。これらの先行研究では、TOM 複合体の構成サブユニットである TOM22 遺伝子の3’ 側にヒスチジンタグを導入した細胞株を用いて、過剰発現をせずにミトコンドリア膜画分から TOM 複合体をアフィニティ精製することで、TOM 複合体試料を調製していました。Tom40 をはじめとする構成サブユニットが純度高く共精製され、精製 TOM 複合体は2つの Tom40 チャネルを持つ二量体構造と、3つの Tom40 チャネルを持つ三量体構造の混在した状態にあることが示されました。
精製方法の模索
しかし、この方法では過剰発現をせずミトコンドリアに局在する内在性の TOM 複合体を精製するため、高収量が見込めません。X 線結晶構造解析による構造決定を想定していた当時の私は、実験室でハンドリング可能な培養スケールで高収量が期待できる他の精製方法を模索していました。まずは大腸菌の過剰発現系による発現・精製を試みましたが、均一な TOM 複合体どころか、単独の Tom40 チャネルを精製することもできませんでした。出芽酵母を利用しようにも、TOM 複合体の過剰発現は細胞毒性を持つことが知られており、有効な発現系を構築することができないまま、月日だけが経過しました。
やはり酵母ミトコンドリアから内在性の TOM 複合体を精製するのがベストなのでしょうか。私たちは、先行研究と同様に Tom22 の C 末端にヒスチジンタグを導入した酵母株を作成し、2 L スケールで培養した酵母細胞から単離したミトコンドリアを用いて、TOM 複合体の精製を試みました。その結果、Tom40 や Tom22 サブユニットを含む分子量約 450 kDa の TOM 複合体を精製可能であることが分かり、プロジェクトに一筋の光明が差し込みました。しかし、構造解析に必要な量を精製することはできず、高効率化・高収量化のための工夫が次なる課題として立ちはだかりました。
ブレイクスルーとなった酵母破砕法
まずはセオリー通りに培養量を増やすことを考えましたが、一般的な実験室でルーチン的に培養を行うことが可能な 12~15 L(5 L フラスコ6本)の培養量ではまだ収量が足りない計算です。さらに、酵母細胞は硬い細胞壁に覆われているため大腸菌のようにソニケーションによって簡単に破砕することはできません。生化学解析においては、溶解酵素である zymolyase によって細胞壁処理を行った後にダウンス型ホモジナイザーによって細胞を破砕し、遠心分画によってミトコンドリアを含む膜画分を回収する方法が用いられますが、2 L 以上の大容量の培養スケールでの処理には向かない作業です。したがって、単純に培養量を増やしても、今度は細胞を破砕する方法がありません。どうしたら大容量の酵母細胞を効率よく破砕することができるでしょうか?その答えは、ステンレス製ブレンダーにありました。
私たちは、液体窒素で凍結した酵母細胞を物理的にパウダー状に粉砕することで大容量の酵母細胞を一気に破砕する方法を開発しました。数 100 mL の液体窒素の中に酵母細胞懸濁液をゆっくり滴下し、フレーク状に酵母細胞を凍結させ、液体窒素で満たしたステンレスブレンダーを用いて物理的に酵母フレークを破砕します。私たちは、幾多のトライ & エラーの末に酵母がパウダー状にまで粉砕される条件を最適化し、これらを緩衝液に懸濁し遠心分画することにより、高効率でミトコンドリア膜画分を調製する方法を確立しました。これが本研究のブレイクスルーと言っても過言ではありません。この方法を用いれば、12 L スケールで培養した酵母細胞(湿重量200~300 g 程度)も難なく破砕することが可能です。最終的に12 L 培養から100~150 μg 程度の収量で TOM 複合体が得られ、ついに構造解析が射程に入ってきました。
クライオ電子顕微鏡
こうして TOM 複合体の試料調製プロトコルを構築していく過程で、構造生物学研究に “クライオ電子顕微鏡解析” という新たな潮流が生まれました。私が TOM 複合体の調製に成功し始めたのは2015年秋頃のことになりますが、同年10 月に日本で開催された国際シンポジウムにおいて、独・ミュンヘン大学 Roland Beckmann 研の Thomas Becker 博士のクライオ電子顕微鏡解析の講演を聴き、その後に Becker 博士と直接お話しをしたことは私にとって良いきっかけとなりました。クライオ電子顕微鏡を使えば TOM 複合体の構造解析が達成できるのではないか?という希望を抱き、帰りの電車に揺られていたことを今でも覚えています。それからクライオ電子顕微鏡解析に取り組むことのできる環境を探し、年が明けて2016年1月から縁あって東京大学 吉川 雅英教授、包 明久助教との共同研究でクライオ電子顕微鏡解析をスタートさせることができました。ネガティブ染色による粒子の均一性確認までは順調に進んだものの、クライオ測定になると粒子がほとんど見えない、という状況がしばらく続きました。京都産業大学 遠藤研の東京お台場ラボでタンパク質試料を調製し、電子顕微鏡設備のある東京大学 吉川研に試料を持ち込んでグリッド作成や予備観察を行い、様々なパラメータの条件検討を進めていきました。2016年夏には Direct electron detector が備わったハイエンドの透過型電子顕微鏡 Titan Krios(FEI)の共同利用をいち早く開始していた大阪大学 蛋白質研究所で何度か測定させてもらい、2017年春にはミュンヘン大学 Roland Beckman 研に2週間のラボステイも経験し、トライ & エラーを繰り返しながらクライオ電子顕微鏡解析についてゼロから勉強しました。ミュンヘン大学では研究所内の部屋を借りて寝泊まりし、近所のスーパーで食材を仕入れてラボのキッチンで調理して食べるといった生活を送り、国際研究交流という観点でも面白い経験ができました。キッチンには測定の進捗状況がリアルタイムで大きく映し出されるモニターがありました。時には測定の様子を眺めながら、焼きたてのソーセージとビールを片手に現地の学生やポスドクと研究生活や文化の違いについて語り合い、楽しい時間を過ごすことができました。Roland Beckmann 教授に、日本から持っていったグリッドを褒めてもらえたのは良い思い出であり、その後の解析に向けて大きな自信にもなりました。
ついに構造決定
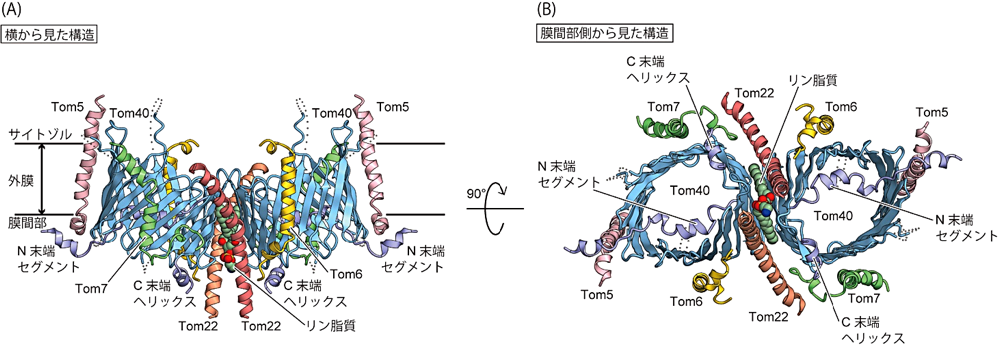
2018年夏頃には東京大学でも Titan Krios の運用が始まり、電子顕微鏡施設の高度化が一気に進みました。それに呼応する形で TOM 複合体の構造解析も加速度的な進展を遂げ、同年秋頃についに構造決定することができました(図2)。私たちの決定した電顕構造は、2つの Tom40 チャネルを有する二量体構造で、各サブユニットの空間配置と相互作用様式をアミノ酸残基レベルで明らかにすることができました(6)。構造を決めたときの試料調製では、酵母破砕時の緩衝液量などを再検討していたところで、いつもとは異なる条件でミトコンドリア調製を試していました。膜画分の可溶化からはルーチン的な精製を行なっていたのですが、ぼんやり見つめていたゲル濾過のピークが見たこともない大きな数値を示し、その場で東京大学の包助教に電話をかけて、すぐに東京大学へ試料を持っていきました。私はクライオ電子顕微鏡グリッド作成の前に必ず試料を超遠心することにしていますが、これまでの試料だと、超遠心の前後で試料濃度は必ず何割か減少していました。ところが今回の試料では、減少することなく高濃度をキープしていたのです。ついに安定した TOM 複合体が精製できる条件が見つかりました。「良い構造解析のためには良い精製から」とはまさにこのことでした。
おわりに
こうして研究開始から約4年半をかけて、私たちは酵母由来 TOM 複合体の立体構造を決定することができました。その大きな一因となったのは、2010年代後半のクライオ電子顕微鏡による構造解析技術の急速な発展に他なりません。その一方で、タンパク質精製については、破砕や遠心、溶液条件といったオールドスクールな基本事項を徹底的に見直したことが構造決定の決め手となりました。
近年、分子量の大きなタンパク質複合体の電顕構造が次々と解明されています。TOM 複合体についても、私たちを含めた4つのグループから別々に構造が報告されており(6-9)、TOM 複合体の構造研究は新しいフェーズに入りました。今後は、TOM 複合体の三量体をはじめとする別フォームや、基質タンパク質と過渡的に結合した膜透過中間体、他の相互作用因子との super complex の立体構造解析を進めることで、TOM 複合体を中心としたミトコンドリアタンパク質輸送メカニズムの理解をさらに深めることが必要とされています。最先端の解析技術を導入するとともに、良いタンパク質精製を行い、これからもミトコンドリアタンパク質の構造生物学の発展に貢献していきたいと考えています。
文献
- Endo, T. & Yamano, K. Biol. Chem., 390, 723‒730 (2009).
- Shiota, T. et al., Science, 349, 1544–1548 (2015).
- Künkele, K. P. et al., Cell, 93, 1009–1019 (1998).
- Model, K. et al., J. Mol. Biol. 316, 657-666 (2002).
- Model, K. et al., J. Mol. Biol. 383, 1049–1057 (2008).
- Araiso, Y. et al., Nature, 575, 395‒401 (2019).
- Bausewein, T. et al., Cell, 170, 693‒700 (2017).
- Tucker, K. & Park, E., Nat. Struct. Mol. Biol. 26, 1158‒1166 (2019).
- Wang, W., et al., Cell Discov. 6, 67 (2020).