結晶化というキーワードからアミロイドーシス予防を考える
大阪大学・大学院工学研究科- 中島吉太郎, 蛋白質科学会アーカイブ, 16, Essay 14 (2023)
- https://www.pssj.jp/archives/essay/Es_14/Es_14.html
1. はじめに
この度は、日本蛋白質科学会第23回年会若手奨励賞・優秀賞をいただき、誠に光栄に存じます。執筆にあたり、今回の受賞研究内容(1)をまとめ直そうと思ったのですが、ありがたいことに他にも日本語の解説記事を執筆する機会をいただき(2,3)、ほとんど同じような文章になってしまい、これではいけないと思うとどうも筆が進みません。そこで、少し角度を変え、今回は、私が取り組む「超音波を用いたアミロイドーシスの発症予測に関する研究」について、酢酸ナトリウムの結晶化を例にとり、研究内容を伝えることを試みてみたいと思います。
2. 酢酸ナトリウムの結晶化
図1を見てください。今、皆さんの目の前に10本の試験管があります。すべての試験管は酢酸ナトリウムの水溶液を含んでいます。10本のうち9本は飽和溶液で残りの1本は過飽和溶液だとします。もう少し定量的に設定すると、すべての試験管には10 mLの水溶液が入っており、9本の試験管には4 g/10 mL(今回の実験条件下での溶解度相当)の酢酸ナトリウムが、残り1本の試験管には6 g/10 mL(過飽和溶液)の酢酸ナトリウムが入っています。皆さんの手元には、(1)空の試験管 × 10本、(2)5 mLの水が入った試験管 × 1本、(3)水溶液を移し替えることができるピペットがあります。重さを測ったり、溶液を温めたりすることはできません。
ここで皆さんにお願いしたいのは、「与えられた5 mLの水を使って、酢酸ナトリウムが結晶化しないようにしてください」ということです。溶液が過飽和状態である以上、溶液に衝撃が加わるとそれをきっかけに結晶化が始まってしまう可能性があります。過飽和溶液で酢酸ナトリウムの結晶化が始まり、過飽和分の2 gの結晶が形成されてしまったら挑戦は失敗とさせてもらいます。なお、ここでは、結晶化は衝撃によって発生し、穏やかなピペット操作では起きないこととします。
● Aさんの対応
Aさんは、「過飽和分のすべての酢酸ナトリウムが結晶化しなければいいということなので、結晶化が始まったことを目視で確認し、その後に5 mLの水を添加しよう」と考え、酢酸ナトリウム溶液が入った10本の試験管をにらみつけ、いつでも水を添加できるように準備していました。しかし、なかなか結晶化は起きません。不思議なもので過飽和状態は意外に安定しているのです。Aさんは、足を机にぶつけ、その衝撃で酢酸ナトリウムの結晶化が始まりました。Aさんは結晶化が想像よりもものすごい勢いで進むことに驚きながらも結晶化が進む試験管に水を加え、間一髪で挑戦は成功に終わりました。
● Bさんの対応
Bさんは、Aさんの挑戦の話を聞き、「過飽和溶液に刺激を加えると結晶化が起こるのか」と考えているうちにいい対策をひらめきました。10本の試験管から少量ずつ酢酸ナトリウム溶液に衝撃を与えないようにそっと空の試験管にそれぞれ移し替えていき、試験管を1本ずつ持ち上げてシャカシャカと振って、酢酸ナトリウム溶液に衝撃を与えていきました。すると、ある1本だけが結晶化しました。そして、元をたどり、結晶が形成された溶液を取り出した試験管に5 mLの水を加え、見事に挑戦は成功です。試験管全体を結晶化させないために、溶液を一部だけ取り出し、試験管を振ることで強制的に結晶化を引き起こす試験を行い、結晶化が起きる前にどれが過飽和溶液かを見分けました。
● 酢酸ナトリウムの結晶化とアミロイドーシス予防の関係
酢酸ナトリウムの問題いかがだったでしょうか?誤解を恐れずにいうと、私の頭の中では、「どうしたらアミロイドーシスの発症を防ぐことができるか」という問題は、「どうしたら酢酸ナトリウム溶液から結晶が形成しないよう対策できるか」という問題に置き換えることができます。そのため、酢酸ナトリウムの結晶化の話をさせていただきました。
上の問題において、試験管の中の水溶液は、私たちの体の中の血液などに、酢酸ナトリウムの結晶化は蛋白質のアミロイド線維形成に、そして、与えられた5 mLの水は、アミロイド線維形成を妨げる薬剤に対応しております。Aさんの対応は、アミロイドシード検出に基づく早期診断法(4,5)の例えです。一方、Bさんの対応は、我々が目指す発症予測法 [1] に相当します。発症予測法では、Bさんが行った試験管をシャカシャカと振って結晶化を引き起こすという予備実験が重要な役割を果たしましたが、我々の研究では、血液検査などで採取した生体試料に独自開発した超音波装置(6,7)で超音波を照射することで強制的にアミロイド線維形成を引き起こす試験を行い、アミロイド線維形成リスクを評価することを目指します。
私たちの研究は、アミロイド線維形成の原理をよく考えたときに、アミロイドーシスを予防するためにBさんのような対応を取ることが有効で、それをどのようにすれば実現できるかを考えるというものです。以下でその概要を説明させていただきます。
3. アミロイドーシスの予防戦略
アミロイド線維は、変性蛋白質が形成する結晶性の凝集体です。酢酸ナトリウムの結晶とは、見た目・大きさ・形成速度などは異なるものの、アミロイド線維も規則的な構造を有し、その形成反応の本質は溶解度に制御された相転移(8,9)であることが知られています。
結晶形成反応は核形成段階とそれに続く成長段階の2段階に大別することができます。このうち核形成段階は高いエネルギー障壁を有する律速段階であり、長い時間を要します。一方、その後の成長反応は核形成反応が完了すると速やかに進行する速い反応です。結晶性の凝集体であるアミロイド線維も例に漏れず、その形成反応は核形成―成長の2段階で記述することができ、核形成反応が律速段階です(10)(図2)。
酢酸ナトリウムの場合は、過飽和溶液に種結晶を添加すると、それを起点とし、瞬く間に結晶成長が起こります。興味のある方はぜひ動画サイト等で動画を見てください。アミロイド線維でも類似した反応がみられ、変性蛋白質の過飽和溶液にあらかじめ作ったアミロイド線維をひとかけら添加すると、即座にアミロイド線維形成が開始します。これは、種の英語であるSeedを語源とし、シーディング反応(Seeding reaction)と呼ばれます(11)。添加した結晶を鋳型として結晶が成長することで、律速段階である核形成反応をスキップして反応が進むため即座に結晶形成が起きると解釈することができます。
● アミロイドーシス
アミロイドーシスは、体の中で蛋白質が異常に凝集し、アミロイド線維が形成されることで引き起こされる疾患の総称で、アルツハイマー病やパーキンソン病がその代表例です。診断・治療法が確立されていない疾患が多く含まれるのが特徴で、これらを解決することの社会的意義は計り知れません。アミロイドーシスでは、アミロイド線維が生体組織に沈着し、様々な機能不全を引き起こします。酢酸ナトリウムに置き換えると、溶液に溶けている時は安全だった酢酸ナトリウムが、結晶化すると突然が試験管の中で悪さをするような状況です。身体に負担がかかる前に疾患の発症を予測し、先回りして手を打つことがより好ましいと考えるのが自然でしょう。これを実現するためには、できるだけ早くアミロイド形成を予見すること(診断)と、それを防ぐ方策(薬剤)の両輪が不可欠です。
現在、アミロイドーシスに対する薬剤には、形成されたアミロイド線維を取り除くもの(12)と、そもそもアミロイド線維ができないように抑制するもの(13,14)があり、これらの開発が急ピッチで進められています。私たちの研究は、こういった薬剤を誰に投与すべきかをできるだけ早く判断したいという動機のもと行っております。以下、アミロイドーシスに対する早期診断と発症予測という2つの戦略について説明させてもらいます。
● アミロイドーシスの早期診断
身体の中で形成されたアミロイド線維をできるだけ早く見つけて、生体の機能に異常が起きる前にそれらを食い止めることを目指すのが、「早期診断」です。近年、血液や脳脊髄液の中から極微量のアミロイド線維を見つける技術に関する研究(4,5)が進められています。先ほど説明したシーディング反応を利用して、準備した変性蛋白質の過飽和溶液に血液等を添加し、そこに含まれる微量のアミロイド線維を増幅し、検出します。生体内でアミロイド線維が形成されてから臨床症状が発症するまでには猶予がある(15)ことが示唆されており、線維伸長反応が始まった後に疾患に対する対策を講じようという戦略です。酢酸ナトリウムの問題でAさんがとった、「結晶形成が始まってから本当の問題が起きるまでの間に対策を講じる」という方針に類似しています。
● アミロイドーシスの発症予測
これに対し、我々が目指すのは「発症予測(1)」です。「将来、アミロイド形成が起きる可能性の高い人を予測し、事前に対策することでそもそもアミロイド形成を起こさないことを目指す」という戦略です。酢酸ナトリウムの問題のBさんの対応に相当します。こちらでも同様、血液等を用いた試験をするのですが、すでに形成された線維を検出するのではなく、将来アミロイド線維が形成される可能性を推測するために試験を行います。そして、早期診断でアプローチするタイミングよりも、さらに速い段階で原因を取り除くことを目指します。しつこいですが、アミロイド線維形成は結晶形成・相転移(8,9)であり、ひとたび核が形成されると、ものすごい勢いで進行するのです。生体内では、臨床症状が出るまでに猶予(15)があるということですが、核が形成される前にアプローチしたいと思いませんか。
4. アミロイドーシス発症予測の実現に向けた私たちの研究
● アミロイドーシス発症予測の難しさと現状
ここまでの私の説明は、「発症予測は、根本的な解決に繋がりそうで魅力的に聞こえるが、具体性に欠けるな」という印象を与えたかもしれません。その通りだと私も思います。その要因の一つは、早期診断では、生体内に存在するアミロイド線維を検出するということで、具体的なバイオマーカー(診断指標となる標的分子)があるのに対し、発症予測については、現時点では、これを調べればよいという標的分子を明確化することが難しいのです。これは、発症予測を実現するためには「どのような機序で生体内でアミロイド線維形成が起きるか」ということをより深く理解する必要があるからだと思います。そもそも、生体内の条件に近い緩衝液中でアミロイド線維形成を起こす蛋白質を生体濃度程度に調製して、その試験管をながめていても、なかなか(もしくは、全く)アミロイド線維形成を起こしてくれないのです。生体内におけるアミロイド線維形成は謎に満ちているのです。
それでも、一部のアミロイドーシスでは、発症予測的なアプローチが実現されています。その一例は、TTR型家族性アミロイドポリニューロパチーです。この疾患では、原因蛋白質のTTRに変異が入ることでTTRの天然四量体が不安定化し、アミロイド形成が起こることが明らかにされています(16)。そのため、遺伝子検査を経て、将来的に発症リスクが高い方々を特定し、TTRの四量体を安定化させるTafamidis(13)やTTR変異体の産出を抑制するPatisiran(14)を服用することで発症を予防・症状の進行を抑制します。原因蛋白質の変異が原因であることが明らかであるため、それに対してアプローチすることができます。
一方で、変異を有さない野生型のTTRにおいても、生体内でアミロイド線維が形成され、アミロイドーシスを引き起こすことがあります。こういったアミロイドーシスは、「孤発性」と呼ばれ、現状では予測が困難です。アルツハイマー病においても、家族性のものと孤発性のものがあり、特に孤発性のものについては、どのような理由でアミロイド線維を形成してしまう人とそうでない人が分かれるのかがよくわかっていないのが現状です。この孤発型アミロイドーシス発症の要因については、抽象的に言えば、生体内でアミロイド形成が何らかの因子によって促進されることや、アミロイド形成を抑制する因子が減少することなどが考えられます。このような因子と将来的なアミロイドーシス発症リスクの相関を明らかにすることができれば、発症予測法の実現に近づくでしょう。
● 透析アミロイドーシス
今回、私たちは、透析アミロイドーシス(17)と呼ばれる長期人工透析患者に特異的に発症するアミロイドーシスの発症機序について、臨床検体を用いて実験的研究を行いました。透析アミロイドーシスの原因蛋白質はβ2-ミクログロブリン(β2m)と呼ばれる蛋白質です。この蛋白質は、機能を果たすと腎臓で分解・再吸収され、正常血中濃度は1 μg/mL程度に保たれます。ところが、人工透析治療を受ける方々は腎不全を有するため、β2mの血中濃度が30 μg/mL程度に上昇します(図3)。そして、生体内でβ2mアミロイド線維が形成され、手首や腱にアミロイド線維が蓄積することで、手根管症候群などを引き起こします。β2mの濃度上昇がアミロイドーシス発症の大きなリスクであることが明らかにされています(18)。また、透析歴が長くなるにつれ発症率が上昇することも医学研究の結果から明らかされています(19)。しかし、図3を見ていただくとわかるように、β2mの血中濃度が高く、透析歴が長い方が必ずしもアミロイドーシスを発症するわけではないことがわかります。これらの話しの中で、β2mは基本的に野生型であると考えていただいて結構です。β2mにもアミロイド線維形成が促進される変異体があり、それらの線維構造も明らかにされていますが、疾患の表現型が異なることが知られています(20,21)。
● 環境因子へのアプローチ
ここで、再度、酢酸ナトリウムの例に戻ると、β2mの血中濃度が透析患者の中では比較的低いのに疾患を発症する人がいることは不思議なことです。なぜなら、酢酸ナトリウムの結晶化では、溶質の酢酸ナトリウムの濃度(過飽和度)が高ければ高いほど結晶化が速くなるからです。しかし、アミロイド線維形成は、溶解度に制御された相転移(8,9)であり、酢酸ナトリウムの結晶化と基本原理は同じです。では、試験管の中の結晶化では説明できないことが、生体内におけるアミロイド線維形成ではなぜ起こるのでしょうか。
私たちは、その理由の一つが「生体内の環境の違い」でないかと考えました。β2mの場合、アミロイド線維形成は血液中で起こります。血液中には、β2m以外の蛋白質が大量に存在します。おおよそ血清中の総蛋白質濃度70 mg/mLですので、その中でβ2mが占める割合は0.1%以下です。つまり、ものすごく混み合った環境で生体内のアミロイド形成は起きるのです。残りの99.9%の蛋白質の濃度変化等がどのようにβ2mのアミロイド線維形成に影響を及ぼすかを研究することが重要だと考えました。
そこで、図4(a)に示すような実験を行いました。30名の透析患者と健常者より血清を採取し、β2mモノマー溶液と混合します。そして、独自に開発を行ってきた超音波アミロイド誘導装置(6,7)を用いて、この検体に超音波を照射し、アミロイド形成反応を強制的に誘導します。そして、アミロイド形成反応の速度・形成量と血清中の様々な蛋白質の濃度との相関を調べました。この実験においても、蛋白質溶液をじっと眺めているだけでは、β2mモノマーの過飽和状態は解消されず、超音波により、強制的に反応を引き起こすことで、その形成量や反応速度を初めて評価することができます。まさに、酢酸ナトリウムの問題でBさんがとった、溶液を取り出し刺激を与えるということを超音波で実施しました。
図4(b)に、実験結果の一例を示します。実験結果は、血清成分はβ2mモノマーのアミロイド線維形成反応を抑制するということを示しました。しかし、その抑制の程度には、健常者の血清と透析患者の血清の間で顕著な差がありました。透析患者の血清成分は、β2mの線維形成を阻害する能力が低下しており、アミロイド線維形成という観点で危険な状況にあるということが明らかになりました。
そして、その要因を探ったところ、血清中に存在するアルブミンの量が低下すると形成されるアミロイド線維量が増加することが明らかになりました(図4(c))。さらに分析を進めると、血清アルブミンは、β2mモノマーと結合し、複合体を形成することで、アミロイド形成へ向かう変性モノマーの濃度を低下させ、アミロイド形成を防ぐことが明らかになりました。透析患者の血清中では、人工透析膜に関連する炎症反応に由来し、血清アルブミンの濃度が健常者よりも低下することが知られています。血清アルブミンは、アミロイド形成を妨げるひとつの重要な因子であるので、これらの濃度が低下することが、アミロイド形成のリスクとなりうることが示されました。また、論文(1)の中では、結晶核形成の速度を記述する古典的核形成理論を用いて、発症予測のための理論モデルの構築を行い、結晶形成とのアナロジーを用いて生体内のアミロイド線維形成反応を記述できる可能性を示唆しました。
5. 今後の展望
今回の研究(1)では、超音波アミロイド誘導装置(6,7)を用いた血清検体の解析により、生体内のアミロイド線維形成にかかわるリスク因子の一つとして血清アルブミン濃度の低下があげられることを示すことができました。その一方で、生体内でのアミロイド線維形成を調節する因子は、他にもたくさん存在すると予想され、それらを包括的に理解することがアミロイドーシスの発症予測のために重要であると考えられます。
これは明らかに単純なことではなく、アルブミンひとつをとっても、第23回年会の若手奨励賞シンポジウムで質問いただいたようなアルブミン自身の一次配列や化学的修飾の有無など、量的変化だけでなくその質的変化を調べる研究をする必要があります。また、複数の蛋白質が協力しながらアミロイド線維形成に対抗する蛋白質恒常性(プロテオスタシス)維持のネットワークを理解する必要があります。これらの解析には、オミクス解析や人工知能を基盤とした解析技術を応用する必要があるかもしれません。また、アミロイドーシスは老化に伴い発症リスクが上昇する老人性アミロイドーシスも少なくありません。そのため、老化に伴う生態環境の変容を理解するための長期的な研究も必要となるでしょう。
さらに複雑なのは、このような研究を様々なアミロイドーシスについて行う必要があることです。私たちが開発した超音波アミロイド誘導装置や結晶化という視点からの物理化学的研究は、これらを明らかにし、真のアミロイドーシス予防を実現するために必須であると考えております。これからも、今回の受賞を励みとし、超音波アミロイド誘導装置の適用範囲を拡大し、アミロイドーシスの発症機序の解明、発症予測法の確立に貢献することを目指して研究に取り組んでいきたいと思います。
謝辞
今回の研究課題「超音波アミロイド誘導装置を用いたアミロイドーシス発症リスクの研究」は、後藤祐児先生(大阪大学)と山本卓先生(新潟大学)に牽引していただき、山口圭一さん(大阪大学)と野地真広さん(京都大学)とともに得た実験結果をもとに、様々な共同研究者の方々と議論を深めてきたものであります。また、この研究は、株式会社ダイセルとの共同研究講座において、永松信二さんと松田洋和さん、並びに株式会社ダイセルの皆様に多大なるご支援を賜り行ってきました。これらの方々に謝意を示させていただきます。
文献
- Nakajima, K. et al., Nat. Commun., 13, 5689 (2022).
- 中島吉太郎ら, MEDCHEM NEWS, 33, 193–198 (2023).
- 中島吉太郎ら, 高圧力の科学と技術, in press.
- Shahnawaz, M. et al., Nature, 578, 273–277 (2020).
- Okuzumi, A. et al., Nat. Med., 29, 1448–1455 (2023).
- Nakajima, K. et al., Ultrason. Sonochem., 73, 105508 (2021).
- Nakajima, K. et al., ACS Chem. Neurosci., 12, 3456–3466 (2021).
- Yoshimura, Y. et al., Proc. Natl. Acad. Sci. USA., 109, 14446–14451 (2012).
- Michaels, T. C. T. et al., Nat. Rev. Phys., 5, 379–397 (2023).
- Iashechishyn, I. A. et al., ACS Chem. Neurosci., 8, 2152–2158 (2017).
- Jarrett, J. T. et al., Cell, 73, 1055–1058 (1993).
- Dyck, C. H. et al., N. Engl. J. Med., 388, 9–21 (2023).
- Razavi, H. et al., Angew. Chem. Int. Ed., 42, 2758–2761 (2003).
- Adams, D. et al., N. Engl. J. Med., 379, 11–21 (2018).
- Bateman, R. J. et al., N. Engl. J. Med., 367, 795–804 (2012).
- Yee, A. W. et al., Nat. Commun., 10, 925 (2019).
- Gejyo, F. et al., Biochem. Biophys. Res. Commun., 129, 701–706 (1985).
- Gejyo, F. et al., N. Engl. J. Med., 314, 585–586 (1986).
- Hoshino, J. et al., Nephrol. Dial. Transpl., 31, 595–602 (2016).
- Mizuno, H. et al., Amyloid, 28, 42–49 (2021).
- Wilkinson, M. et al., Nat. Commun., 14, 1190 (2023).
-
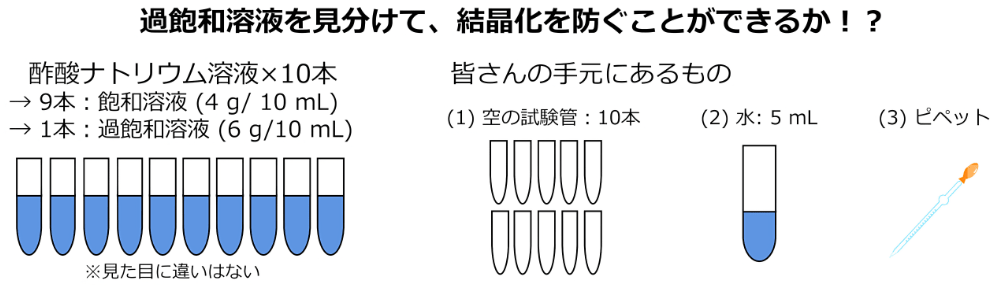
図1:酢酸ナトリウムの結晶化を防いでください! -
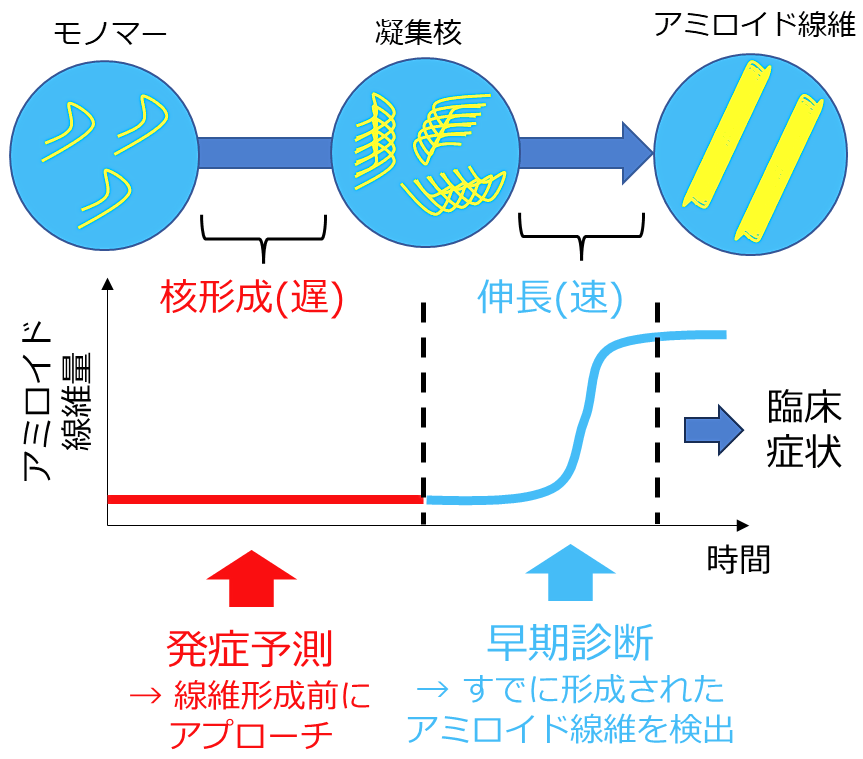
図2:アミロイド線維の形成反応と早期診断・発症予測法でアプローチするポイントの違い。アミロイド線維形成反応は、溶解度に制御された相転移。核形成反応が律速段階であり、その後の線維伸長反応は速やかに進行することが知られています。 -
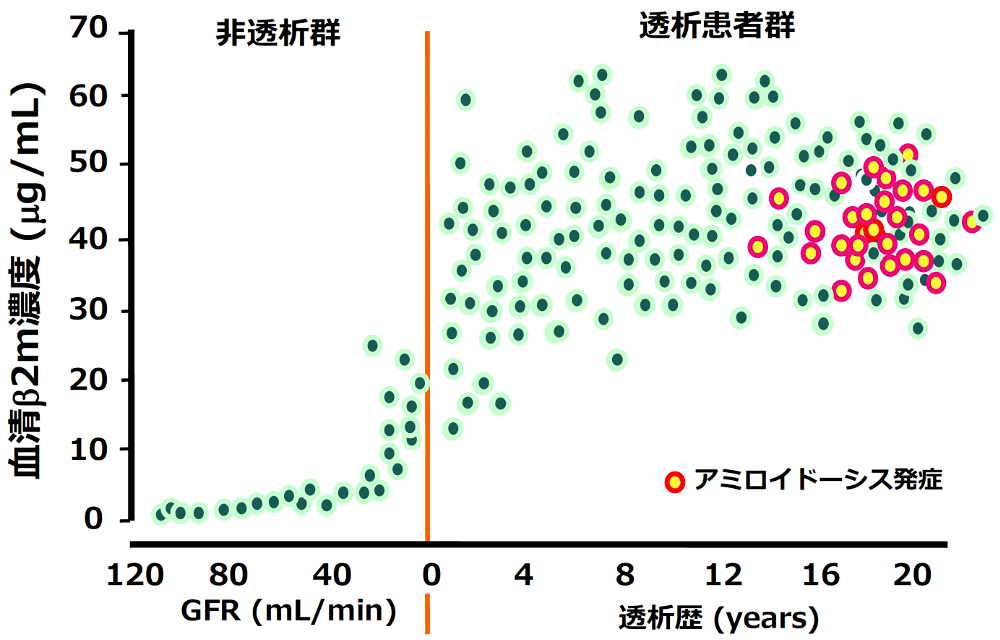
図3:血中β2m濃度・透析歴とアミロイドーシス発症の関連。GFRは糸球体濾過率(glomerular filtration rate)で低下するほど腎機能が低下していることを示す。(グラフ:下條文武先生ご提供) -
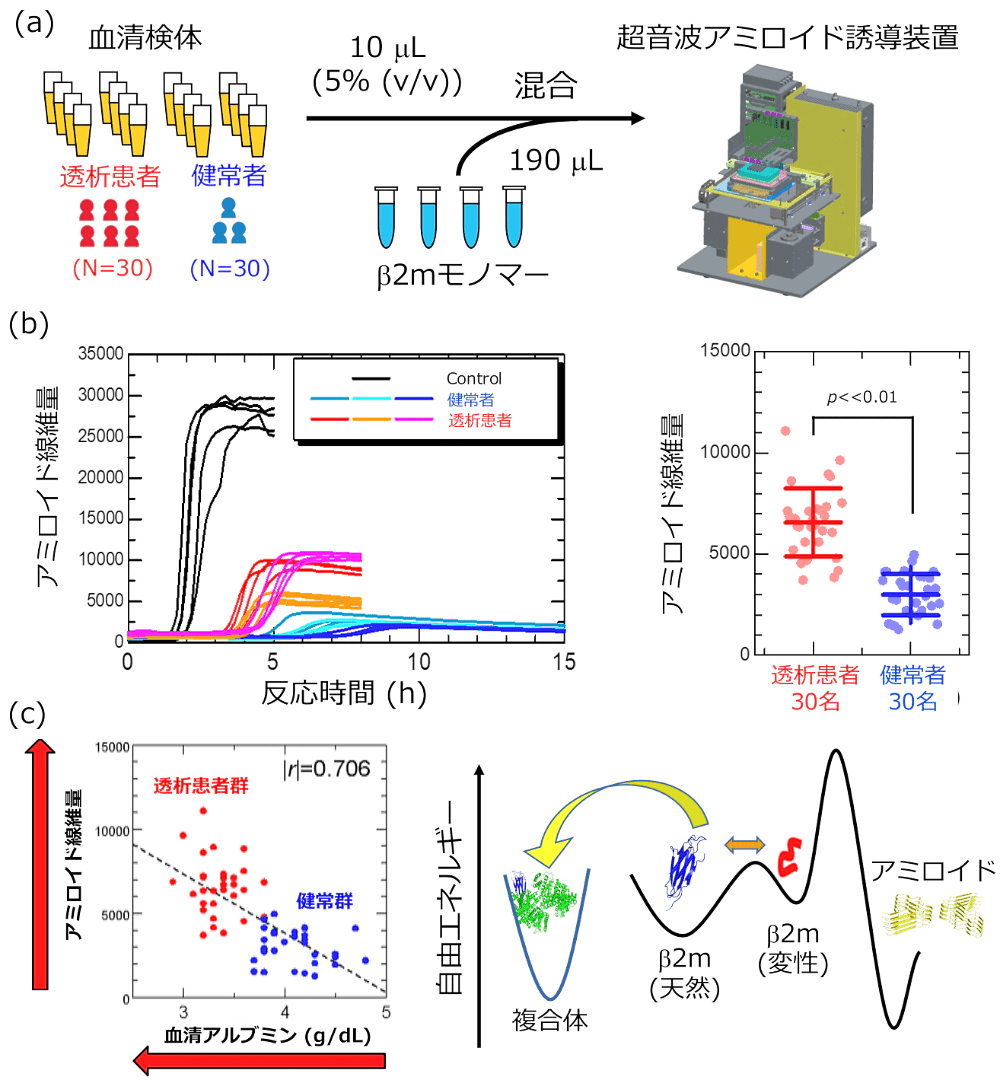
図4:(a) 本研究で血清環境がβ2mのアミロイド線維形成反応に及ぼす影響を研究するために行った実験。(b) 実験結果の一例。透析患者の血清を添加した場合、形成される線維量が多くなることがわかる。(c) 血清アルブミン量と形成されたアミロイド線維量との関係とアルブミン(図中の緑色の分子)が線維形成を防ぐ機構。


