概要等
タンパク質の機能解析や構造解析を行うにあたって大量のタンパク質の調製が必要となるが、真核生物由来のタンパク質を生理活性を保持した状態で調製するには大腸菌を用いた発現系では困難な場合が多い。そのような場合、昆虫細胞や哺乳細胞を用いた発現系が汎用されている。
バキュロウイルスを用いた外来遺伝子の昆虫細胞発現系では糖鎖などの翻訳後修飾を受けることができるため、高等生物由来の組換えタンパク質発現には大変有用である。バキュロウイルスには2つのタイプがあり、1つはSf9等の昆虫細胞にのみ感染するAcNPVで、もう1つはカイコのみに感染するBmNPVである。
本プロトコールでは、我々が開発したカイコバキュロウイルス(BmNPV)バクミドDNAと、大量生産の期待できるカイコ個体を組み合わせた発現システムを紹介する。
BmNPVバクミドシステムは大腸菌で作製したバクミドDNAをそのまま発現に使用することができ、カイコ個体に接種されたバクミドDNAはトランスフェクション試薬と混合することによって体内で細胞に直接取り込まれる。その後、細胞内で増幅、バキュロウイルスを産生し、それが個体内で感染する。細胞培養やウイルス作製、タイター測定のような煩雑な操作が不要であり、さらに省スペースで大量発現が見込まれる点で有用な発現系である。分泌タンパク質は幼虫体液、細胞質内タンパク質や膜タンパク質は幼虫脂肪体か蛹に発現させるとよい。発現系の構築から組換えタンパク質の抽出まで約2週間で完了する。
装置・器具・試薬
- pFastBac1などのBac-to-Bac用ベクター(Invitrogen)
- BmDH10Bacコンピテントセル(北大・前仲より譲受)*一般に良く用いられるsf9等のヨトウガの昆虫細胞でのAcNPVバキュロウイルス発現系構築で使用されるDH10Bacとは異なるので要注意
- LB培地(各社)
- LB寒天培地(各社)
- Kanamycin(各社)
- Gentamicin(各社)
- Tetracycline(各社)
- イソプロピル-β-チオガラクトピラノシド(IPTG)(各社)
- X-gal(各社)
- チオ硫酸ナトリウム(各社)
- EndoFree Plasmid Maxi KitまたはPlasmid Midi Kit(QIAGEN)
- インキュベーター(各社)
- 超遠心機(各社)(膜タンパク質発現の場合)
- ホモジナイザーまたは超音波破砕機(各社)(細胞質内または膜タンパク質発現の場合)
- カイコ幼虫(5齢)(日本農産工業、シスメックス)10頭4,000~6,000円、出荷日は要確認
- カイコ人工飼料(日本農産工業、シスメックス)
- カイコ蛹(シスメックス)10匹7,000円、出荷日は要確認
- DIMRIE-C(Invitrogen)
- PBS
- タッパー(図1)
- テルモシリンジ26G
- 解剖セット(図2:マット、まち針、はさみ、ピンセット)
実験の手順
第1~3日目
組換えBmNPVバクミドDNAの作製
第4~5日目
組換えBmNPVバクミドDNAの精製
第6日目
組換えBmNPVバクミドDNAのカイコ幼虫および蛹への導入
第7~11日目
カイコまたは蛹の飼育
第12~13日目
組換えタンパク質の抽出
実験の詳細
組換えBmNPVバクミドDNAの作製及び精製
- 目的遺伝子をpFastBac1に挿入する。
- 氷上で溶かしたBmDH10Bacコンピテントセル(100 μL、一般に良く用いられるAcNPVバキュロウイルス用のDH10Bacでないことに注意)に①のプラスミド(0.1~1 μg)を加える。
- 氷上で30分インキュベートする。
- 42℃で40秒ヒートショックを行い、氷上に2分静置した後、温めておいたLB培地(1.4 mL)を加え、37℃で1時間培養する。
- Tetracycline(fin. 10 μg/mL)を加え、37℃で一晩培養する。
- Gentamicin(fin. 7 μg/mL)を加え、37℃で2時間培養する。
- Kanamycin(fin. 50 μg/mL)、Gentamicin(fin. 7 μg/mL)、IPTG(fin. 200 μM)、X-gal(fin. 40 μg/mL)を含むLB寒天培地に原液および10倍、100倍希釈したものをまく。
- 白色コロニーについてdirect PCR(M13 Forward (-40): 5’-GTTTTCCCAGTCACGAC-3’, M13 Reverse : 5’-CAGGAAACAGCTATGAC-3’)によって目的遺伝子の有無を確認する。(目的遺伝子がバクミドに挿入されていれば、約2,300bp+目的遺伝子のサイズのバンドが得られる。)
- 目的遺伝子が挿入された組換えBmNPVバクミドを持つコロニーをkanamycin(fin. 50 μg/mL)、gentamicin(fin. 7 μg/mL)を含むLB培地に接種し、37℃で培養する。
- 増殖した大腸菌からEndoFree Plasmid Maxi KitやPlasmid Midi Kit(QIAGEN)等を用いて、組換えBmNPVバクミドDNAを精製する。
組換えBmNPVバクミドDNAのカイコ幼虫および蛹への導入
- 組換えBmNPVバクミドDNA(1 μg)とDMRIE-C(3 μL)を混ぜ、室温で45分静置する。
- 滅菌水(50 μL)を加えて混ぜ、5齢になったばかりのカイコ幼虫の腹部(尾部に近い方)に頭部へ向けて針(テルモシリンジ26G)を刺し接種する。蛹の場合は腹部に接種する。
- 組換えタンパク質を回収するまで、朝晩2回人工飼料を与え、飼育用タッパー(図1)に入れて25℃で飼育する。A5くらいの面積に~15匹程度。吐糸の時期(到着日から6~7日目)になると感染しなかった幼虫が逃げ出す可能性があるので、常にフタをする。フタかタッパーには空気穴を開けておくとよい。給餌の際に糞を取り除き、底に敷いたティッシュを交換してタッパー内を清潔に保つ。蛹の場合は繭から取り出してタッパーなどに並べておき、給餌は不要。
組換えタンパク質の抽出
接種後6~7日後、体色が黒くなることで感染成立を確認できる(図3)(感染が成立する確率はおおよそ9割以上)。幼虫の場合は体液(分泌発現)もしくは脂肪体(細胞内および膜タンパク質)を、蛹の場合は内容物を回収し、SDS-PAGEまたはウエスタンブロッティング等で目的タンパク質の発現を確認する。昆虫体液に特有のメラニン化を防止するため、バッファーにチオ硫酸ナトリウムを最終濃度が0.5%となるように添加する。
<幼虫体液の回収>
*カイコ幼虫1頭あたり約500μLの体液が回収できる。
①1.5 mLチューブに5%チオ硫酸ナトリウム(50 μL(体液の1/10量を目安))を入れておく。
②カイコ幼虫の足にシリンジの針を刺して穴をあけ、体液をチューブに受ける。(図4)
③10,000xg×10 min,4℃で遠心し、上清を回収し、目的のタンパク質を精製する。
<幼虫脂肪体の単離>
*カイコ幼虫を氷上に置いておくと動きが少なくなる。
①カイコ幼虫を縦に伸ばして、頭部と尾部にまち針を斜めに刺して固定する(図5)。
②ハサミで背の皮を切る。(腸を傷つけないように。)
③皮を開いて広げ、四隅をまち針で留める(図6)。
④消化管や絹糸腺をピンセットで取り除く、もしくは脇のほうによせる(図7)。
⑤PBSで洗浄する。
⑥皮の内側についている黄色や透明の管状の小さな器官を取り除く。
⑦皮の内側についている白いどろっとした形状の組織が脂肪体。ピンセットでこそげとり、0.5%チオ硫酸ナトリウムを含むPBSバッファーを入れたチューブに回収する(図8)。
<脂肪体からの細胞質画分および膜画分の精製>
①0.5%チオ硫酸ナトリウム含有PBSに懸濁した脂肪体を遠心して回収し、自分の実験に適したバッファーに置換する。プロテアーゼインヒビターを添加する。
②氷冷しながらダウンスホモジナイザーでしっかりホモジナイズする。安定な膜タンパク質の場合はソニケーションを用いて破砕してもよい。
③10,000xg×10 min,4℃で遠心し、上清を超遠心用のチューブに移す。
④100,000xg×60 min,4℃で遠心し、上清は細胞質画分とする。
⑤得られた沈殿をバッファーで懸濁し、再度100,000xg×60 min,4℃で遠心する。
⑥得られた沈殿をバッファーで懸濁し、膜画分(ミクロソーム画分)とする。
⑦目的のタンパク質を精製する。
<蛹からの回収>
①接種後6~7日で感染し黒っぽくなった蛹をハサミで半分にし、0.5%チオ硫酸ナトリウムおよびプロテアーゼインヒビターを含む緩衝液に入れる。
②ポッター型ホモジナイザーに移し、内容物を押しつぶすように4,000 rpmほどの回転数でホモジナイズする。
③ナイロンメッシュなどで殻を除き、ダウンス型ホモジナイザーに移して必要なだけホモジナイズする。
④目的のタンパク質を精製する。
工夫とコツ
- 湿度を保つため、幼虫を入れたタッパーの近くに、水を入れた容器を置いておく。
- 感染した幼虫や蛹の体色は黒っぽくなる。感染していない幼虫はバクミド接種後7日目頃から糸を吐き始め、繭を作り始める。
- 精製したバクミドは凍結融解による損傷を避けるため、4℃で保存する。
- 体液に分泌発現させたい場合はN末端にシグナペプチドを付加する。ほ乳類のシグナルペプチドはそのまま使用できる場合がほとんどである。
- カイコ体液中にはヒスチジンが多く含まれているので、精製する前にバッファーで10倍希釈するか、透析を行った方が良い。
- 二度目以降は体液または体液から超遠心で回収したウイルスを用いて感染させることも可能であるが、幼虫に原液のまま感染させると数日で死亡することが多いので、希釈系列のタイターチェックが必要となる。蛹の場合は1 μLほどの感染体液をインジェクトすると概ねうまく感染する。
- 免疫細胞表面受容体の細胞外ドメインをカイコ幼虫で発現させた場合、体液中に発現し、1頭の体液から約0.2 mgの精製組換えタンパク質が得られた。
- カイコで発現させた組換えタンパク質に修飾される糖鎖は昆虫細胞特有の比較的小さな糖鎖が修飾される傾向がある。発現の良い蛋白質で比較的均一な糖鎖修飾が見られることがあり、結晶構造解析にも適している可能性が十分にある。
- 幼虫を使用する際のメリットとしては体液中に発現する場合、大量にしかも簡便に回収することができる。デメリットは、感染成立するまでの間、毎日朝晩の飼育をしなければならないことである。他方、蛹を使用する際のメリットは冷蔵庫で保存でき、すぐにバクミド接種などができ、また接種後、飼育の必要がないことである。
- 組換えBmNPVバクミドDNAの作製において、従来通り、熱ショック後37℃で2時間培養し、抗生物質を含むLB寒天培地にまくことも可能である。しかし、本プロトコールに比べ、若干白色コロニーの出現率が低くなると思われる。
文献
- Motohashi, T. et al., Biochem. Biophys. Res. Commun., 326, 564–9 (2005)
- Kajikawa, M. et al., Biochem. Biophys. Res. Commun., 385, 375–9 (2009)
- Sasaki, K. et al., Biochem. Biophys. Res. Commun., 387, 575–80 (2009)
-

図1:飼育用タッパー
フタに穴をあけ、網を貼ったものを使用。底にはティッシュを敷いておく。 -

図2:解剖セット
マット、まち針、はさみ、ビンセット -

図3:感染後のカイコ幼虫(左)と蛹(右)
ウイルスが感染すると体色が黒くなる -
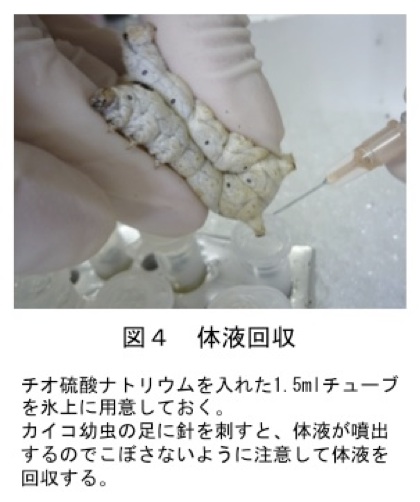
図4:体液回収
チオ硫酸ナトリウムを入れた1.5 mlチューブを氷上に用意しておく。
カイコ幼虫の足に針を刺すと、体液が噴出するのでこぼさないように注意して体液を回収する。 -

図5:脂肪体単離①
カイコ幼虫を伸ばして、両端を針で固定する -
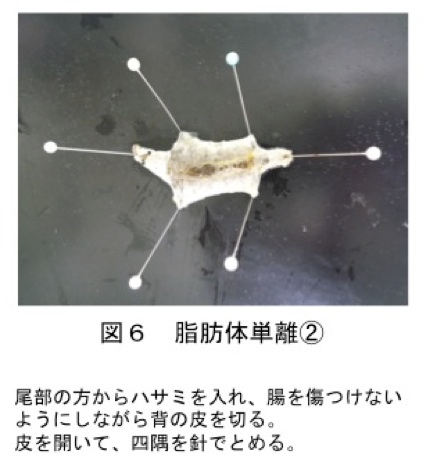
図6:脂肪体単離②
尾部の方からハサミを入れ、腸を傷つけないようにしながら背の皮を切る。
皮を開いて、四隅を身でとめる。 -
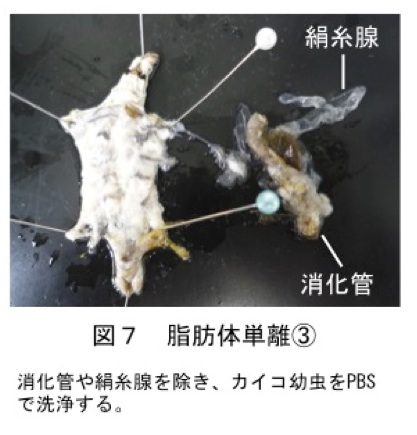
図7:脂肪体単離③
消化管や絹糸腺を除き、カイコ虫をPBSで洗浄する。 -

図8:脂肪体単離④
皮の内側についている脂肪体(白いどろっとした組織)をピンセットでかきとり、0.5%チオ硫酸ナトリウムを含むPBSバッファーを入れたチューブに回収する。


