概要
ここでは、7本の膜貫通αヘリックスを持ち、その内部に発色団・レチナール(ビタミンAアルデヒド)を結合するレチナール蛋白質にフォーカスし、私たちが培ってきた発現および可溶化法のノウハウや工夫・コツについて述べる。なお本稿は、2008年および2014年の本アーカイブスの記事 #009「膜蛋白質の抽出(可溶化)」および #079「膜蛋白質の抽出(可溶化)(2)」の増補・改訂版であり、前稿発表後に新たに得た知見を中心に加筆している。そのため、本稿に記載していない実験プロトコールの詳細や関連事項については、それらを参照していただきたい。また、これまでの記事で扱ってきた微生物由来のレチナール蛋白質に加えて、本稿では新たに動物由来のレチナール蛋白質についての記載を追加した。
蛋白質科学に関わる多くの研究者や、これから蛋白質科学研究へと参入したいと考えている研究者(特に膜蛋白質や光受容蛋白質に興味をお持ちの方)にとって、本稿で記載する情報が有益なものとなることを願っている。
目的・イントロダクション
膜蛋白質は、細胞や細胞小器官の生体膜に存在する蛋白質群であり、全蛋白質の25–30%を占めている。これら分子は、生体膜を介した物質輸送や情報伝達を担うことで、多様な生命活動(例:神経活動、エネルギー産生、感覚受容、免疫応答)を司る。膜蛋白質の機能異常や欠損は病気や疾患の原因となるため、現在市販されているうちの50%以上の薬が膜蛋白質をターゲットとしており、医学・薬学を含む広範な生命科学分野において、膜蛋白質は重要な分子群として位置づけられている (3)。膜蛋白質の作動原理を理解する上では、その物理化学的特性を明らかにすることが重要であるものの、可溶性蛋白質と比べて技術的に困難であるというのが一般的な理解である。これは、膜蛋白質の天然存在量の少なさ、取り扱いの難しさ、さらには膜蛋白質解析における特有の操作である『可溶化』の存在に起因する。
私たちは、7回膜貫通型レチナール蛋白質の発現、可溶化・精製、および機能・構造解析に取りくんでいる (4,5)。レチナール蛋白質は、ビタミンAの誘導体であるレチナールを膜貫通部に結合する蛋白質群であり、橙色から紫色といった様々な色を呈する(図1A)。一般的な蛋白質とは異なり、レチナール蛋白質は、①色を呈し、変性すると黄色に変化する特徴(図1B)、②光によって蛋白質機能・活性を容易にオン/オフできる特徴から、機能・活性の確認のみならず発現や可溶化の条件検討にも適した膜蛋白質であると考えている。本稿では、著者らが行ってきたレチナール蛋白質研究のノウハウについて、原著論文には記載していないコツや、普段より感じてきた経験や感覚も含めて記述したい。
装置・器具・試薬
- 遠心機(各社)
- 超遠心機(各社)
- ホモジェナイザー
- 全トランス型レチナール(Sigma-Aldrich,Merck)
- イソプロピル-β-D-ガラクトピラノシド(IPTG)(富士フイルム和光純薬)
- DMEM/F12-Dulbecco’s Modified Eagle Medium(Gibco,Thermo-Fisher)
- n-dodecyl-β-D-maltoside(DOJINDO)
- SMA2000(Cray Valley)
実験手順
- 膜蛋白質の発現
- 細胞の破砕と膜画分の調製
- 膜蛋白質の可溶化と機能(活性)確認
実験の詳細
1. 膜蛋白質の発現
1800年代後半にカエルの眼球より発見されたロドプシンからレチナール蛋白質の研究は始まった (6)。様々な後生動物よりレチナール蛋白質(動物型ロドプシンあるいはオプシン類と呼ばれる)は見いだされており、ヒトも9種類の分子をもつことが知られている。動物型ロドプシンは、Gタンパク質共役型受容体(GPCR)あるいは光異性化酵素として働き、視覚や概日リズムの調節などを担う (6,7)。数多くの動物型ロドプシン分子の中でも、ウシロドプシンは最もよく研究が進んでいる分子であり、GPCRの中で最初に三次元の結晶構造が解かれたことをはじめ、多様な時空間領域での構造ー機能相関が解明されている (8,9)。そのため、GPCR 研究を牽引してきた分子としても知られている。動物型ロドプシンの多くは、暗状態で11シス型レチナールを発色団として持ち、光を吸収することでレチナールのシス–トランスの異性化が引き起こされる (6)。
一方で、1971年に高度好塩性古細菌より、色素蛋白質が見いだされた。この分子は、上述の動物型ロドプシン同様に、可視部に吸収を持ち、同じくレチナールを発色団とすることから、バクテリオロドプシン(BR)と名付けられた (10)。BR は、光駆動のプロトンポンプとして機能し、同一の古細菌からはハロロドプシン(HR)、センサリーロドプシンⅠ(SRI)、センサリーロドプシンⅡ(SRII、フォボロドプシン:pRとも呼ばれる)が見いだされた (11)。最近ではゲノム科学の進展により、様々な微生物(古細菌・細菌・真核微生物など)から、万を超える種類の微生物型レチナール蛋白質(微生物型ロドプシンと呼ばれる)が見いだされており、それらの分子機能の多様性が注目を浴びている。動物型と異なり、微生物型の多くは全トランス型レチナールを発色団として持ち、光を吸収することで13シス型への異性化が起こる (4,5)。これら微生物型レチナール蛋白質は、膜蛋白質あるいは光受容蛋白質のモデルとして長年研究が行われ、その分子理解が大きく進んでいる。
このような基礎的研究に加え、動物型および微生物型レチナール蛋白質は光遺伝学のツール分子としても注目されている (12,13)。光遺伝学とは、特定の細胞に、遺伝学的手法を用いて光感受性蛋白質(例:レチナール蛋白質)を発現させ、光によって生物個体や細胞の機能・応答を操作する技術のことを言う。例えば、神経細胞に光開閉型のカチオンチャネルを発現させることで、細胞の脱分極応答、すなわち神経興奮を光で制御することができるため、神経科学を中心とした生命科学分野で、その応用研究が進められている (12,13)。本稿では、2008年および2014年の本アーカイブスの記事#009「膜蛋白質の抽出(可溶化)」、#079「膜蛋白質の抽出(可溶化)(2)」で扱った微生物由来のレチナール蛋白質(微生物型ロドプシン)に加え、動物由来のレチナール蛋白質(動物型ロドプシン)についても記述する。
(A)微生物型ロドプシン
微生物由来のレチナール蛋白質の発現は、古細菌の一種であるHalobacterium salinarumや、大腸菌、酵母、動物細胞、無細胞蛋白質合成系などを用いて試みられている (2)。当初は、古細菌を中心に蛋白質発現系の構築が試みられたが (14,15)、1997年に高度好塩好アルカリ性古細菌であるNatronomonas pharaonis由来のSRII(NpSRII)を、大腸菌膜に機能的に発現させることが可能となって以来 (16)、遺伝子操作が容易であり、時間および価格的観点から低コストで大量培養が可能な大腸菌を用いた発現系が第一選択肢として用いられている (17–22)。大腸菌発現系を用いた詳細な発現方法は、前稿や他の解説・総説などをご参照頂きたい (1,2,23–25)。大腸菌を用いた発現方法について簡単に述べると、発現ベクターに応じた試薬(例:IPTG、アラビノース)の添加による発現誘導を行い、その際に発色団・レチナールを添加する。経験的に、発現誘導後、低温(18℃)で長時間(8時間程度)培養すると、正常に折りたたまれた機能性蛋白質が得られる割合が高くなることがある。この方法により、レチナール蛋白質の中でも発現量の低い分子(アニオンチャネルロドプシン-2)の発現に成功している (26–28)。ぜひ発現や着色が少ないレチナール蛋白質では、この方法を試していただきたい。
ここでは、前稿である#009「膜蛋白質の抽出(可溶化)」と#079「膜蛋白質の抽出(可溶化)(2)」からの加筆として、哺乳類培養細胞・HEK293 を用いた発現法について述べる(図2)。この方法は、後述の動物由来のレチナール蛋白質における発現に主に用いられており (29–36)、大腸菌では発現が困難な分子を含めて様々な微生物由来のレチナール蛋白質にも適用可能である (27,37)。まず、蛋白質遺伝子(例:アニオンチャネルロドプシン-1・2)を哺乳類細胞発現用ベクター(例:pCAGGS)のマルチクローニングサイトへと挿入する。その際、蛋白質の精製用に6×His-tagをC末端に付加するとよい。HEK293細胞はDMEM/F12-Dulbecco’s Modified Eagle Medium(Gibco,Thermo-Fisher)を用いて培養を行い、細胞数が2–3割になったときにリン酸カルシウム法を用いて遺伝子を導入する。遺伝子は、10 cmのculture dish 1枚あたり15 µg加えている。なお、リン酸カルシウム法による遺伝子導入効率と蛋白質の発現効率を最適化するため、私たちは、粉末培地を用いて液体培地を作成し、培地のpHの値を正確に7.25に合わせている。形質転換から6–8時間後を目途に、古い培地を吸い取り新しい培地へと交換する。そして、形質転換から24時間後を目途に、レチナールを終濃度が5 µMとなるように細胞へと加える。レチナールはエタノールに溶かしたもの(10 mMのストック溶液)を用いているが、ストック溶液をそのまま細胞に加えると、エタノールによって滴下した付近の細胞が死んでしまう。そのため、私たちは、ストック溶液を新しい培地に加え、100倍程度希釈したものを細胞に滴下するようにしている。その後、アルミホイルでculture dishを覆うようにして遮光した状態で培養した後、形質転換から48時間後を目途に細胞を回収する。目的のレチナール蛋白質を上手く発現していれば、回収した細胞膜のペレットが色づいているのが確認できる(図2)。
(B)動物型ロドプシン
動物由来のレチナール蛋白質は、古くより動物の眼から生化学的に精製した試料を用いた解析が進められてきた。その中で、1987年にKhorana博士らのグループが、アフリカミドリザル腎由来のCOS-1細胞でウシロドプシンの組換えタンパク質の発現と精製に成功した (38)。それ以来、COS-1細胞やHEK293細胞といった哺乳類培養細胞が発現宿主として利用されている。なお、大腸菌で動物型ロドプシンのホロタンパク質の発現に成功したという報告はこれまでにない。
ここでは、私たちのグループでも利用しているHEK293細胞を用いた発現法を述べる(図3)。蛋白質遺伝子(例:ウシロドプシン、ニワトリ緑色感受性錐体視物質)を哺乳類細胞発現用ベクター(例:pCDNA3.1、pCAGGS)のマルチクローニングサイトへと挿入する。その際、蛋白質の精製用にRho1D4タグをC末端に付加するとよい (38,39)。Rho1D4タグとは、ウシロドプシンのC末端配列(ETSQVAPA)であり、その配列をエピトープ配列としたRho1D4抗体が作成されている。なお、多くの脊椎動物ロドプシンはもともとその配列をC末端に持つため、タグの付加は不要である。HEK293細胞の培養とトランスフェクションは、微生物型ロドプシンの章で述べた方法(図2)と同様である。形質転換から6–8時間後を目途に、古い培地を吸い取り新しい培地へと交換する。その後、形質転換から48時間後を目途に、細胞を回収する。回収した後、適当なBuffer(例:50 mM HEPES-NaOH(pH 7.0),140 mM NaCl)で細胞膜を懸濁し、発色団である11シス型レチナールを終濃度が250–500 µMとなるように添加する(図3A)。なお、国内では高純度の11シス型レチナールを購入することは困難であるため、私たちは、一般的な卓上の白色蛍光灯(光強度はおよそ500ルクス)を用いて市販の全トランス型レチナールに12時間程度光をあて、一定程度できる11シス型レチナールを高速液体クロマトグラフィー(HPLC)によって分離することで得ている (40)。ここで、多くの動物型ロドプシンは光反応が一方向性であるため、一度光を浴びてしまうと、暗状態へと戻すことができない(光退色と呼ばれる)。そのため、ロドプシンの光退色とレチナールの光異性化を防ぐため、発色団の添加作業以降は、すべて暗室(赤色光下)で行う必要がある(図3B)。レチナールを添加した細胞膜懸濁液は、遠心管(例:エッペンチューブやコニカルチューブ)に移し、アルミホイルで遮光する。そして、小型旋回ミキサーに貼り付け、4℃で6時間以上旋回させ、11シス型レチナールを結合した色素を再構成させる。これにより、可視部または紫外部に吸収を持ったホロタンパク質を得ることができる(図3C)。
2. 細胞の破砕と膜画分の調製
大腸菌発現系を用いた詳細な手順と方法は前稿や他の解説・総説などをご参照頂きたい (1,2,23–25)。大腸菌を用いた細胞の破砕と膜画分の調製方法について簡単に述べると、回収した菌体を適当なBuffer(例:50 mM Tris-HCl(pH 8.0), 1 M NaCl)で懸濁した後、氷上で超音波によって破砕する(例:TOMMY SEIKO社製ULTRASONIC DISRUPTOR(UD-211)を用いて、Duty:50,Output control:7,Time:30分の条件で破砕処理)。なお、蛋白質の変性を防ぐため、溶液は必ず氷上で冷やしながら行う。破砕した溶液を遠心管に移し、低速で遠心処理(例:5,000×g,10分,4℃)し、未破砕の菌体や核を沈殿させ、上清を回収する。次に、上清を遠心処理(例:103,900×g,1時間,4℃)し、膜画分を沈殿として得る。
ここでは、前項の続きとして、レチナール蛋白質を発現させたHEK293細胞の破砕法について述べる。大腸菌の場合と同様に、可能な限り低温で細胞の破砕を行う。具体的には、回収した細胞膜を適当なBuffer(例:50 mM HEPES-NaOH(pH 7.0),140 mM NaCl)で懸濁した後、氷上で超音波によって破砕する。なお、蛋白質の変性を防ぐため、溶液は必ず氷上で冷やしながら行う。ピペットで懸濁液を容易にサスペンジョンできる程度まで破砕できれば十分である。なお、経験的に、プロテアーゼインヒビターの添加は、長期保存の場合においてもほとんど安定化に寄与しない。破砕した細胞は、次項で述べるように界面活性剤を用いた可溶化のプロセスに進む。動物型ロドプシンを扱う場合は、先述したとおり、赤色光下で作業を行う。
3. 膜蛋白質の可溶化と機能(活性)確認
ここでは、微生物型ロドプシンにおける大腸菌発現蛋白質のSMAを用いた可溶化法(A)、HEK293細胞発現蛋白質の界面活性剤(DDM)を用いた可溶化法(B)、および動物型ロドプシンの可溶化法(C)の3点と、機能(活性)確認法について述べる。DDMを始めとした界面活性剤による微生物型ロドプシンの可溶化法については、前稿や他の解説・総説などをご参照頂きたい (1,2,23–25)。
(A)大腸菌発現蛋白質の SMA を用いた可溶化法
私たちは、様々な微生物型ロドプシンの発現・可溶化・精製・機能解析を行ってきた。その中で、可溶化には親水基に糖鎖を持つ非イオン性の界面活性剤、DDM(n-dodecyl-β-D-maltoside)を最も良く用いている (17,18,20–22,37)。それは、他の界面活性剤中と比べて、DDMで可溶化した場合の方が蛋白質自体が安定な場合が多いからである。しかしながら、膜蛋白質は一般的に、脂質二重膜から引き剥がすと不安定になるため、DDM中では可溶化の際に変性してしまい、レチナールが結合した機能性分子(ホロ蛋白質)を取得できない場合があるのも事実である。そこで私たちが着目したのは、スチレンマレイン酸(Styrene-Maleic Acid:SMA)である(図4)(41)。両親媒性分子であるSMAは、脂質膜と相互作用し、直径が10–50 nm程度の円盤状の二重膜(SMALPと呼ばれる)を自発的に形成する (41,42)。そのため、界面活性剤を用いずに、脂質二重膜に埋め込まれた状態で膜蛋白質を可溶化することができる。このことから、界面活性剤中では変性してしまう不安定な蛋白質も可溶化できる新たなツールになると期待されている。私たちは、DDM中では可溶化の際に変性してしまう不安定性分子であるH. salinarum由来のSRIへとSMAを適用したところ、変性させることなく可溶化およびアフィニティ精製することに成功している (43)。そこで、SMAを用いた可溶化法について具体的に述べたい(図4)。
膜画分をBuffer(50 mM Tris-HCl(pH 8.0),10(v/v)%グリセロール)で懸濁し、ホモジェナイザーでホモジェナイズした後、SMA(終濃度5.0(w/v)%)を加えて室温で120分間攪拌し、膜画分を可溶化する。他の文献では (42,44)、終濃度が2.5(w/v)%となるようにSMAを加えて可溶化を行っているケースが見受けられる。Rubrobacter xylanophilus由来のレチナール蛋白質分子(RxR)を発現させた大腸菌膜を対象に、私たちは定量比較を行ったところ、終濃度が2.5(w/v)%となるようにSMAを添加した場合と比較して、5.0(w/v)%のSMAを添加した場合では、可溶化されたRxR分子がおよそ2.5倍多いことを見出している (43)。そのため、私たちは終濃度が5.0(w/v)%となるようにSMAを添加することを推奨する。なお、変性が心配される分子の場合は、4℃で120分間攪拌し、膜画分を可溶化している。そして、この溶液を遠心処理(例:103,900×g,30分,4℃)し、不溶性の膜画分を除去する。可溶性画分が含まれる上清は、アフィニティカラムやゲル濾過カラムなどを用いることで、目的の蛋白質のみを単離することができる。
なお、SMAを用いるもう一つのメリットとしては、一般的な界面活性剤と比較して価格がはるかに安いことがあげられる。SMAは、スチレンと無水マレイン酸から化学合成されたスチレン無水マレイン酸の加水分解によって得られる。スチレン無水マレイン酸は商業的に汎用されている(例:プラスチック製品の加工)ため、1 kgで数千円程度と、一般的な界面活性剤(例:DDMは1 gで1万円程度)と比較して破格の安さである。私たちもCray Valley社製のSMA2000(同等品としてはPolyscope社製のXIRAN2000Pが挙げられる)を購入し、既報 (45) に従って加水分解を行うことでSMAを取得している。
(B)HEK293細胞発現蛋白質の界面活性剤(DDM)を用いた可溶化法
破砕した膜画分を適当なBuffer(例:50 mM HEPES-NaOH(pH 7.0),140 mM NaCl)で懸濁し、終濃度が1(w/v)%となるようにDDMを加える。懸濁液の液量の目安としては、10 cmのculture dish 5枚から回収した細胞膜に対して、500 µL~1 mLとなるように調製している。懸濁液は遠心管(例:エッペンチューブやコニカルチューブ)に移し、小型旋回ミキサーに貼り付け、泡立たないような速度で4℃で旋回させることで可溶化を行う。なお、30分間–1時間程度可溶化すれば十分である。可溶化後の溶液を遠心処理(例:103,900×g,30分,4℃)し、不溶性の膜画分を除去する。可溶性画分が含まれる上清は、アフィニティカラムやゲル濾過カラムなどを用いることで、目的の蛋白質のみを単離することができる (27,37)。
(C)動物型ロドプシンの可溶化法
(B)で述べたものと同様の方法で、HEK293細胞から動物型ロドプシンの可溶化を行う (29–31,34,35)。なお、この作業もすべて暗室(赤色光下)で行う。DDM中では変性してしまう蛋白質の場合、ジギトニンや3-[(3-cholamidopropyl)dimethylammonio]-propanesulfonate(CHAPS)が用いられる。ジギトニンの場合は終濃度1(w/v)%で可溶化し、CHAPSの場合は終濃度0.75(w/v)%の溶液に1 mg/mLのL-α-phosphatidylcholine:PC)を加えた混合液中で可溶化することが多い (32,36)。可溶化後の溶液を遠心処理(例:103,900×g,30分,4℃)し、不溶性の膜画分を除去する。可溶性画分が含まれる上清は、Rho1D4抗体を結合させたアガロースゲルを用いてアフィニティ精製を行い、目的の蛋白質のみを単離することができる (29–36)。
本稿で対象としたレチナール蛋白質は、それぞれの分子種に応じた色を呈し、蛋白質が変性し機能(活性)が失われた場合、色が黄色へと変化する(図1B)。そのため、可溶化および精製した試料の色を確認することで、機能性分子として保持されているのかを確かめることができる。また、動物型ロドプシンの場合は室内光で光退色してしまうため、試料の色を目視で確認するのは困難なことも多い。そのため、紫外可視分光高度計を用いて、可溶化および精製した試料の吸収スペクトルを測定し、ロドプシンに由来する吸収を確認する。光照射に伴う吸収スペクトルの変化を確認することで、可溶化試料に機能性蛋白質が含まれているのかを確認できる(図3C)。さらに、レチナール蛋白質の光照射に伴う構造変化・機能発現を、時間分解紫外可視分光測定、FTIR(Fourier transform infrared spectroscopy)測定などによって確認することもできる (1,2,25,32,33)。
工夫とコツ
ここでは、前稿や他の解説・総説 (1,2,23–25) では述べていない点を中心に記す。
SMAを用いた可溶化
SMAは酸性条件下や高塩濃度下では凝集してしまう性質を持つ。そのため、BufferのpHは7.4以上に保つように注意し、低塩濃度下(NaClの場合150 mM以下)での可溶化・調製を徹底していた。また、凝集を抑えるために、場合によっては10(v/v)%グリセロールをBufferに加えて実験を行っている。
HEK293細胞のDDMを用いた可溶化
HEK293細胞は、DDM添加後30分から1時間程度可溶化を行っている。これは1時間以上可溶化を行っても、レチナール蛋白質の可溶化効率がほとんど変わらないこと、また、長時間可溶化することで夾雑蛋白質が可溶化される割合が増えてしまい、精製の際に純度を低下させてしまうことを経験的に知っているからである。そのため、1時間以内の可溶化が好ましいと考えられる。
動物型ロドプシンを対象とした暗室実験
多くの動物型ロドプシンは光退色する性質を持つため、試料に光を当てないことが重要である。しかし、光がないと、私たち実験者も周囲が見えないため実験ができない。そのため、赤色光のみが存在する暗室(写真の現像を行うための暗室をイメージしていただけるとよい)で実験を行うことが一般的である(図3B)。赤色光は、660 nm以下の波長の光を除いた長波長光であることが多い。私たちは、700–720 nmにピークを持つような赤色LEDを利用して暗室を照らしている。なお、赤色光を吸収するロドプシンの場合(例:ヒト赤色感受性錐体視物質)では、LEDなどの赤色光でも光退色してしまう。その場合、赤外線ゴーグル(暗視ゴーグル)と呼ばれる特殊な装置を用いて実験を行う。
実験の安全
レチナールは、溶液中において光で分解もしくは異性化するため、発現誘導中は暗状態で培養する。また、人体に毒性があるため、取り扱いの際は手袋を用いる。
文献
- 須藤雄気, 蛋白質科学会アーカイブ, 1, e009 (2008)
- 須藤雄気ら, 蛋白質科学会アーカイブ, 7, e079 (2014)
- Santos, R. et al., Nat. Rev. Drug Discov., 16, 19–34 (2017)
- 須藤雄気ら, 生物物理, 60, 209–214 (2020)
- Kojima, K. et al., Biochemistry, 59, 218–229 (2020)
- Shichida, Y. et al., Philos. Trans. R Soc. Lond. B Biol. Sci., 364, 2881–2895 (2009)
- 今元泰, 生物物理, 55, 299–304 (2015)
- Palczewski, K. et al., Science, 289, 739–745 (2000)
- 森住威文, 生物物理, 53, 34–36 (2013)
- Oesterhelt, D. et al., Nat. New. Biol., 233, 149–152 (1971)
- Kurihara, M. et al., Biophys. Physicobiol., 12, 121–129 (2015)
- 山中章弘, ファルマシア, 50, 968–972 (2014)
- Zhang, F. et al., Cell, 147, 1446–1457 (2011)
- Sudo, Y. et al., Biophys. J., 80, 916–922 (2001)
- Sudo, Y. et al., Proc. Natl. Acad. Sci. USA, 103, 16129–16134 (2006)
- Shimono, K. et al., FEBS lett., 420, 54–56 (1997)
- Sudo, Y. et al., J. Biol. Chem., 286, 5967–5976 (2011)
- Sudo, Y. et al., J. Biol. Chem., 288, 20624–20632 (2013)
- Irieda, H. et al., J. Biol. Chem., 287, 32485–32493 (2012)
- Tsukamoto, T. et al., J. Biol. Chem., 288, 21581–21592 (2013)
- Inoue, S. et al., Phys. Chem. Chem. Phys., 20, 3172–3183 (2018)
- Kojima, K. et al., Sci. Rep., 10, 20857 (2020)
- 須藤雄気, 実験医学, 23, 1933–1937 (2005)
- 須藤雄気, 遺伝子医学 MOCK 別冊「図・写真で観るタンパク質構造・機能解析実験実践ガイド」, 41–46 (2005)
- 須藤雄気ら, 薬学雑誌, 132, 407–416 (2012)
- Doi, S. et al., Sci. Rep., 7, 41879 (2017)
- Kojima, K. et al., J. Phys. Chem. Lett., 11, 6214–6218 (2020)
- Kojima, K. et al., Biophys. Physicobiol., 15, 179–188 (2018)
- Terakita, A. et al., Nat. Struct. Mol. Biol., 11, 284–289 (2004)
- Tsukamoto, H. et al., Proc. Natl. Acad. Sci. USA, 102, 6303–6308 (2005)
- Yamashita, T. et al., Proc. Natl. Acad. Sci. USA, 107, 22084–22089 (2010)
- Sato, K. et al., Biochemistry, 51, 4300–4308 (2012)
- Kojima, K. et al., J. Biol. Chem., 289, 5061–5073 (2014)
- Kojima, K. et al., Proc. Natl. Acad. Sci. USA, 114, 5437–5442 (2017)
- Kojima, K. et al., Proc. Natl. Acad. Sci. USA, 114, 6028–6033 (2017)
- Yamashita, T. et al., J. Biol. Chem., 289, 3991–4000 (2014)
- Kikuchi, M. et al., Sci. Rep., 11, 14765 (2021)
- Oprian, D. D. et al., Proc. Natl. Acad. Sci. USA, 84, 8874–8878 (1987)
- Molday, R. S. et al., Biochemistry, 22, 653–660 (1983)
- Tsukida, K. et al., J. Nutr. Sci. Vitaminol. (Tokyo), 24, 593–596 (1978)
- Dorr, J. M. et al., Eur. Biophys. J., 45, 3–21 (2016)
- Knowles, T. J. et al., J. Am. Chem., Soc., 131, 7484–7485 (2009)
- Ueta, T. et al., Biophys. J., 119, 1760–1770 (2020)
- Gulati, S. et al., Biochem. J., 461, 269–278 (2014)
- Lee, S. C. et al., Nat. Protoc., 11, 1149–1162 (2016)
-

図1:レチナール蛋白質
(A)レチナール蛋白質の精製試料の写真。分子種によって様々な色を呈する。(B)レチナール蛋白質の変性過程における色の変化。変性や光反応の結果としてレチナールが蛋白質から遊離すると着色(図の場合は赤色)が失われ、黄色(レチナール自身の色)へと変化する。ここでの色味の違いは、蛋白質内部でのレチナールと遊離のレチナールで分子吸光係数が数倍程度異なることに由来する。 -
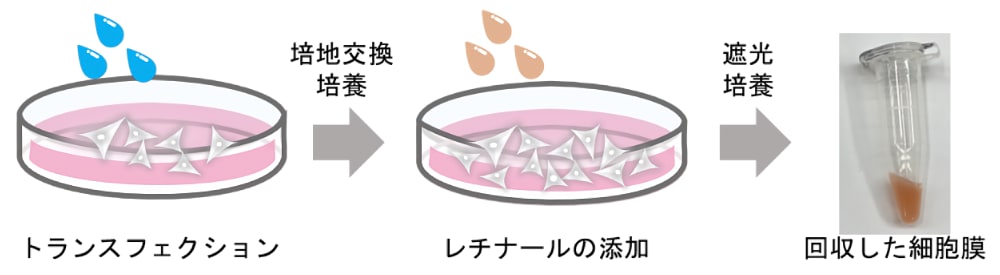
図2:HEK293 細胞を用いた微生物型ロドプシンの発現
目的のレチナール蛋白質が上手く発現できていれば、回収した細胞膜に着色(図の場合はアニオンチャネルロドプシン-1に由来する赤色)が見られる。なお、レチナールを添加した後の culture dish はアルミホイルで遮光し培養する。 -
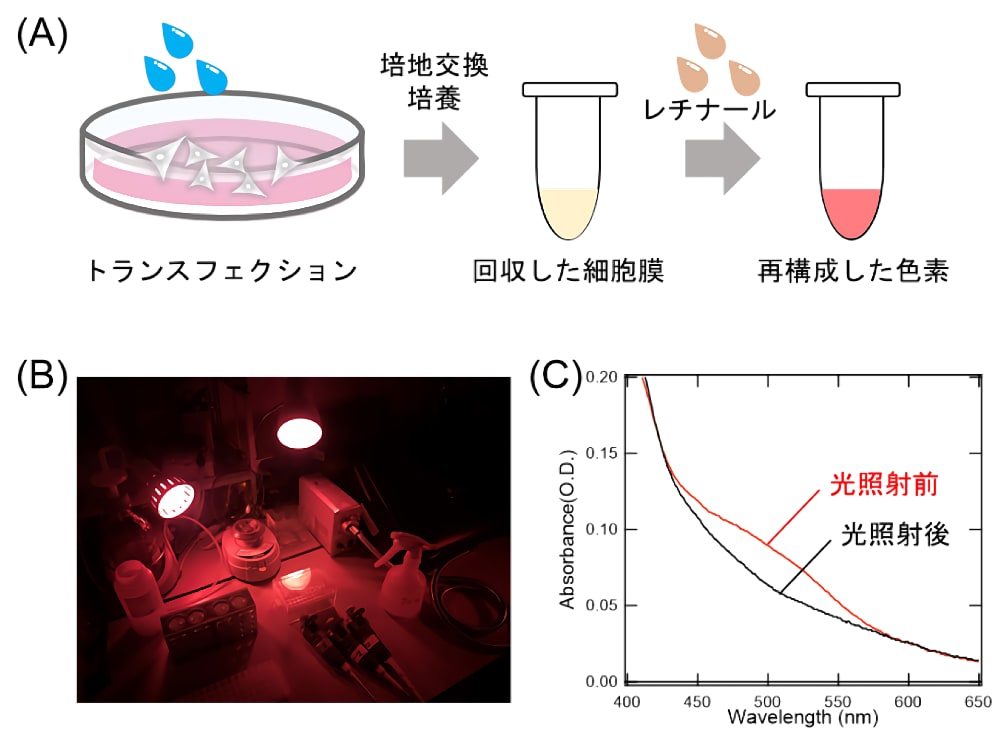
図3:HEK293 細胞を用いた動物型ロドプシンの発現と可溶化徴
(A)HEK293 細胞を用いた動物型ロドプシンの発現。(B)暗室実験の写真。赤色光下で実験を行うことでロドプシンの光退色とレチナールの光異性化を防ぐことができる。(C)ウシロドプシンを発現させた HEK293 細胞の可溶化試料の吸収スペクトル。暗室で調整した可溶化試料(光照射前)に黄色光(>480 nm)を照射すると、ウシロドプシンが光退色する。それにより、光照射後の吸収スペクトルでは、500 nm 付近の吸光度が減少していることが確認できる。 -
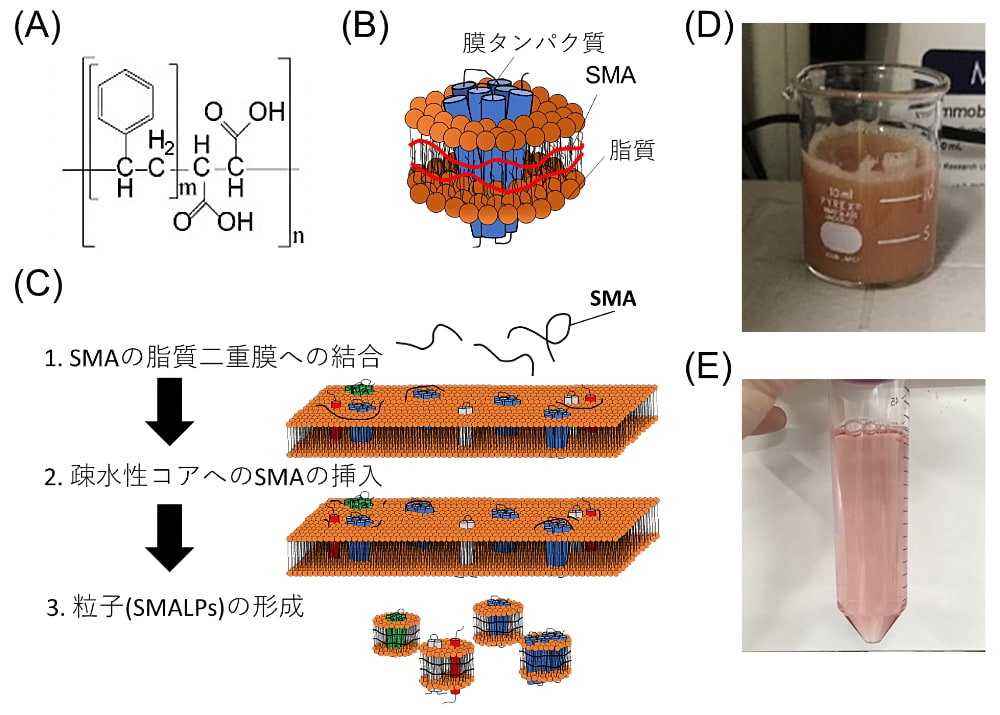
図4:SMAを用いた膜蛋白質の可溶化
(A)SMA の化学構造。m はマレイン酸に対するスチレンの存在比、n は SMA の重合度を表し、一般的に m=2,3、n=10 程度のものが用いられている。(B)SMALPs の模式図。SMA が脂質二重膜を取り囲むことで SMALPs を形成し、中に目的の膜蛋白質を埋め込むことができる。(C)SMALPs 形成プロセスの模式図。(D)SMA を用いた膜画分の可溶化処理の写真。ビーカーの中で、攪拌子を用いて泡立たないように注意しながら可溶化する。(E)可溶化処理後の試料を遠心した後の可溶性画分の写真。レチナール蛋白質(RxR)に由来する赤色を呈していることが確認できる。


