概要
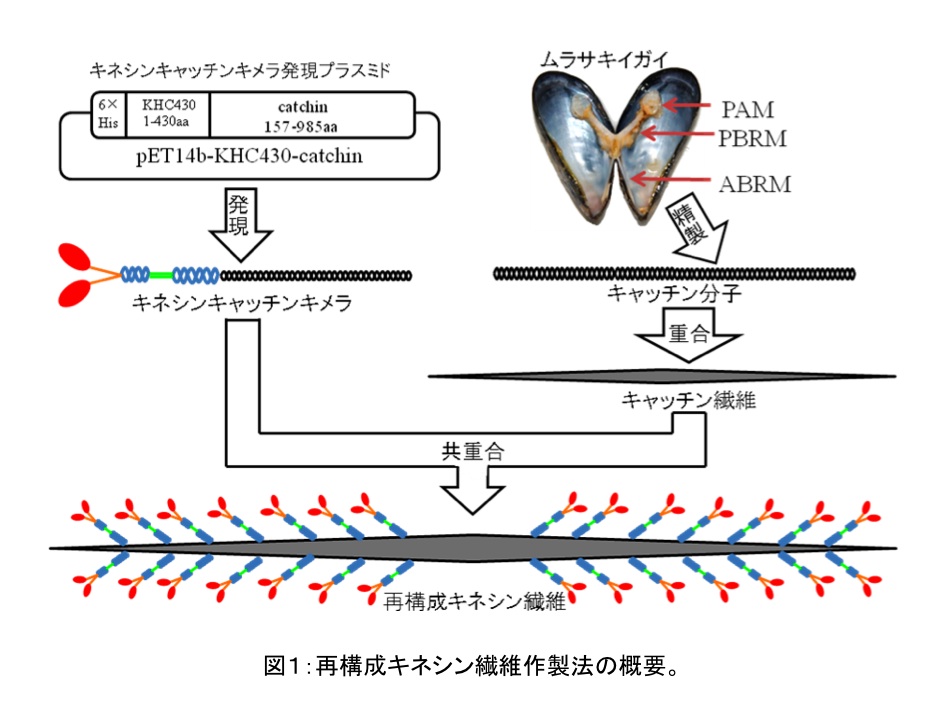
キネシン分子モーターの繊維状集合体である再構成キネシン繊維を作製する方法について述べる(1)。
この手法では最初に、ムラサキイガイの筋肉においてミオシンを含む太い繊維に含まれるキャッチン(2)(ミオシン尾部と相同な配列を持つ)を低塩濃度条件で会合させ、キャッチン繊維を作製する。その後に、大腸菌で発現させたキネシン頭部とキャッチンのキメラタンパクを加えて、キャッチン繊維上にキメラタンパクを付着させることによって再構成キネシン繊維を作製する(図1)。
この再構成キネシン繊維上では、筋肉の太い繊維におけるミオシン頭部と同様にキネシンの頭部の向きが揃っているので、微小管滑り運動の解析において、頭部の向きの不均一性がもたらす影響を受けることがないという利点がある(1)。
装置・器具・試薬
イガイ筋肉からのキャッチン精製において使用する器具
カッターナイフ、ピンセット、解剖用ハサミ、シャーレ
小型の刃が高速で回転するタイプのホモジナイザー(当方ではIKA S8N-8Gを用いる)
遠心分離機および超遠心分離機
キネシンキメラ発現に必要な試料および試薬類
- ラットキネシン頭部とムラサキイガイキャッチン(アミノ酸残基157-985)のキメラタンパクをコードする配列を組み込んだプラスミドを組み込んだ大腸菌BL21(DE3)株(1)
- LB培地500 ml
- 100 mg/ml アンピシリン
- 40 %グルコース
- 1 M IPTG
用意するバッファ
- HSPバッファ
50 mMイミダゾール-HCl pH 7.0, 2 mM EGTA, 2 mM MgCl2, 400 mM NaCl, 2 mM DTT - No Salt バッファ
20 mM PIPES-KOH pH 7.0 at 4 ℃, 2 mM EGTA, 2 mM MgCl2, 2 mM DTT - Low Salt バッファ
20 mM PIPES-KOH pH 7.0 at 4 ℃, 2 mM EGTA, 80 mM KCl, 2 mM MgCl2, 2 mM DTT - High Salt バッファ
20 mM PIPES-KOH pH 7.0 at 4 ℃, 2 mM EGTA, 400 mM KCl, 2 mM MgCl2, 2 mM DTT - 0.1 mM ATP in HSB
High Saltバッファに0.1 mM ATPを含むもの。なお、菌の超音波破壊を行う場合は、さらにプロテアーゼインヒビターを添加しておくこと。 - キネシンアッセイバッファ
10 mM Tris-CH3COOH pH 7.5 at 25℃, 50 mM CH3COOK, 4 mM MgSO2, 1 mM EGTA
実験手順
A. キャッチンの精製
- ムラサキイガイ Mytilus galloprovincialis の前・後足糸牽引筋(anterior and posterior byssus retractor muscles, ABRMおよびPBRMと略す)および閉殻筋(posterior adductor muscle, PAMと略す)(図1)を取り出し重さを測る。シャーレに移して解剖用ハサミで細かく切り刻む。イガイの解剖手順は図2に詳しく述べる。
- 上で測った質量の 6 倍のHSPバッファを加えてホモジナイザーで1~2分間ホモジナイズし、エッペンチューブに1 mlずつ分注する。
- 75℃(もしくは80℃)のお湯で 3 分間ボイルし、水道水で 10 分間冷ます。
- 遠心分離。4 ℃で 30 分間 15,000 rpm(13,000 g)。
- 上清を Low Salt バッファで 2 時間透析。
- 遠心分離。4 ℃で 20 分間 10,000 rpm(9,000 g)。
- ペレットに、最初に測った筋肉の質量と等量のHigh Saltバッファを加え、ゆっくり20分間ピペッティングして良く溶かす。
- 超遠心分離。4 ℃で 30 分間 100,000 rpm(450,000 g)。
- 上清のタンパク質濃度を測定して1mg/mlになるようにHigh Saltバッファで希釈し0.3 mlずつ分注して液体窒素で急速凍結したのち、-80 ℃で保存する。
B. キャッチンキネシンキメラの発現誘導
- 大腸菌のストックを白金耳でかき取り、LB 培地 50 ml(0.1 mg/ml アンピシリンおよび 0.5 %グルコースを含む)に植え、37 ℃で 16 時間振盪培養。
- 遠心分離。25 ℃で 6 分間 5,000 rpm(4,000 g)。
- ペレットをLB培地 450 ml(0.1 mg/mlアンピシリンを含む)に移し替えて 25 ℃で 5 時間振盪培養。
- 終濃度が 0.4 mM となるように 1 M IPTG を0.18 ml 加えて、25 ℃で 3 時間振盪培養して発現誘導する。
- 遠心分離。25 ℃で 6 分間 5,000 rpm(4,000 g)。
- ペレットを純水に溶かし、遠心分離。25 ℃で 6 分間 5,000 rpm(4,000 g)。
- ペレットを純水に溶かし、遠心分離。25 ℃で 6 分間 5,000 rpm(4,000 g)。
- ペレットが集菌した大腸菌である。すぐにキメラの精製を始めない場合は、液体窒素で菌を急速凍結して、-80 ℃で保存する。
C. キネシンキャッチンキメラの精製
- 450 ml の LB 培地で発現誘導して集菌した大腸菌に 0.1 mM ATP in HSB (インヒビター入り)を 10 ml 加えて、氷冷しながら超音波破壊する。
- 遠心分離。4 ℃で 20 分間 12,000 rpm(13,000 g)。
- 上清をLow Saltバッファで 2 時間透析する。
- 遠心分離。4 ℃で 20 分間 10,000 rpm(9,000 g)。
- ペレットにHigh Saltバッファを 0.53 ml 加えて 20 分間のピペッティングで良く溶かす。
- 超遠心分離。4 ℃で 20 分間 100,000 rpm(340,000 g)。
- 上清からFPLC(Superose 6 HR 10/30, bed volume 24 ml)を用いたゲル濾過クロマトグラフィーによってキメラタンパクを精製する。流速は0.3 ml/minで約24分後に溶出してくる。
D. 再構成キネシン繊維の作製
- 凍結保存しておいたキャッチンを解凍し、High Salt バッファで 100μg/ml に希釈する。
- 1mlずつに分けて透析する。透析外液は、High Salt バッファに No Salt バッファを 2 時間かけて加えることにより、400 mM から 100 mM へと KCl 濃度を徐々に下げていく。
- キネシンキャッチンキメラ溶液(in 400 mM KCl)0.1 mlに、上で重合させたキャッチン繊維溶液(in 100 mM KCl)0.9 ml を加えてピペッティングし、1 時間氷上放置。
- 遠心分離。4 ℃で 20 分間 5,000 rpm(1,400 g)。
- ペレットをキネシンアッセイバッファ 0.2 ml で溶かす。観察時には10~20倍希釈して使う。
以上のようにして作製した再構成キネシン繊維を用いて、蛍光染色した微小管の滑り運動を観察する方法は成書(3)に準ずる。
工夫とコツ
A.キャッチンの精製
手順1では、目的とする筋肉以外の組織をよく取り除くこと。
手順3で試料をボイルする場合は必ずお湯を使うこと。ヒートブロックなどを用いると失敗する。
D.再構成キネシン繊維の作製
手順2において、水温を25~6 ℃に保つと長いキャッチン繊維を得ることができる。
実験の安全
A.キャッチンの精製
手順1では先の鋭いピンセットや解剖用ハサミ、手順2では刃が高速で回転するホモジナイザーなど、刃物を用いるため怪我をしないように注意して行うこと。
文献
- Taba et al., Cell Motility and the Cytoskeleton 65, 816-26(2008)
- Yamada et al., J. Mol. Biol., 295, 169-78(2000)
- 馬渕一誠(編), 「細胞生物学の基礎技術」, 89-92 羊土社(1997)