概要
これまで組換えタンパク質の分泌発現には主に昆虫細胞や哺乳類細胞が宿主として用いられてきた。特にバキュロウイルスを介し昆虫細胞で目的のタンパク質を発現させる手法は特殊な培養器具は必要とせず、簡便なキットが数社から市販されていることから汎用的に用いられる技術となっている。近年、カイコに感染するバキュロウイルス(BmNPV)を用いることで、培養細胞ではなくカイコの生体内で目的タンパク質を発現させる技術が確立され様々な研究用タンパク質の発現に利用できるようになった。
カイコでのタンパク質発現の特徴は他の真核細胞系よりも高発現(カイコ体液 1 mL 当たり~数 mg)であること。また、これまで昆虫細胞系ではウイルス増殖から発現までに数ヶ月を要していたが、カイコ発現系では1ヶ月以内に終了すること。さらにカイコ数匹毎に感染させるウイルスを変えれば複数のタンパク質の同時発現が可能であることなどがあげられる。現在、各研究室でカイコを飼育しタンパク質の発現実験を行えるまでの汎用性はないが、数社がトランスファーベクター構築、タンパク質発現・精製までの受託を行っている。
このプロトコールでは、カイコ発現系が企業受託であるため実際の発現については記載できないが、実際に著者らが片倉工業(株)(現在 Kaiko express)へ依頼した例(免疫グロブリン Fc 領域と融合発現させるためのトランスファーベクターの構築、受容体細胞外領域のカイコ発現系による Fc との融合発現及び精製)について紹介する。
装置・器具・試薬
- カイコ発現系受託企業
- 片倉工業(株)(Kaiko Express)
http://www.katakura.co.jp/kaikoexpress/index.htm - 日本農産工業(株)
http://bio.nosan.co.jp/protein/service/bomx_series.html - (株)ネオシルク
http://www.neosilk.co.jp/jyutaku1.html
- 片倉工業(株)(Kaiko Express)
- クローニングベクター(pGEM-5Zf(+)、pBluescript など)
- トランスファーベクター(企業が指定・推奨するもの)
- 遠心分離機(50 mL の遠心チューブが 15,000 x g 以上で遠心できるもの)
- アフィニティーカラム(Protein A、Ni-NTA、GST 固定化樹脂)
- 消化酵素(トロンビン、エンテロキナーゼ、Precision Protease)
実験手順
- 打ち合わせ
- 発現形態(分泌、可溶性、膜貫通)、トランスファーベクターの選択、発現・精製プランなど
- トランスファーベクターの構築(各研究室で実施もしくは企業へ依頼)
- ウイルス液調製、ウイルス感染、タンパク質発現(企業へ依頼)
- タンパク質の精製(各研究室で実施もしくは企業へ依頼)
実験の詳細
1. 打ち合わせ
発現させたいタンパク質の発現形態(分泌、細胞内、膜貫通)によって、体液もしくは磨砕液からのタンパク質回収が選択できる。通常分泌タンパク質であれば体液、細胞内・膜貫通であれば磨砕液から目的のタンパク質を回収する。タンパク質発現に用いるトランスファーベクターや発現後のタンパク質精製、それらの受託費用などは企業との打ち合わせで決定する。目的タンパク質発現を確認するためには、ウイルス液調製及び1単位(体液 25 mL)の依頼が必要で、およそ30万円の費用となる(片倉工業の場合)。追加生産(~10単位程度)では発現確認に使用したウイルス液が使用されるためウイルス調製費用はかからない。その他、ベクター構築費用などが発生する。
著者らは受容体の細胞外領域のみを分泌発現させることを目的としてカイコ発現系を利用しており、体液からのタンパク質回収を選択した。体液からのタンパク質の回収、精製は独自に行った。
2. トランスファーベクターの構築
各企業で専用や推奨のベクターが用意されており、タグ付発現も可能である(各社 URL 参照)。独自にベクターを構築することもできるが、目的タンパク質をコードするDNAを含むクローニングベクターを渡すことにより、トランスファーベクター構築を依頼することもできる。
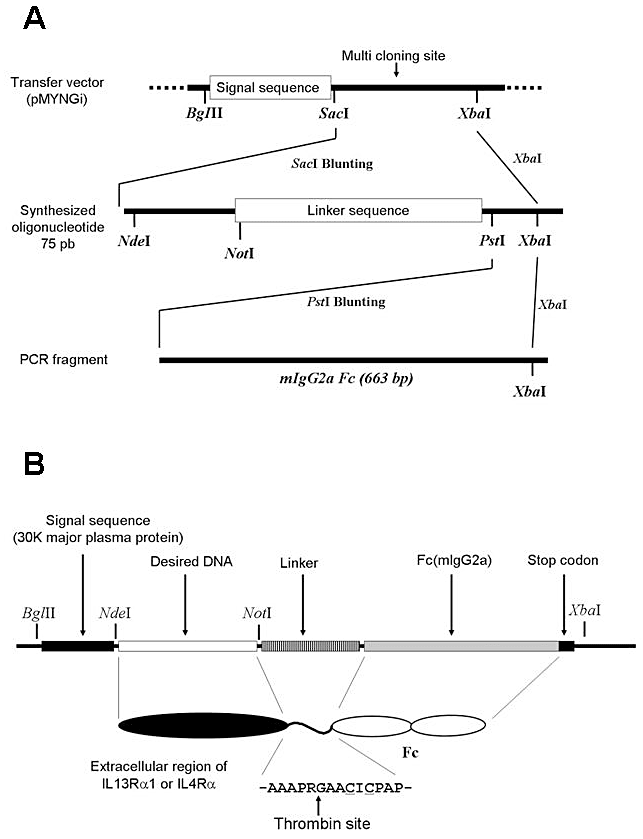
著者らは以前昆虫細胞で顆粒球コロニー刺激因子(GCSF)受容体の細胞外領域と Fc の融合発現に成功している(1)。そこで受容体細胞外領域を発現させるために、片倉工業の pMYNGi ベクターを基にマウス IgG2a の Fc 領域と融合発現させる独自のベクターを構築した(図1A)。このトランスファーベクターの NdeI-NotI 制限サイトを介して目的のタンパク質をコードする DNA を導入することによりマウス Fc との融合発現が可能となり、発現された受容体領域はトロンビン消化により Fc と切り離すことができる(図1B)。
3. ウイルス液調製、ウイルス感染、タンパク質発現確認
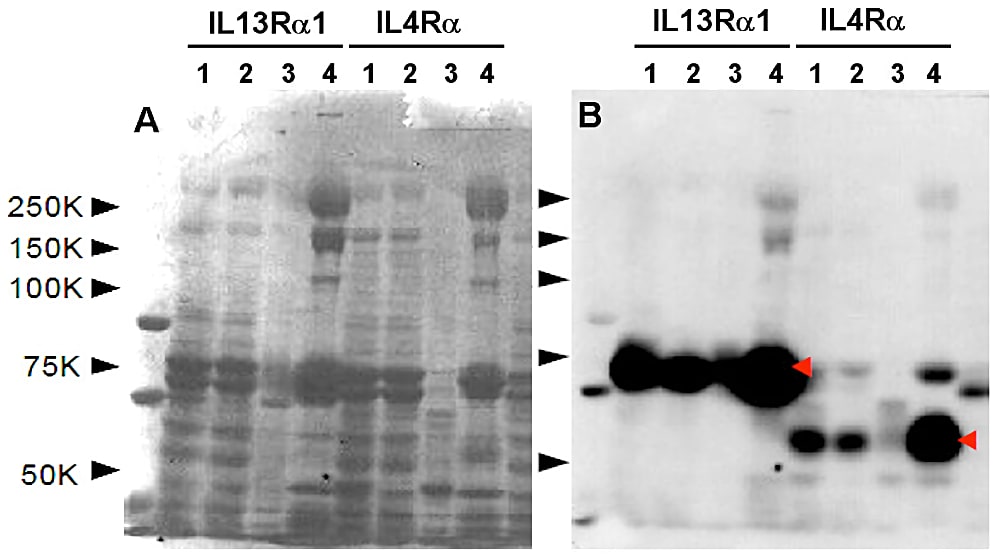
この過程は現状では各研究室で実施できないことから企業へ依頼する。ウイルス感染後、3週間でカイコ試料中のタンパク質を SDS-PAGE で分離後、特異的抗体を用いたウエスタンブロッティングにより目的タンパク質の発現確認が行われる。その結果が PDF ファイルとしてメールで送られてくる(図2)。また、同時に1単位分(蛹磨砕液 70 mL、体液 25 mL)も冷凍状態で送られてくる。この体液試料を独自に分析し、追加生産の可否を決定する。
著者らが依頼したヒト IL-13 受容体 α1 鎖細胞外領域-Fc の発現では体液 1 mg 当たり 10 mg のタンパク質発現が確認された。
4. タンパク質の精製
発現タンパク質の精製も企業へ依頼することができる。得られたカイコ試料中には比較的高濃度で目的タンパク質が含まれているが、それ以上にカイコ由来の夾雑タンパク質が高濃度で混在していることから、まずオープンカラムによるアフィニティー精製により目的タンパク質を特異的に回収する。さらに必要に応じて消化酵素によるタグの除去及び最終精製を行う。
著者らは、Fc 融合発現したヒト IL-13 受容体 α1 鎖細胞外領域を回収、精製するため凍結されたカイコ体液(30 mL)を氷上で溶解後、遠心分離し不要物を除去し、得られた体液上澄からプロテイン A セファロース FF カラムで Fc 融合タンパク質を回収した。トロンビンで消化後、Resource Q カラムで精製することにより IL-13 リガンドと結合能を有する受容体細胞外領域をカイコ体液 1 mL から 0.2 mg 精製することができた(2)。
工夫とコツ
バキュロウイルス–カイコ発現系の利点と注意点
概要でも紹介した様に、カイコでのタンパク質発現の利点は、短期間で高発現が可能であり、しかも複数タンパク質の同時発現も可能である。しかしながら注意しなければならないこともあることから以下に記載する。
すべてのタンパク質が高発現というわけではない
他の発現系と同様にすべてのタンパク質が高発現できるわけではない。著者らは10種以上の受容体細胞外領域の発現を実施したが、発現レベルには10倍以上の差が見られた。
SDS-PAGE のみでは目的タンパク質の発現確認が困難
培養細胞系とは異なりカイコ体液(A280 がおよそ100)という高濃度の宿主由来タンパク質中に目的タンパク質が混在されるため、抗体を介したタンパク質の検出(ウエスタンブロッティング)が必要となる。
タグ、融合タンパク質の付加が必要
高濃度の宿主由来タンパク質中から目的タンパク質のみを精製するため、タグ・融合タンパク質の付加は必須である。
試料
他のタンパク質とのジスルフィド結合を介した重合にも注意を払う必要がある。カイコの体液や磨砕液は溶液状態で数日間保存すると内在性のフェノールオキシダーゼの影響で変色を伴う沈殿が生じ、目的タンパク質回収低下につながることから精製作業は速やかに実施する。
利用したことはないが(株)ネオシルクでは目的タンパク質を繭中に発現するトランスジェニックカイコを作成の受託を行っている。目的タンパク質は繭から緩衝液で抽出できるとのことなので目的タンパク質を大量にかつ高純度で得るには有効であると考えられる。
文献
- Mine S., et al., Biochemistry, 43, 2458–2464 (2004)
- Honjo E., et al., Protein Expr. Purif. in press