概要
光をエネルギーや情報に変換する光受容タンパク質の光誘起赤外差スペクトルの計測法について、ロドプシンを例にして説明する。本手法で得られる情報は、光受容部位である発色団の構造変化や、それに伴うタンパク質の構造変化(二次構造やアミノ酸測鎖)である。また、試料に含まれる水分を調節することにより、タンパク質内部に存在する水分子やアミノ酸測鎖の \(\ce{O-H}\)、\(\ce{N-H}\) 伸縮振動(水素結合強度のプローブ)を検出することが可能となる。1回の赤外分光計測は1日で完了するが、スペクトルのS/N比を向上させるために、同様の計測を繰り返したり、信号の帰属のために安定同位体置換試料、変異体試料などの計測が必要となることもある。
目的
生物は、視覚や光合成に代表されるように、光を情報およびエネルギーとして利用している。そのような生命活動は様々なタンパク質が関与することにより実現されているが、光を捉える最初の反応を担うのが光受容タンパク質である。これらは、レチナールやクロロフィル等の発色団を結合して、光を受容し、発色団の異性化や電荷分離等によりエネルギーを捕捉するタンパク質である。
光受容タンパク質の機能発現においては、発色団が結合する部位、タンパク質間の相互作用部位、それらの結合や構造変化に伴うアロステリック効果などが重要である。これらに関与するアミノ酸残基の変化を検出するためには、タンパク質全体からなる様々な分子振動から切り分ける必要がある。光誘起赤外差スペクトルの計測は反応に関与するアミノ酸残基の分子振動を抽出する強力な手法である。
このような計測法を活用することにより、光受容に伴って生じる発色団やタンパク質の構造変化を検出することが可能となる。特にX線結晶構造解析では検出することが難しい水素原子が関与する分子振動(レチナールの水素面外変角振動、カルボン酸の \(\ce{COOH}\) および \(\ce{COO\bond{-}}\) 伸縮振動、水分子の \(\ce{O-H}\) 伸縮振動、アミノ酸測鎖の \(\ce{N-H}\)、\(\ce{O-H}\) 伸縮振動)から、発色団に加わっている歪み、カルボン酸のプロトン化状態、水分子やアミノ酸測鎖の水素結合強度などの情報が得られることに特徴がある(1,2)。
本プロトコールの目的は、様々な光受容タンパク質の構造・機能相関の研究に、赤外分光法をどのようにすれば適用できるかを紹介することである。しかし、光で活性化するケージド化合物を利用するなどして、光受容タンパク質以外の酵素や膜受容体などにも発展させることが可能であるため(3)、その適用範囲は実験者の創意工夫によっていくらでも拡張できるものと期待している。
装置・器具・試薬
- フーリエ変換赤外分光光度計
通常はDTGS検出器が利用されるが、感度がよく、スキャン速度も速く設定できるMCT検出器が望ましい。著者の所属する神取研究室ではBio-Rad社のFTS-40やDIGILAB社のFTS-7000を使用(Bio-Rad社の赤外分光部門がDIGILAB社に移り、現在はVarian社となっている)(図1)。 - 光学測定用クライオスタット
赤外測定用窓板(\(\ce{KBr}\) や \(\ce{ZnSe}\) など赤外光を透過する窓板)が設置され、液体窒素温度まで冷却できるものが望ましい。-30℃程度でも反応速度を計測時間程度(約1分)にまで遅くできるのであれば、Harrick社等の温度可変セルに低温恒温循環槽を接続したものでもよい(温度コントロール性能は最低でも±0.1℃は必要)。神取研究室ではオックスフォード・インスツルメンツ社のDN-1704やOptistat DNを使用している。これらの製品は光照射操作を前提に設計されており、特別な改造は必要としない。赤外分光装置への取り付けは、業者に相談すると良い。 - 真空ポンプ
クライオスタットを真空引きするために使用。油拡散ポンプが接続された高真空タイプが必要。神取研究室ではULVAC社のVPC-050(液体窒素トラップ付き)を使用。温度可変セルを用いる場合は不要。 - 試料用窓板
\(\ce{BaF2}\),\(\ce{CaF2}\) 製(1000~800 cm-1を計測する場合は \(\ce{BaF2}\) 製が良い)がよく使われているが、低波数測定には \(\ce{ZeSe}\),\(\ce{AgBr}\) なども使用されている。応用光研、ピアーオプティックス社から購入できる。(図2)。 - 試料照射用光源
クライオスタットの試料室に励起光を導入できるものであれば、どのような光源でも使用できる。朝日分光社の照射光源のように、光学フィルターやシャッターなどをパソコンで制御できれば、計測を自動化できるなどの利点がある。 - 光学フィルター
短波長カットフィルターや特定の波長を透過する干渉フィルターなど様々なものを用意すると便利である。旭テクノグラス、シグマ光機、メレスグリオ社などから購入できる。また、赤外バンドパスフィルター(Geなど)を試料および検出器の前に設置する必要がある。試料がHe-Neレーザー(633 nm)で励起されたり、検出器が過剰の可視光で破損したりすることを避けるのに有効である。検出器への可視光の遮蔽には電磁シャッターを使用しても良い。 - 重水(\(\ce{D2O}\))および水の同位体(\(\ce{H2^{18}O}\)、\(\ce{D2^{18}O}\))
振動バンドのH/D交換性を検討したり、\(\ce{O-H}\) や \(\ce{O-D}\) 伸縮振動が水に由来するのかを同定するために使用。昭光通商、渡商会、大陽日酸社などから購入できる。 - 部位特異的変異体試料
振動バンドの帰属を行う際に必要。例えば、プロトン化カルボン酸の振動の帰属には、AspやGluを、それぞれAsn,Glnに置換したり、Glu,Aspと入れ替えたものを作成したりする。また、標的となるアミノ酸をAlaに変異したものも利用する。機能を欠損する変異タンパク質では、赤外吸収スペクトルが大きく変わり、振動バンドの帰属が困難となる場合がある。その際は、タンパク質の構造にあまり影響がない変異体を作成することが重要となる。 - 安定同位体標識試料
\(\ce{^{13}C}\)-Glucoseや \(\ce{^{15}NH4Cl}\) などを含む最小培地で培養することで、タンパク質全体を \(\ce{^{13}C}\) もしくは \(\ce{^{15}N}\) 標識し、タンパク質に由来する振動バンドを帰属することが可能となる。また、それぞれのアミノ酸の安定同位体標識試料を用いれば、振動バンドがどのアミノ酸に由来するのかを帰属できる。さらに、セルフリーシステムが利用できるのであれば、部位特異的にアミノ酸の安定同位体標識をすることで、アミノ酸残基番号を含めて、振動バンドの帰属が可能となる(究極の振動バンドの帰属法ではあるが、活性を持ったタンパク質を高純度で調製することは容易ではなく、あまり利用されていない。通常は、部位特定的変異体を用いることでアミノ酸残基番号の特定を行う)。
実験手順
- 乾燥フィルム試料の調製
- 赤外吸収スペクトルの計測
- 光誘起赤外差スペクトルの計測
実験の詳細
1. 乾燥フィルム試料の調製
タンパク質試料はNi-NTAアフィニティクロマトグラフィーなどで精製済みのものを使用する。水溶性タンパク質は任意の緩衝液に溶かし、膜タンパク質は脂質に再構成したものを緩衝液に懸濁する(緩衝液はpH 5では5 mMクエン酸緩衝液、pH 7では2 mMリン酸緩衝液、pH 9では2 mMホウ酸緩衝液をよく使用している。塩濃度は20 mMを超えると乾燥時に析出するため、できるだけ低くする。試料濃度は3 mg/ml程度とする。)
赤外窓板上に60 μLの試料懸濁液を滴下し、水道アスピレーターに接続されたデシケーター内で乾燥させる(約30分程度でフィルム状に乾燥する)。乾燥に弱い試料については、真空引きせずに、冷蔵庫内で一昼夜乾燥させるなどの方法も試みると良い。図2Aに古細菌型ロドプシンの1種であるファラオニスフォボロドプシン(ppR)の乾燥フィルムを示す。
試料は冷蔵庫に保存しておく。
2. 赤外吸収スペクトルの計測
個々の赤外分光装置の使用法については、各種マニュアルを参照すること。赤外吸収スペクトルを計測するためのバックグラウンドは、空の赤外窓板2枚をサンプルホルダーにセットし、アパーチャーで赤外光強度を調節して計測している。スキャン回数は1024回としている。その後、乾燥フィルムをホルダーにセットし、吸収スペクトルを計測する(図3)。amide Iの吸光度が0.7~1.2程度に収まっていない場合は濃度を調節して乾燥フィルムを作製し直す(ただし、amide I領域を捨てて、測定したい振動数領域のみに絞る場合は濃い試料を用いても構わない)。
クライオスタットの真空引きを行い、液体窒素を充填し、冷却の準備を行う。これらの操作については、それぞれの機器のマニュアルを参照すること。次に、サンプルホルダーから乾燥試料を取り出し、近傍に水滴を乗せ(約1~4 μL程度。水和量を抑えたい場合はグリセロールを10~50%程度で添加する(4))、シリコン製スペーサ(厚さ0.5~1 mm程度)を乗せ、空の窓板で密閉することにより、試料を穏やかに水和する(図2B)。水和フィルム試料の赤外吸収スペクトルが図4のようになっていることを確認して、光誘起赤外差スペクトルを計測する温度にまで冷却する。ただし、初めて測定する試料においては、十分に水和した条件や乾燥気味の条件などを検討して、計測が生理的条件を反映しているか留意する必要がある。水和は通常、5~30分程度で行う。
3. 光誘起赤外差スペクトルの計測
温度を冷却してから、赤外吸収スペクトルを連続で2回計測し(128~256スキャン)、両者の差スペクトルを計算する(ベースラインと呼んでいる)。注目している振動数領域での吸光度の変動が0.001以内に収まっていることを確認する。経験上、だいたい1時間程度でベースラインが安定する。
試料に光照射を行う直前にベースラインを再び計測し、それから試料に光照射を行う。光照射時間については、事前に同様の条件で可視吸収スペクトル変化を計測して最適な時間を決定しておくとよい。光照射前後の赤外差スペクトルを計算することによって、光誘起赤外差スペクトルが得られるので(図5)、ベースラインと比較して、有意な振動バンドが観測されているかどうかを確認する。
もし、フォトクロミックな性質のある試料の場合は、照射する光の波長を調節することにより、連続的に差スペクトルを計測して、S/N比を向上させることができる。1度光照射すると失活する場合は、試料調製からやり直して、満足のいくS/N比となるまで何度も計測を行う。
良好な光誘起赤外差スペクトルが測定できれば、部位特異的変異体試料や安定同位体標識試料を用いて同様の計測を行い、振動バンドの帰属を行う。神取研究室ではppRの情報伝達過程でのレチナールおよびタンパク質の構造変化として、図6に示すような振動バンドを検出してきた(5–8)。
工夫とコツ
赤外分光測定に用いる試料について
赤外線は光受容に関与しないタンパク質でも吸収されるため、不純物として含まれるタンパク質が良好な赤外差スペクトルの計測を阻害することがある。そのため、できるだけ純度が良い方が良い(SDS-PAGEでシングルバンドになるぐらい十分に精製が行われた試料でも、amide Iの吸光度において1/300程度の変化しか検出できない。これは光反応に関与するアミノ酸残基がタンパク質全体からすると限定的であるためである)。もし、フォトクロミックな性質を持つ試料であれば、容易に繰り返し計測が可能なので、\(\ce{X-H}\)、\(\ce{X-D}\) 伸縮振動領域を含めた高精度な赤外差スペクトルを計測することができる。常温ではフォトクロミズムを示さない試料でも、低温では示す場合があるので、赤外分光計測の前に、可視吸収分光計測で条件検討を行うと良い。
赤外分光装置について
各社から様々な赤外分光装置が販売されているが、本プロトコールで紹介した微弱な赤外差スペクトル(吸光度差にして0.0001程度)を計測するためには、ハイスペックな製品を用いなければならない。MCT検出器は必須と考えても良いと思う。
液体中での赤外分光計測
通常、タンパク質試料は液体中でしか活性を示さないものが多い。そのような試料の場合は全反射型フーリエ変換赤外分光法(ATR-FTIR)により計測するとよい。ただし、その場合でも、試料を一度セル表面に乾燥させる必要があったり、非常に高濃度のサンプル(10 mg/ml程度)が必要となったりする(ただし、表面増強効果を利用すれば、高感度で計測することが可能である(9))。また、凍結を避けるため、冷却温度は-10~0℃程度に制限される。そのため、反応中間体を安定化できる試料条件を検討したり、時間分解計測が必要となったりする。詳しくは文献3、9、10に記載されている。
文献
- Furutani, Y., Shibata, M. & Kandori, H., Photochem. Photobiol. Sci., 4, 661–6 (2005)
- 古谷祐詞,神取秀樹,第9章第9節 赤外・ラマン分光法,生物物理学ハンドブック, 朝倉書店 (2007)
- Gerwert, K., Handbook of Vibrational Spectroscopy vol. 5, Applications of Vibrational Spectroscopy in Life, Pharmaceutical and Natural Sciences
- Noguchi, T. & Sugiura, M., Biochemistry, 41, 2322–30 (2002)
- Sudo, Y., Furutani, Y., Wada, A., Ito, M., Kamo, N. & Kandori, H., J. Am. Chem. Soc., 127, 16036–7 (2005)
- Sudo, Y., Furutani, Y., Shimono, K., Kamo, N. & Kandori, H., Biochemistry, 42, 14166–72 (2003)
- Furutani, Y., Kamada, K., Sudo, Y., Shimono, K., Kamo, N. & Kandori, H., Biochemistry, 44, 2909–15 (2005)
- Kamada, K., Furutani, Y., Sudo, Y., Kamo, N. & Kandori, H., Biochemistry, 45, 4859–66 (2006)
- Ataka, K. & J. Heberle, J. Am. Chem. Soc., 126, 9445–57 (2004)
- Iwaki, M. & P. R. Rich, Mol. Biosyst., 3, 398–407 (2007)
-
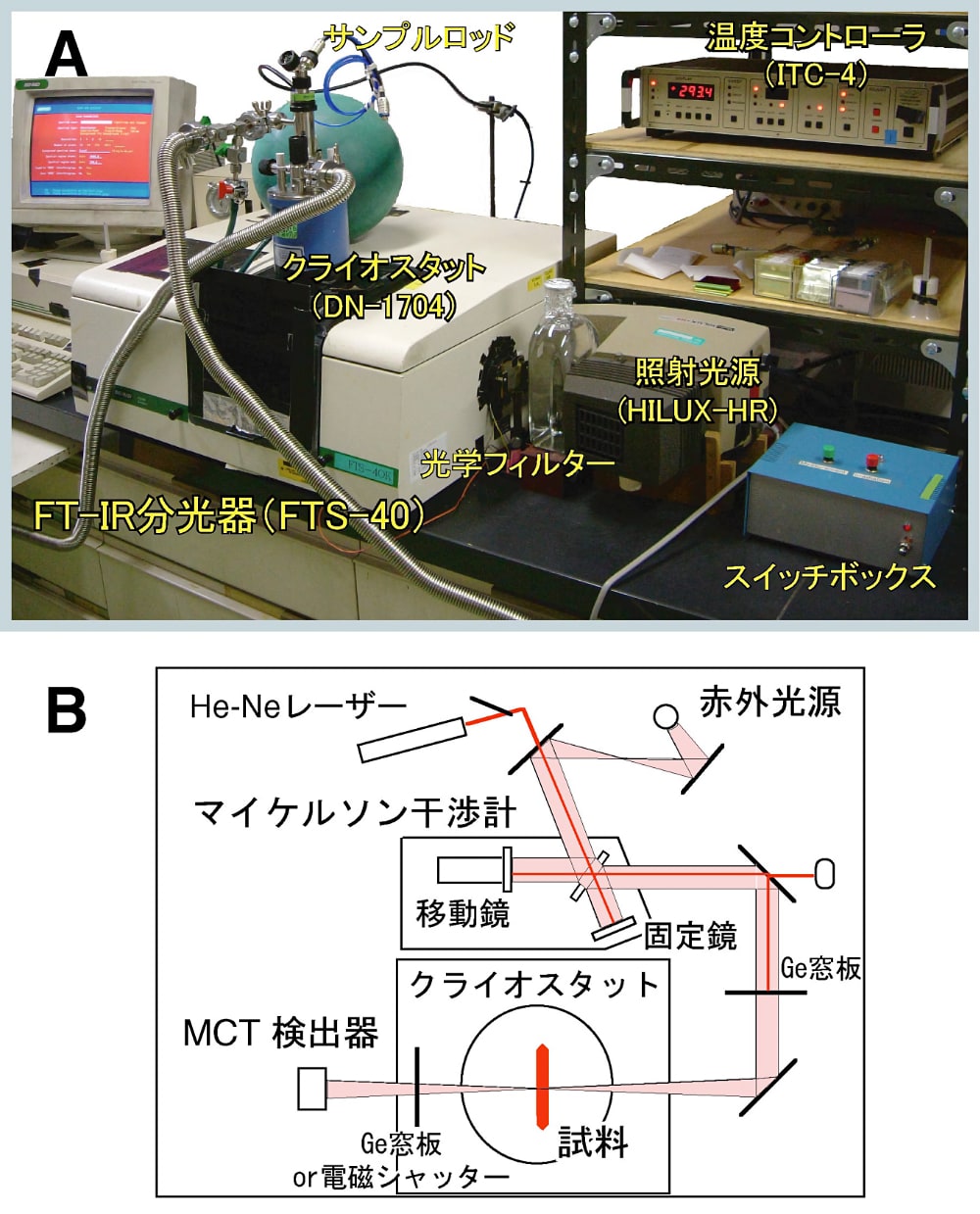
図1:赤外分光装置の外(A)及び内部の模式(B)
(A)赤外分光装置の試料室に液体窒素温度まで冷却可能なクライオスタットを設置している。また、試料に励起光を導入するための照射光源やシャッターコントロールのためのスイッチを設置する。(B)赤外光はマイケルソン干渉計で干渉されて試料に導入される。試料を通過した赤外光は高感度のICT検出器で検出される。分光器に接続されたコンピューターでフーリエ変換されることで赤外吸収スペクトルが得られる。 -

図2:サンプルホルダーと乾燥フィルム試料(A)、水和フィルム試料(B)と試料のセット方法(C)
試料懸濁液を赤外窓板上で乾燥させたフィルム試料を(B)に示したように密封する。その際に、試料の近傍に \(\ce{H2O}\)、\(\ce{D2O}\)、\(\ce{D2^{18}O}\)(矢印)などを滴下し、水和する。それを(C)のようにサンプルホルダーに固定してクライオスタット内にセットする。 -
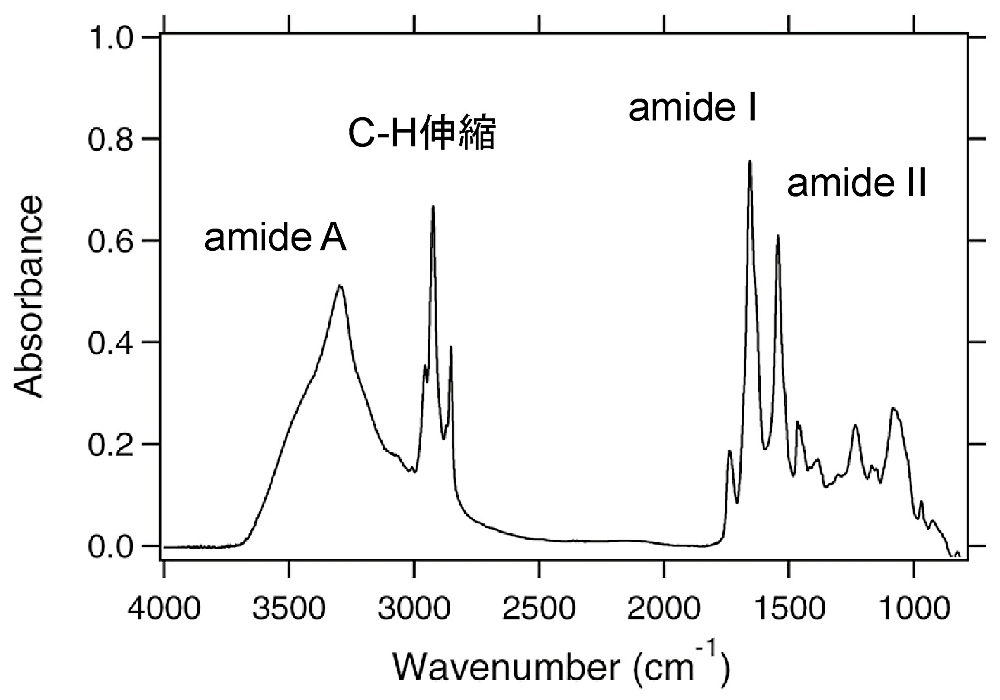
図3:乾燥フィルムの赤外吸収スペクトル
試料は古細菌型ロドプシンであるファラオニスフォボロドプシン(ppR)である。タンパク質の骨格に由来するamide I,II,Aと脂質の \(\ce{C-H}\) 伸縮振動のピークが頭著である。 -
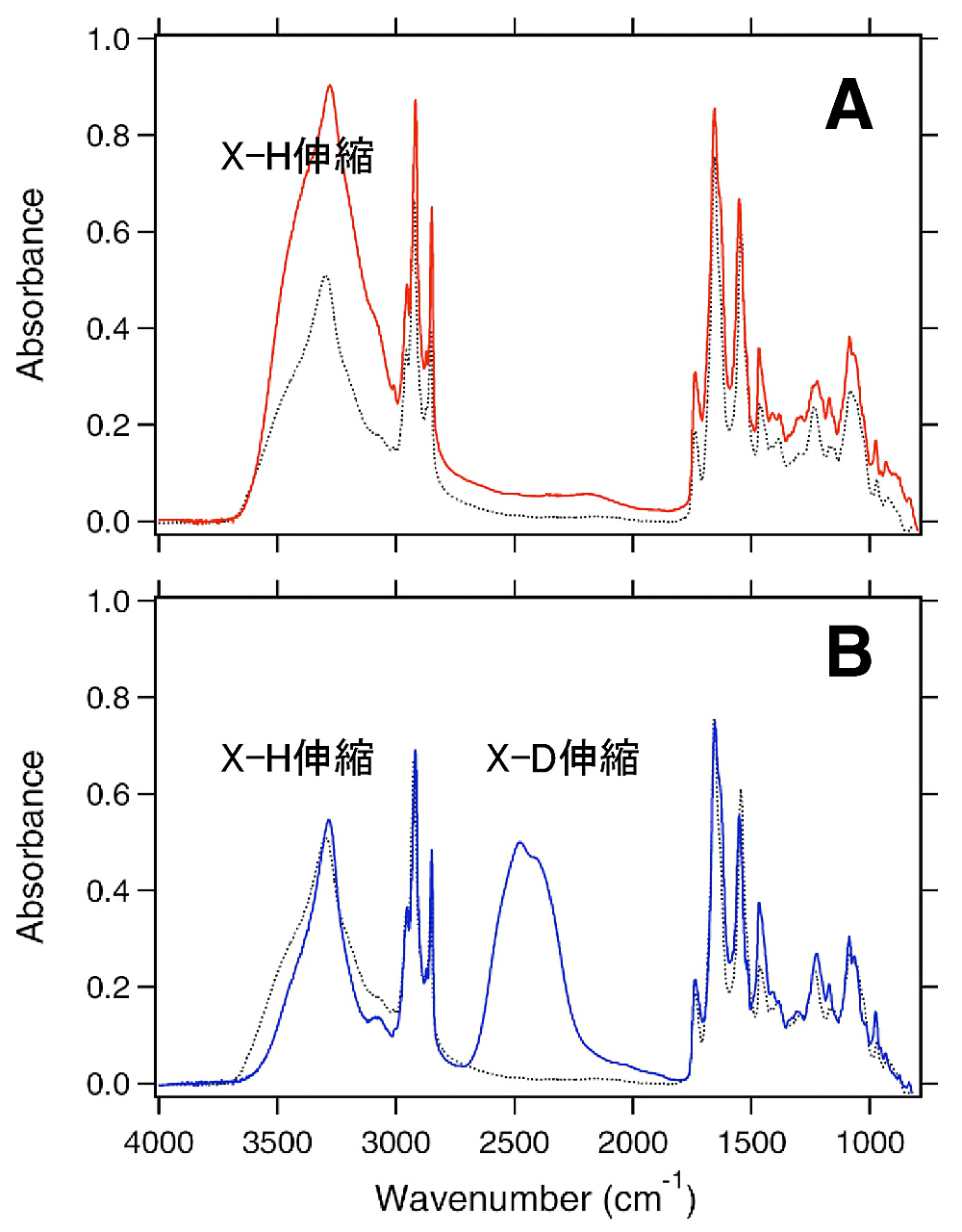
図4:水和フィルム試料の赤外吸収スペクトル(A;\(\ce{H2O}\),B;\(\ce{D2O}\))
試料の水和量を適度に調節することにより、\(\ce{X-H}\)、\(\ce{X-D}\)(X=O,N)伸縮振動の領域でもスペクトル変化を検出することが可能となる。経験的に1.0 O.D.以内であれば、良好な赤外差スペクトルの計測ができる。 -
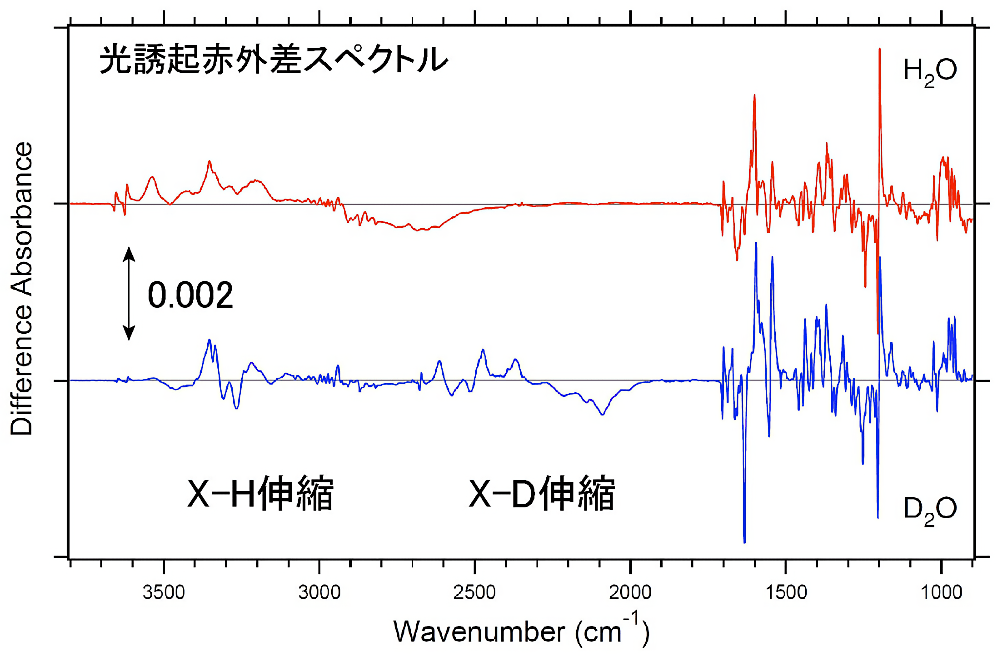
図5:光誘起赤外差スペクトル
赤は \(\ce{H2O}\) 水和試料、青は \(\ce{D2O}\) 水和試料である。試料はファラオニスフォボロドプシン(ppR)、測定温度は77 Kである。それぞれの振動バンドはレチナールの光異性化に伴う構造変化に由来する。 -
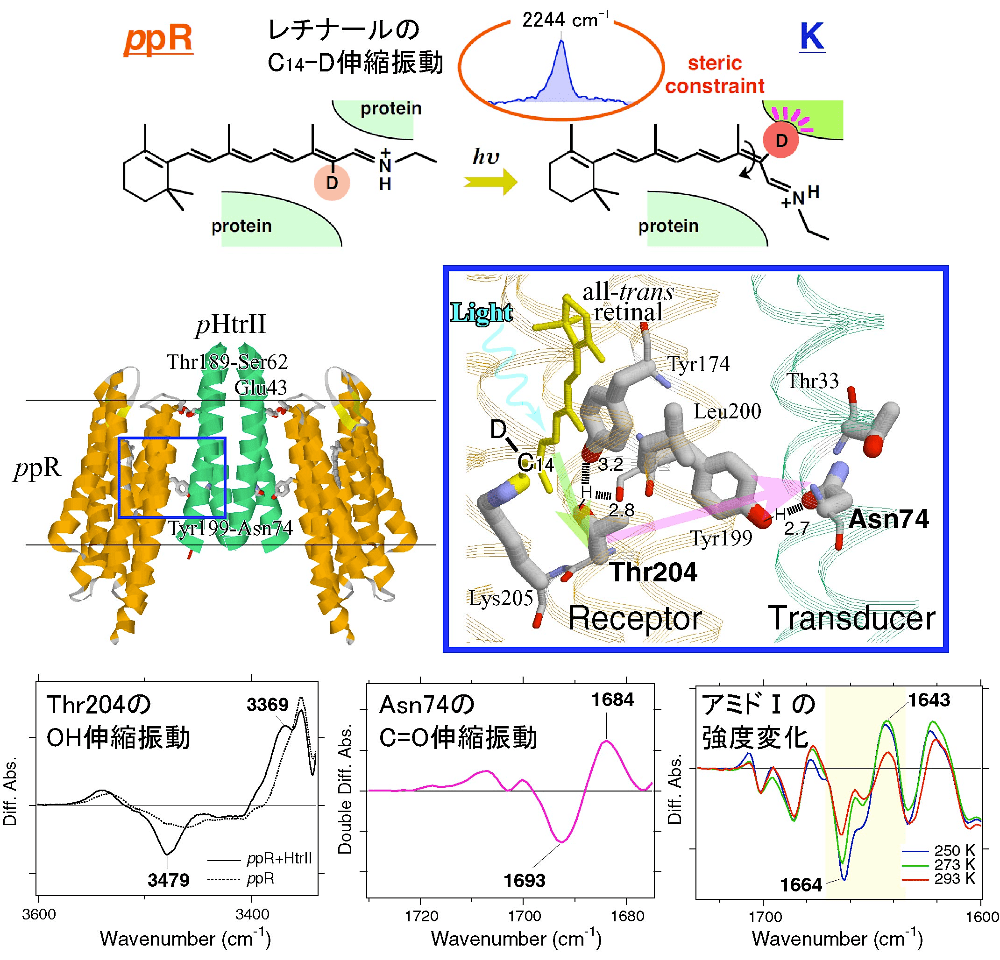
図6:光誘起赤外差スペクトルから明らかになったファラオニスフォボロドプシン(ppR)の情報伝達過程でのレチナールおよびタンパク質の構造変化
レチナールの光異性化に伴って \(\ce{C14-D}\) 伸縮振動やThr204の \(\ce{OH}\) 伸縮振動に変化が現れ、pHtrIIへの情報伝達の際に、pHtrIIのAsn74の \(\ce{C=O}\) 伸縮振動やppRのアミドIの強度変化が生じる。それぞれ文献5–8で帰属した。


