概要
本稿では、赤外吸収スペクトルに現れるC=O伸縮振動(アミドI)バンドの解析に基づく、タンパク質の二次構造解析を行うための手順および注意すべき点を具体例とともに解説する。この方法により、円偏光二色性、X線結晶構造解析あるいはNMR法などの各種構造解析手法と矛盾しない結果が得られることが知られている。
赤外吸収分光法がもたらす情報には原子座標決定の精度が必ずしもあるわけではない。しかしながら赤外吸収分光に求められる試料準備の要求が少ないことから、利用範囲は幅広い。タンパク質のフォールディング問題、あるいは生理活性と分子構造の関連の解析など、様々な問題において、二次構造(変化)の解明が十分本質的な価値を持つ場合がある。本稿で紹介する手法は、そのような問題に対して有用な情報をもたらすであろう。
イントロダクション
赤外吸収分光法は構造化学において強力な実験手法である。等核二原子分子以外は全て何らかの赤外吸収を示すことから、適用範囲は幅広い。
この手法を生体分子に応用する場合、振動スペクトル解析のための厳密な理論を正確に適用することは現実問題として容易ではない。これは、n個の原子からなる非直線分子の基準振動が3n-6だけ存在すること、そのためnが大きくなった場合、赤外吸収スペクトル(以下では赤外スペクトルと略記する)上で各振動バンドを十分に分離した形で検出することが困難であるということによる。この原因は「強度が弱い場合があること」「バンド幅の範囲内に多数のバンドが密集して現れること」などである。
タンパク質の赤外スペクトルには、ペプチド主鎖カルボニル基の振動に帰属される強い吸収バンド(アミドIバンド)が現れる。このバンドの振動数はペプチド主鎖の二次構造の種類によって異なる。この対応関係は、アミドI振動子の連成振動を考慮した近似的な取り扱いにより、良く説明される。この関係を利用してスペクトル形状からタンパク質二次構造解析を行う方法が提案されてきた(1)。本稿ではこの解析の仕方を解説する。赤外吸収分光法の基礎および測定原理に関しては各種文献を参照されたい(2,3)。
装置・器具
測定装置・器具:赤外吸収分光計
透過型セル 温度調節可能であることが望ましい
数値解析ソフトウェア(例えばIgor Pro, Wavemetrics社)
手順
1)サンプル調製と測定
2)二次構造解析
詳細
1)サンプル調製と測定
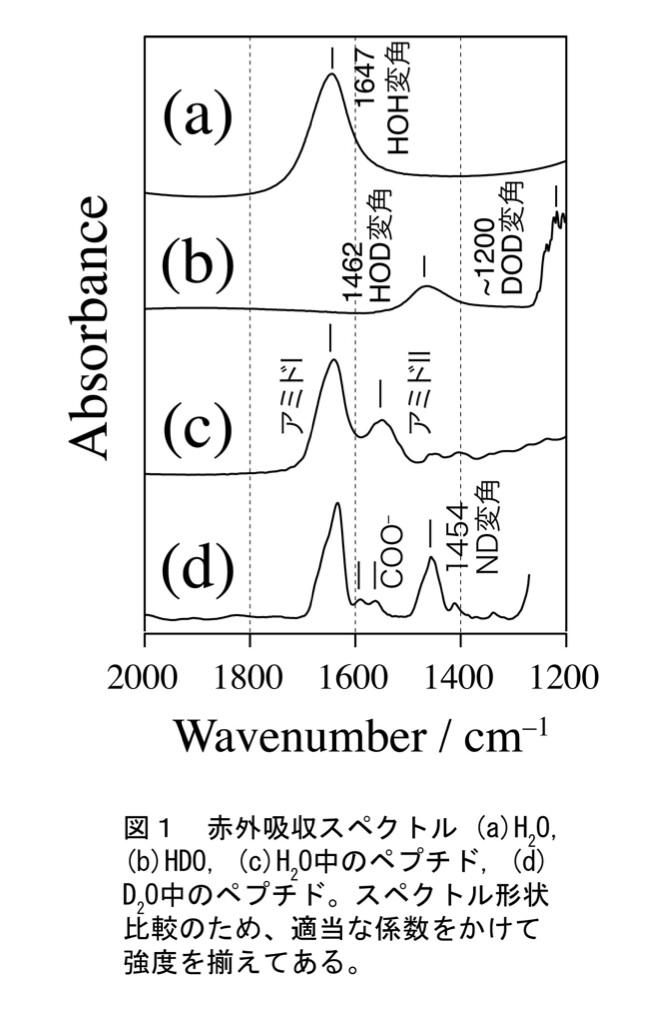
タンパク質研究においては、多くの場合水溶液中での構造が興味の対象である。ところが赤外スペクトルにおいては、H2OのHOH変角振動が1640 cm-1付近に現れてアミドIバンドの測定の大きな妨害となる(図1(a))。H2Oに溶解したタンパク質の赤外スペクトルを高い信号雑音(S/N)比で測定するためには、まず試料セルの光路長を薄く(< 10μm)し、透過光の強度を確保する必要がある。さらに、吸光度を求めるための2種類の測定すなわち「溶媒のみを光路においたときの透過光強度 = I0」「タンパク質溶液を光路においたときの透過光強度 = I」を行うときに、光路長を厳密に一定にする必要がある。光路長が1%変化すると光路上のH2O分子の数が1%変化するが、その結果生じるHOH変角振動バンド強度の1%の変化が、タンパク質のアミドIバンドの形状を正確に記録する上で問題となりうるためである。この問題に関しては、Biocell (Biotools社)などの光路長固定セルを用いると便利である。液体試料用フローセルも利用可能であるが、経験上、光路長が10μm未満になると水溶液試料の入れ替えには工夫を要する(工夫とコツ参照)。また、HOH変角振動バンド形状は温度に依存して変化するため、温度調節(恒温設定)が可能なセルを使用するのが望ましい。
取り扱いの容易さから、窓板にCaF2あるいはBaF2を用いることが多い(4)。透過波数下限はMCT(Mercury-Cadmium-Telluride)検出器の感度下限と同程度である。
筆者らが実際に使用している液体試料セルおよびセルホルダーを図2に示す。図2(上)に示すように、セルホルダーにチューブをハンダ付けして恒温槽からの流水を流すことで試料温度の制御を行っている。図2(下)に示すように、液体試料セルは固定金具(a,a’)、2枚のCaF2窓板(b,b’)、スペーサーからなる。固定金具aおよび窓板bには液体試料を出し入れするための穴がある。厚さが既知のフィルムをスペーサーに用いると窓板間隔の調節がしやすい。我々はポリエチレンテレフタレートフィルム(東レ「ルミラー」)やPTFEシート(ニチアス「ナフロン」)などを適当な形に切り出して用いている。空セルのスペクトルに現れる干渉縞から窓板間隔を求める方法もある。
H2Oバンドの妨害を回避する別な方法として、溶媒に重水(D2O)を使用することが有効である。重水を用いることでHOH変角振動バンド(~1640 cm-1)は消失し、代わりにDOD変角振動バンド(~1200cm-1)が現れる(図1(b))。そのためアミドI領域の測定が非常に容易になる。D2Oを用いた測定試料にごく少量のH2Oが残存すると、HOD由来のバンドが~1450 cm-1に現れ、ベースラインの傾きの原因になる(図1(b))。そのため測定に先立ち、試料(タンパク質やリン酸など試料溶液中に含まれる分子すべて)をそれぞれ重水に溶解し凍結乾燥を行うことでH/D(水素/重水素)交換を行っておく必要がある。αヘリックスやβシートなどの安定構造に含まれる残基においてH/D交換速度が遅い場合は「重水に溶解して凍結乾燥」という作業を何度か繰り返すとよい。
試料濃度はまず1 mg/mL程度として測定を行う。セル間隔によって観測される吸光度は異なるが、A~0.01程度のアミドIバンドが観測されれば、積算によるS/N比改善で十分解析に耐えるスペクトルが得られるであろう。濃度条件に制約がある場合はセル間隔を調節して信号強度を確保する。
二次構造解析を行う場合、スペクトル測定は透過法で行う。全反射吸収測定(ATR)法を用いる場合、赤外光の潜り込み深さ(penetration depth)が波長に依存するため、測定結果は透過法と一致しない。
透過法で測定した赤外スペクトルを図1(c,d)に示す。それぞれはH2O中およびD2O中で測定した同じ試料のスペクトルである。図1(c)において、アミドIバンドが1600-1700 cm-1に、アミドIIバンドが1500-1560 cm-1に見られる。アミドIバンド(主にC=O伸縮振動)の振動モードには主鎖N-Hの運動がほとんど含まれていないため、重水素溶媒中でもバンド形状の変化はほとんど見られない。これに対し、アミドIIバンド(主にC-N伸縮振動およびN-H変角振動)の振動モードには主鎖N-Hの運動が含まれるため、N-H変角がN-D変角に変化することで振動数が変化する。そのため重水中ではアミドIIの振動形は大きく変化する。1454 cm-1にN-D伸縮振動が現れることは(図1(d))、重水中ではN-D変角振動とC-N伸縮振動がもはやカップリングしていないことを示す。図1(d)のアミドII領域に見られるのはGlu, AspおよびC末端のCOO-逆対称伸縮振動バンドである。
フーリエ変換型分光計を用いて得られる赤外スペクトルには、用いるアポダイゼーション関数の種類に応じて、本来は観測されるはずのない疑似ピークや負のピークが現れうる(2,3)。アミドIバンドの分解および面積の比較を行う上で、疑似ピークや負のピークの出現は誤った解析結果をもたらすため問題である。筆者らはアポダイゼーション関数にHapp-Genzel関数を用いている。
2)二次構造解析
2-1 基礎知識
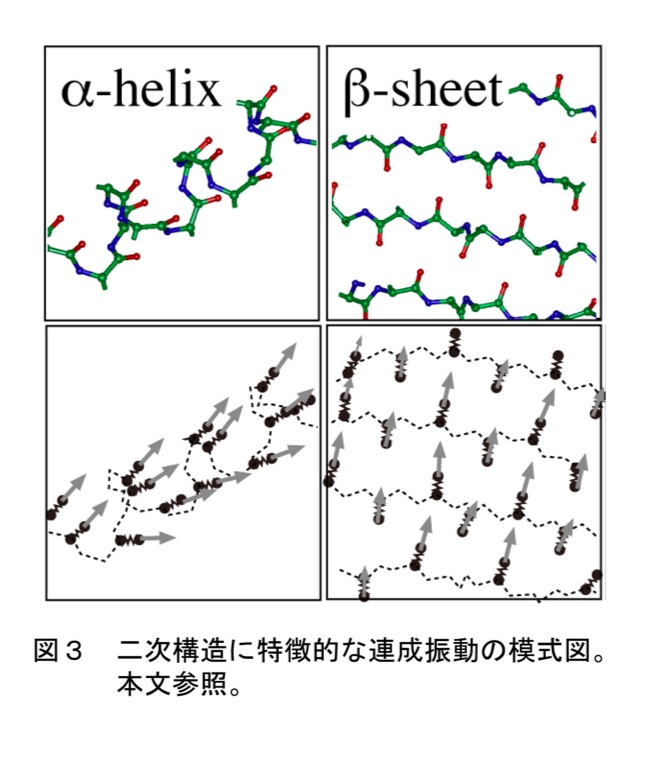
タンパク質には複数のアミドI振動子が含まれる。水溶液中で一定の二次構造や三次構造を持つタンパク質の場合、振動子同士の位置関係も固定される。このような場合には個々の振動子の運動は独立ではありえず、静電的相互作用により連成振動となる。静電相互作用は振動子間の距離と配向の関数であるため、各二次構造中での振動子の配置が異なることに対応して、異なるタイプの連成振動が生じる。赤外吸収強度が特に大きいのは連成振動に関わる振動子が同じ方向に分極を作る場合であり、そのようなバンドの振動数が二次構造毎に異なることが、赤外スペクトルが二次構造解析に利用される所以である。αヘリックスとβシートの場合の連成振動の様子を図3に示した。αヘリックスの場合は全ての振動子がヘリックス長軸に沿って同じ位相で振動するモードが1640-1660 cm-1領域に大きな強度を持ち、βシートの場合は「隣の振動子との位相差がπ、水素結合相手の振動子との位相差がゼロ」であるような振動が1620-1640 cm-1領域で大きな強度を持つと期待される。ランダムコイルの場合、主鎖構造が時間変化することに対応して、振動子間の相互作用の仕方は一定ではない。そのためランダムコイルの場合“特徴的な連成振動”は見られず、孤立振動子と同じく1640-1660cm-1領域に振動バンドが現れる。
アミドIバンドの振動数と二次構造の対応はおよそ表1の通りである。この対応関係を二次構造の帰属の目安とする。適用の際の注意点に関しては2-4で述べる。αヘリックスの振動のうち最大の強度を持つバンドは連成振動の結果現れたモードに帰属されるものであるが、ランダムコイルと同じ領域に現れる。そのためアミドIバンドの振動数だけからはこれらを区別することが出来ない。アミドIバンドに加えて、ペプチド主鎖の振動モードに帰属されるアミドII (1500-1560 cm-1)あるいは アミドIII (1220-1280 cm-1))バンドの振動数(形状)まで考慮することで区別が可能である(1)。
アミドI領域(1600-1700 cm-1)には、主鎖カルボニル基の振動バンドの他に、アミノ酸側鎖の振動に帰属されるバンドが現れる(5)。中でもAsnやGlnの側鎖のC=O伸縮振動バンドの強度は大きい。これらの残基が多く含まれる場合、側鎖に帰属すべきバンドが現れるはずである。逆にこれらの残基の含有率が低い場合これらの側鎖のバンドの寄与は無視しうる。>1700cm-1に現れるCOOH基のバンドは、側鎖プロトン化状態のマーカーとして有用である。
2-2 手順
赤外スペクトルのフィッティング解析を行う際、用いるバンドの数を適切に選ぶことが重要である。原理的にはアミドIに帰属すべきバンドの数は全残基数-1(C末端の残基はアミド結合を持たない)まで増やすことが出来るが、フィッティング結果の一意性が低下する。測定結果を再現するために必要最少限の数のバンドを用いるべきである。
解析においては、実測赤外スペクトルだけでなく、その二次微分波形を再現することを目指す。二次微分波形には凹凸が強調されて現れるため、実測赤外スペクトルでは目立たない特徴を発見するのに役立つ。
○手順その1:二次微分スペクトル計算 赤外スペクトルの測定が終わったら、赤外スペクトルの二次微分を求める。二次微分スペクトルにノイズが目立つ場合は、赤外スペクトルを平滑化し、再度二次微分スペクトルを計算する。二次微分計算および平滑化は、測定プログラムの解析機能や各種数値解析ソフトウェアを利用して行う(参考までに、筆者らはIgor ProでSavitzky-Golay法を用い平滑化を行うことが多い)。
データの平滑化処理を行ってもなおノイズが目立つ場合は、測定をやり直す。
アミドIバンドの解析はバンド分解から始まる。実測赤外スペクトルおよび二次微分波形が再現するよう、適切な数のバンドを用いてフィッティングを行う。フィッティング解析のためのバンド形状を表す関数として
Gauss関数 f(x) = A・π-1/2・exp ((x-ω)2 / Γ2)
Lorentz関数 f(x) = A・π-1・Γ / {(x-ω)2 + Γ2}
などがよく用いられる。ここでAは面積、Γはバンド幅、ωは振動数とした。これらの他、Voigt関数(Gauss関数とLorentz関数の畳み込み)あるいはGauss-Lorentz混合関数なども用いられる。
○手順その2:フィッティング解析の初期値の設定 二次微分スペクトルの負のピーク(谷)の数だけバンドが存在するとし、関数の形状を決めるパラメータ、すなわち面積Aおよび振動数ωを適当に設定する。幅Γは典型的な値として7-15cm-1程度とする。
○手順その3:フィッティング解析 最小二乗法により各バンドの面積・幅・位置を決定する。選んだフィッティングパラメータが、赤外スペクトルとその二次微分波形を同時に再現するかどうかを確認する。両者が同時に再現しない場合は、用いるバンドの数を増やして再度フィッティングを試みる。二次微分波形の再現結果を大きく変化させることなく実測スペクトル再現結果の面積を増減する方法(「工夫とコツ」参照)を参考にして、実測値と二次微分波形の両方が同時によく再現できるまで根気よく解析を行うことが重要である。
上記の手順により実測スペクトルが再現できたら、バンドの帰属を行う。二次構造の種類および残基数に関する情報を得るために個々のバンドの振動数と面積強度を利用する。
○手順その4:帰属 2-1で示した対応をもとにして、フィッティング解析に用いた個々のバンドをいずれかの二次構造に帰属する。側鎖のバンドに帰属すべき場合があることに注意する。
○手順その5:二次構造含有率計算 アミドIバンド全面積(アミドIバンドに帰属されたバンドの面積強度の総和)に対する個々のバンド面積の割合から、二次構造含有率を求める。
2-3 実例(6)
水溶性タンパク質β2-ミクログロブリンの部分配列ペプチド(21NFLNCYVSGFH31、11残基)のアミロイド線維の構造解析の例を示す。図4(a)に、実測した赤外スペクトル(上)、および、手順その1に従い求めた二次微分波形(下)を示す。
手順その2に従い、負のピークの波数を求めた(1630 cm-1、1668 cm-1)。
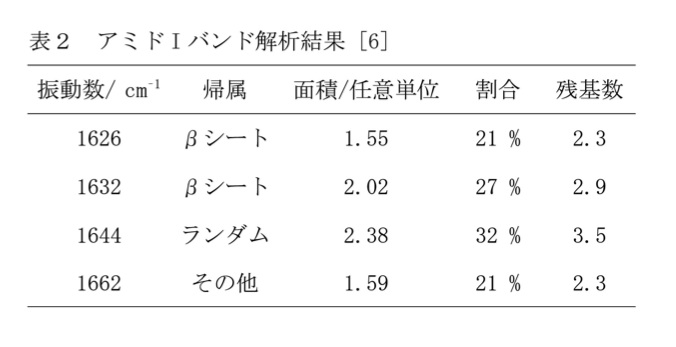
手順その3に従い、2本のピークを用いてフィッティングを行った。二次微分波形はよく再現したが(図4(b、下))、赤外スペクトルは全く合わない(図4(b、上))。1668 cm-1バンドの近傍に2本のバンドを追加した結果(図4(c))は未だ不十分であったため、さらに1630 cm-1のバンドの近傍に2本のバンドを追加した(図4(d))。図4(b-d) でバンドの数を増やした際、二次微分波形の再現結果は大きく変化しないが、実測スペクトルの再現結果が徐々に改善する様子が分かる。アミドII領域およびアミドI,IIバンドの中間(1590-1610 cm-1)にもバンドがあるものとして最小二乗法フィッティングを行い、実測スペクトル(図5(a))およびその二次微分波形(図5(a’))をよく再現する結果を得た(図5(b,b’))。用いたバンドのうちアミドIに帰属すべきものを図中に細線で示した。得られた振動数および面積を表2に示す。
手順その4、5に示した方法により、二次構造に関する情報を得た(表2)。すなわち、表1に示した分類を基準として振動数から帰属を求め、面積の総和に対する各バンドの割合から残基数の割当を行った。この試料の円偏光二色性の測定により、αヘリックス含有率が低いことが分かったため、1644cm-1のバンドをランダムコイルに帰属した。
適切でない解析結果の例を図5(c)に示す。Γ= 33cm-1のバンドを1652cm-1におくことで、実測値(図5(a))が再現できるように見える。しかし二次微分スペクトル(それぞれ図5(a’)および(c’))を比較すると、実測スペクトルに見られる1655および1668 cm-1の凹凸を再現していないことが目立つようになる。この点において図5(b)の結果の方がより適切である。
2-4 注意点
本稿で解説した二次構造解析においては以下の仮定がなされている。
- 各二次構造のアミドIバンドは、例外なく所定の波数領域に現れる。
- 各二次構造においてモル吸光係数は同じ値を取る。
これらの仮定は絶対的に成り立つものではない(7)。第1の点に関して、βシートのバンドの振動数にストランド数依存性があること(8)、水との水素結合を有するαヘリックスではバンドが低波数に出ること(9)、などの要因による例外が知られている。また第2の点に関して、同一ポリペプチドのアミドIバンドの面積が、二次構造に応じて変化するという報告がある(10)。この依存性を考慮することで二次構造解析の結果は変化する。判定基準の境界領域にバンドが存在する場合は、帰属の仕方によっても二次構造解析結果が変化する。したがって、赤外スペクトルを用いた二次構造解析法を利用する際には、これらの誤差要因を念頭に置き、見込まれる誤差の程度を評価する必要がある。赤外スペクトルの解析から得た二次構造含有率はX線結晶構造解析の結果と数%の誤差で一致したという報告があるが(11)、場合によってはもう少し大きい誤差が見込まれる場合もあるはずである。二次構造解析においてより確からしい結論を導くためには、赤外スペクトルからすべてを結論するのではなく、円偏光二色性測定など、原理の異なる他の実験法と合わせて考察を行うのがよいであろう。
工夫とコツ
1. ベースライン補正
タンパク質(溶質)の体積分の溶媒分子が光路から除外され、溶媒のバンド強度が減少することに由来して、赤外スペクトルに凹みや負のピークが現れる場合がある。OH(OD)伸縮振動の減少が埋め戻されるように「溶媒のスペクトル」の加減を行うことで補償する。
2. セル窓板の撥水加工
測定セルの窓板間隔を10μm以下にすると水溶液試料の交換が容易でなくなることが多い。すなわち、試料入れ替え時に少量の溶液がセル中に残り、これを取り除くことが困難である。試料溶液の残存を減らすための一つの方法は、窓板表面の撥水性を上げることである。筆者らは、CaF2窓板表面の撥水性を高めるためにごく少量のシリコーングリース(ダウコーニング FS高真空用グリース など)を薄く塗布し、溶液試料の入れ替えをスムーズに行っている。
3. フィッティング解析でのバンド本数の増やし方
二次微分波形(図6下段、太実線と点線)は似ていても、吸収スペクトル波形は大きく異なる場合がある(図6上段、太実線と点線)。点線の波形は太実線と細実線の(合計3本の)バンド波形の和である。この図から分かるように、1本目のバンドの両脇に同じ大きさのバンドを1本ずつ置くと、二次微分波形のピーク波数での値を変化させることなく吸収スペクトル波形を変化させることが出来る。
4. 数値解析ソフト
筆者らはデータ解析にIgor Proを使用している。ソフトウェアに備え付けの関数の他、使用者が定義した関数をフィッティング解析に用いることが出来る点で赤外スペクトルの波形解析に重宝している。平滑化や二次微分波形の計算などもsmooth, differentiateなどのコマンドを用いて容易に行うことが出来る。試用版についてはWavemetrics社のウェブサイト(www.wavemetrics.com)から英語版を、HULINKS社のウェブサイト(www.hulinks.co.jp)から日本語版を、それぞれ取得できる。
文献
- J. Bandekar, Biochim. Biophys. Acta 1120, 123-143 (1992); および引用文献
- 田隅三生編著、FT-IRの基礎と実際 第2版 東京化学同人 (1994)
- 日本化学会編、実験化学講座<9> 物質の構造(1)-分光(上)、丸善 (2005)
- 井上悟、分光研究 45, 197-202 (1996).
- A. Barth and C. Zscherp, Quarterly Rev. Biophys. 35, 369-430 (2002).
- H. Hiramatsu et al., J. Am. Chem. Soc. 126, 3008-3009 (2004).
- W. K. Surewicz et al., Biochemistry, 32, 389-394 (1993).
- J. Kubelka and T.A.Keiderling, J. Am. Chem. Soc. 123, 12048-12058 (2001).
- E. S. Manas et al., J. Am. Chem. Soc. 122, 9883-9890 (2000).
- M. Jackson et al., Biochim. Biophys. Acta 998, 75-59 (1989).
- A. Dong et al., Biochemistry, 29, 3303-3308 (1990).
概要
本稿では、赤外吸収スペクトルに現れるC=O伸縮振動(アミドI)バンドの解析に基づく、タンパク質の二次構造解析を行うための手順および注意すべき点を具体例とともに解説する。この方法により、円偏光二色性、X線結晶構造解析あるいはNMR法などの各種構造解析手法と矛盾しない結果が得られることが知られている。
赤外吸収分光法がもたらす情報には原子座標決定の精度が必ずしもあるわけではない。しかしながら赤外吸収分光に求められる試料準備の要求が少ないことから、利用範囲は幅広い。タンパク質のフォールディング問題、あるいは生理活性と分子構造の関連の解析など、様々な問題において、二次構造(変化)の解明が十分本質的な価値を持つ場合がある。本稿で紹介する手法は、そのような問題に対して有用な情報をもたらすであろう。
イントロダクション
赤外吸収分光法は構造化学において強力な実験手法である。等核二原子分子以外は全て何らかの赤外吸収を示すことから、適用範囲は幅広い。
この手法を生体分子に応用する場合、振動スペクトル解析のための厳密な理論を正確に適用することは現実問題として容易ではない。これは、n個の原子からなる非直線分子の基準振動が3n-6だけ存在すること、そのためnが大きくなった場合、赤外吸収スペクトル(以下では赤外スペクトルと略記する)上で各振動バンドを十分に分離した形で検出することが困難であるということによる。この原因は「強度が弱い場合があること」「バンド幅の範囲内に多数のバンドが密集して現れること」などである。
タンパク質の赤外スペクトルには、ペプチド主鎖カルボニル基の振動に帰属される強い吸収バンド(アミドIバンド)が現れる。このバンドの振動数はペプチド主鎖の二次構造の種類によって異なる。この対応関係は、アミドI振動子の連成振動を考慮した近似的な取り扱いにより、良く説明される。この関係を利用してスペクトル形状からタンパク質二次構造解析を行う方法が提案されてきた(1)。本稿ではこの解析の仕方を解説する。赤外吸収分光法の基礎および測定原理に関しては各種文献を参照されたい(2,3)。
装置・器具
測定装置・器具:赤外吸収分光計
透過型セル 温度調節可能であることが望ましい
数値解析ソフトウェア(例えばIgor Pro, Wavemetrics社)
手順
1)サンプル調製と測定
2)二次構造解析
詳細
1)サンプル調製と測定
タンパク質研究においては、多くの場合水溶液中での構造が興味の対象である。ところが赤外スペクトルにおいては、H2OのHOH変角振動が1640 cm-1付近に現れてアミドIバンドの測定の大きな妨害となる(図1(a))。H2Oに溶解したタンパク質の赤外スペクトルを高い信号雑音(S/N)比で測定するためには、まず試料セルの光路長を薄く(< 10μm)し、透過光の強度を確保する必要がある。さらに、吸光度を求めるための2種類の測定すなわち「溶媒のみを光路においたときの透過光強度 = I0」「タンパク質溶液を光路においたときの透過光強度 = I」を行うときに、光路長を厳密に一定にする必要がある。光路長が1%変化すると光路上のH2O分子の数が1%変化するが、その結果生じるHOH変角振動バンド強度の1%の変化が、タンパク質のアミドIバンドの形状を正確に記録する上で問題となりうるためである。この問題に関しては、Biocell (Biotools社)などの光路長固定セルを用いると便利である。液体試料用フローセルも利用可能であるが、経験上、光路長が10μm未満になると水溶液試料の入れ替えには工夫を要する(工夫とコツ参照)。また、HOH変角振動バンド形状は温度に依存して変化するため、温度調節(恒温設定)が可能なセルを使用するのが望ましい。
取り扱いの容易さから、窓板にCaF2あるいはBaF2を用いることが多い(4)。透過波数下限はMCT(Mercury-Cadmium-Telluride)検出器の感度下限と同程度である。
筆者らが実際に使用している液体試料セルおよびセルホルダーを図2に示す。図2(上)に示すように、セルホルダーにチューブをハンダ付けして恒温槽からの流水を流すことで試料温度の制御を行っている。図2(下)に示すように、液体試料セルは固定金具(a,a’)、2枚のCaF2窓板(b,b’)、スペーサーからなる。固定金具aおよび窓板bには液体試料を出し入れするための穴がある。厚さが既知のフィルムをスペーサーに用いると窓板間隔の調節がしやすい。我々はポリエチレンテレフタレートフィルム(東レ「ルミラー」)やPTFEシート(ニチアス「ナフロン」)などを適当な形に切り出して用いている。空セルのスペクトルに現れる干渉縞から窓板間隔を求める方法もある。
H2Oバンドの妨害を回避する別な方法として、溶媒に重水(D2O)を使用することが有効である。重水を用いることでHOH変角振動バンド(~1640 cm-1)は消失し、代わりにDOD変角振動バンド(~1200cm-1)が現れる(図1(b))。そのためアミドI領域の測定が非常に容易になる。D2Oを用いた測定試料にごく少量のH2Oが残存すると、HOD由来のバンドが~1450 cm-1に現れ、ベースラインの傾きの原因になる(図1(b))。そのため測定に先立ち、試料(タンパク質やリン酸など試料溶液中に含まれる分子すべて)をそれぞれ重水に溶解し凍結乾燥を行うことでH/D(水素/重水素)交換を行っておく必要がある。αヘリックスやβシートなどの安定構造に含まれる残基においてH/D交換速度が遅い場合は「重水に溶解して凍結乾燥」という作業を何度か繰り返すとよい。
試料濃度はまず1 mg/mL程度として測定を行う。セル間隔によって観測される吸光度は異なるが、A~0.01程度のアミドIバンドが観測されれば、積算によるS/N比改善で十分解析に耐えるスペクトルが得られるであろう。濃度条件に制約がある場合はセル間隔を調節して信号強度を確保する。
二次構造解析を行う場合、スペクトル測定は透過法で行う。全反射吸収測定(ATR)法を用いる場合、赤外光の潜り込み深さ(penetration depth)が波長に依存するため、測定結果は透過法と一致しない。
透過法で測定した赤外スペクトルを図1(c,d)に示す。それぞれはH2O中およびD2O中で測定した同じ試料のスペクトルである。図1(c)において、アミドIバンドが1600-1700 cm-1に、アミドIIバンドが1500-1560 cm-1に見られる。アミドIバンド(主にC=O伸縮振動)の振動モードには主鎖N-Hの運動がほとんど含まれていないため、重水素溶媒中でもバンド形状の変化はほとんど見られない。これに対し、アミドIIバンド(主にC-N伸縮振動およびN-H変角振動)の振動モードには主鎖N-Hの運動が含まれるため、N-H変角がN-D変角に変化することで振動数が変化する。そのため重水中ではアミドIIの振動形は大きく変化する。1454 cm-1にN-D伸縮振動が現れることは(図1(d))、重水中ではN-D変角振動とC-N伸縮振動がもはやカップリングしていないことを示す。図1(d)のアミドII領域に見られるのはGlu, AspおよびC末端のCOO-逆対称伸縮振動バンドである。
フーリエ変換型分光計を用いて得られる赤外スペクトルには、用いるアポダイゼーション関数の種類に応じて、本来は観測されるはずのない疑似ピークや負のピークが現れうる(2,3)。アミドIバンドの分解および面積の比較を行う上で、疑似ピークや負のピークの出現は誤った解析結果をもたらすため問題である。筆者らはアポダイゼーション関数にHapp-Genzel関数を用いている。
2)二次構造解析
2-1 基礎知識
タンパク質には複数のアミドI振動子が含まれる。水溶液中で一定の二次構造や三次構造を持つタンパク質の場合、振動子同士の位置関係も固定される。このような場合には個々の振動子の運動は独立ではありえず、静電的相互作用により連成振動となる。静電相互作用は振動子間の距離と配向の関数であるため、各二次構造中での振動子の配置が異なることに対応して、異なるタイプの連成振動が生じる。赤外吸収強度が特に大きいのは連成振動に関わる振動子が同じ方向に分極を作る場合であり、そのようなバンドの振動数が二次構造毎に異なることが、赤外スペクトルが二次構造解析に利用される所以である。αヘリックスとβシートの場合の連成振動の様子を図3に示した。αヘリックスの場合は全ての振動子がヘリックス長軸に沿って同じ位相で振動するモードが1640-1660 cm-1領域に大きな強度を持ち、βシートの場合は「隣の振動子との位相差がπ、水素結合相手の振動子との位相差がゼロ」であるような振動が1620-1640 cm-1領域で大きな強度を持つと期待される。ランダムコイルの場合、主鎖構造が時間変化することに対応して、振動子間の相互作用の仕方は一定ではない。そのためランダムコイルの場合“特徴的な連成振動”は見られず、孤立振動子と同じく1640-1660cm-1領域に振動バンドが現れる。
アミドIバンドの振動数と二次構造の対応はおよそ表1の通りである。この対応関係を二次構造の帰属の目安とする。適用の際の注意点に関しては2-4で述べる。αヘリックスの振動のうち最大の強度を持つバンドは連成振動の結果現れたモードに帰属されるものであるが、ランダムコイルと同じ領域に現れる。そのためアミドIバンドの振動数だけからはこれらを区別することが出来ない。アミドIバンドに加えて、ペプチド主鎖の振動モードに帰属されるアミドII (1500-1560 cm-1)あるいは アミドIII (1220-1280 cm-1))バンドの振動数(形状)まで考慮することで区別が可能である(1)。
アミドI領域(1600-1700 cm-1)には、主鎖カルボニル基の振動バンドの他に、アミノ酸側鎖の振動に帰属されるバンドが現れる(5)。中でもAsnやGlnの側鎖のC=O伸縮振動バンドの強度は大きい。これらの残基が多く含まれる場合、側鎖に帰属すべきバンドが現れるはずである。逆にこれらの残基の含有率が低い場合これらの側鎖のバンドの寄与は無視しうる。>1700cm-1に現れるCOOH基のバンドは、側鎖プロトン化状態のマーカーとして有用である。
2-2 手順
赤外スペクトルのフィッティング解析を行う際、用いるバンドの数を適切に選ぶことが重要である。原理的にはアミドIに帰属すべきバンドの数は全残基数-1(C末端の残基はアミド結合を持たない)まで増やすことが出来るが、フィッティング結果の一意性が低下する。測定結果を再現するために必要最少限の数のバンドを用いるべきである。
解析においては、実測赤外スペクトルだけでなく、その二次微分波形を再現することを目指す。二次微分波形には凹凸が強調されて現れるため、実測赤外スペクトルでは目立たない特徴を発見するのに役立つ。
○手順その1:二次微分スペクトル計算 赤外スペクトルの測定が終わったら、赤外スペクトルの二次微分を求める。二次微分スペクトルにノイズが目立つ場合は、赤外スペクトルを平滑化し、再度二次微分スペクトルを計算する。二次微分計算および平滑化は、測定プログラムの解析機能や各種数値解析ソフトウェアを利用して行う(参考までに、筆者らはIgor ProでSavitzky-Golay法を用い平滑化を行うことが多い)。
データの平滑化処理を行ってもなおノイズが目立つ場合は、測定をやり直す。
アミドIバンドの解析はバンド分解から始まる。実測赤外スペクトルおよび二次微分波形が再現するよう、適切な数のバンドを用いてフィッティングを行う。フィッティング解析のためのバンド形状を表す関数として
Gauss関数 f(x) = A・π-1/2・exp ((x-ω)2 / Γ2)
Lorentz関数 f(x) = A・π-1・Γ / {(x-ω)2 + Γ2}
などがよく用いられる。ここでAは面積、Γはバンド幅、ωは振動数とした。これらの他、Voigt関数(Gauss関数とLorentz関数の畳み込み)あるいはGauss-Lorentz混合関数なども用いられる。
○手順その2:フィッティング解析の初期値の設定 二次微分スペクトルの負のピーク(谷)の数だけバンドが存在するとし、関数の形状を決めるパラメータ、すなわち面積Aおよび振動数ωを適当に設定する。幅Γは典型的な値として7-15cm-1程度とする。
○手順その3:フィッティング解析 最小二乗法により各バンドの面積・幅・位置を決定する。選んだフィッティングパラメータが、赤外スペクトルとその二次微分波形を同時に再現するかどうかを確認する。両者が同時に再現しない場合は、用いるバンドの数を増やして再度フィッティングを試みる。二次微分波形の再現結果を大きく変化させることなく実測スペクトル再現結果の面積を増減する方法(「工夫とコツ」参照)を参考にして、実測値と二次微分波形の両方が同時によく再現できるまで根気よく解析を行うことが重要である。
上記の手順により実測スペクトルが再現できたら、バンドの帰属を行う。二次構造の種類および残基数に関する情報を得るために個々のバンドの振動数と面積強度を利用する。
○手順その4:帰属 2-1で示した対応をもとにして、フィッティング解析に用いた個々のバンドをいずれかの二次構造に帰属する。側鎖のバンドに帰属すべき場合があることに注意する。
○手順その5:二次構造含有率計算 アミドIバンド全面積(アミドIバンドに帰属されたバンドの面積強度の総和)に対する個々のバンド面積の割合から、二次構造含有率を求める。
2-3 実例(6)
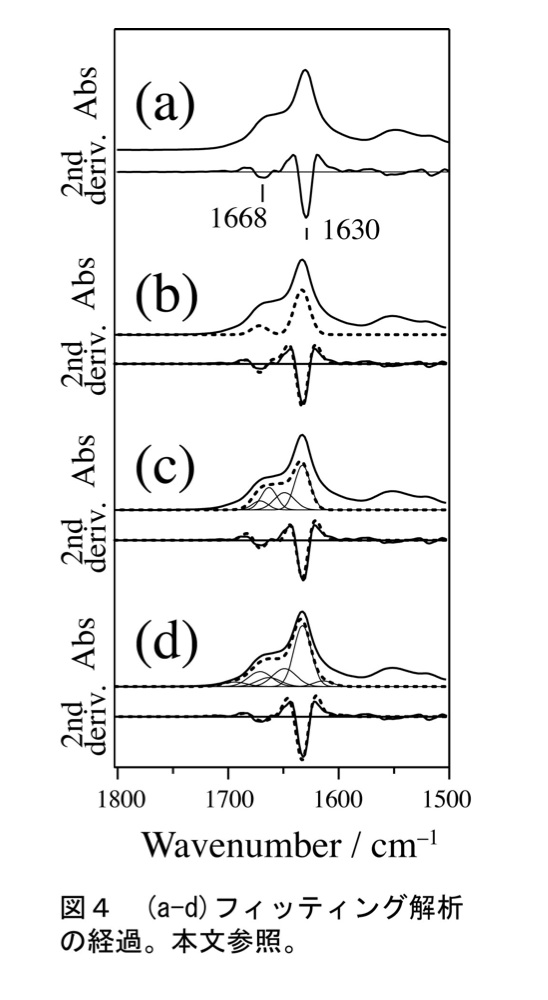
水溶性タンパク質β2-ミクログロブリンの部分配列ペプチド(21NFLNCYVSGFH31、11残基)のアミロイド線維の構造解析の例を示す。図4(a)に、実測した赤外スペクトル(上)、および、手順その1に従い求めた二次微分波形(下)を示す。
手順その2に従い、負のピークの波数を求めた(1630 cm-1、1668 cm-1)。
手順その3に従い、2本のピークを用いてフィッティングを行った。二次微分波形はよく再現したが(図4(b、下))、赤外スペクトルは全く合わない(図4(b、上))。1668 cm-1バンドの近傍に2本のバンドを追加した結果(図4(c))は未だ不十分であったため、さらに1630 cm-1のバンドの近傍に2本のバンドを追加した(図4(d))。図4(b-d) でバンドの数を増やした際、二次微分波形の再現結果は大きく変化しないが、実測スペクトルの再現結果が徐々に改善する様子が分かる。アミドII領域およびアミドI,IIバンドの中間(1590-1610 cm-1)にもバンドがあるものとして最小二乗法フィッティングを行い、実測スペクトル(図5(a))およびその二次微分波形(図5(a’))をよく再現する結果を得た(図5(b,b’))。用いたバンドのうちアミドIに帰属すべきものを図中に細線で示した。得られた振動数および面積を表2に示す。
手順その4、5に示した方法により、二次構造に関する情報を得た(表2)。すなわち、表1に示した分類を基準として振動数から帰属を求め、面積の総和に対する各バンドの割合から残基数の割当を行った。この試料の円偏光二色性の測定により、αヘリックス含有率が低いことが分かったため、1644cm-1のバンドをランダムコイルに帰属した。
適切でない解析結果の例を図5(c)に示す。Γ= 33cm-1のバンドを1652cm-1におくことで、実測値(図5(a))が再現できるように見える。しかし二次微分スペクトル(それぞれ図5(a’)および(c’))を比較すると、実測スペクトルに見られる1655および1668 cm-1の凹凸を再現していないことが目立つようになる。この点において図5(b)の結果の方がより適切である。
2-4 注意点
本稿で解説した二次構造解析においては以下の仮定がなされている。
- 各二次構造のアミドIバンドは、例外なく所定の波数領域に現れる。
- 各二次構造においてモル吸光係数は同じ値を取る。
これらの仮定は絶対的に成り立つものではない(7)。第1の点に関して、βシートのバンドの振動数にストランド数依存性があること(8)、水との水素結合を有するαヘリックスではバンドが低波数に出ること(9)、などの要因による例外が知られている。また第2の点に関して、同一ポリペプチドのアミドIバンドの面積が、二次構造に応じて変化するという報告がある(10)。この依存性を考慮することで二次構造解析の結果は変化する。判定基準の境界領域にバンドが存在する場合は、帰属の仕方によっても二次構造解析結果が変化する。したがって、赤外スペクトルを用いた二次構造解析法を利用する際には、これらの誤差要因を念頭に置き、見込まれる誤差の程度を評価する必要がある。赤外スペクトルの解析から得た二次構造含有率はX線結晶構造解析の結果と数%の誤差で一致したという報告があるが(11)、場合によってはもう少し大きい誤差が見込まれる場合もあるはずである。二次構造解析においてより確からしい結論を導くためには、赤外スペクトルからすべてを結論するのではなく、円偏光二色性測定など、原理の異なる他の実験法と合わせて考察を行うのがよいであろう。
工夫とコツ
1. ベースライン補正
タンパク質(溶質)の体積分の溶媒分子が光路から除外され、溶媒のバンド強度が減少することに由来して、赤外スペクトルに凹みや負のピークが現れる場合がある。OH(OD)伸縮振動の減少が埋め戻されるように「溶媒のスペクトル」の加減を行うことで補償する。
2. セル窓板の撥水加工
測定セルの窓板間隔を10μm以下にすると水溶液試料の交換が容易でなくなることが多い。すなわち、試料入れ替え時に少量の溶液がセル中に残り、これを取り除くことが困難である。試料溶液の残存を減らすための一つの方法は、窓板表面の撥水性を上げることである。筆者らは、CaF2窓板表面の撥水性を高めるためにごく少量のシリコーングリース(ダウコーニング FS高真空用グリース など)を薄く塗布し、溶液試料の入れ替えをスムーズに行っている。
3. フィッティング解析でのバンド本数の増やし方
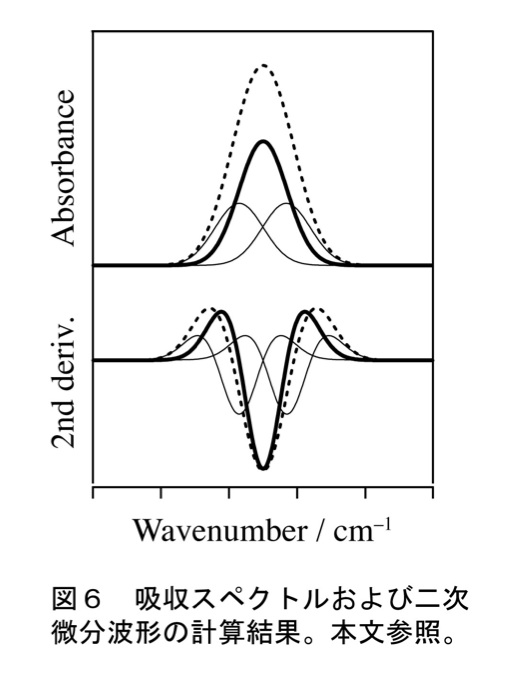
二次微分波形(図6下段、太実線と点線)は似ていても、吸収スペクトル波形は大きく異なる場合がある(図6上段、太実線と点線)。点線の波形は太実線と細実線の(合計3本の)バンド波形の和である。この図から分かるように、1本目のバンドの両脇に同じ大きさのバンドを1本ずつ置くと、二次微分波形のピーク波数での値を変化させることなく吸収スペクトル波形を変化させることが出来る。
4. 数値解析ソフト
筆者らはデータ解析にIgor Proを使用している。ソフトウェアに備え付けの関数の他、使用者が定義した関数をフィッティング解析に用いることが出来る点で赤外スペクトルの波形解析に重宝している。平滑化や二次微分波形の計算などもsmooth, differentiateなどのコマンドを用いて容易に行うことが出来る。試用版についてはWavemetrics社のウェブサイト(www.wavemetrics.com)から英語版を、HULINKS社のウェブサイト(www.hulinks.co.jp)から日本語版を、それぞれ取得できる。
文献
- J. Bandekar, Biochim. Biophys. Acta 1120, 123-143 (1992); および引用文献
- 田隅三生編著、FT-IRの基礎と実際 第2版 東京化学同人 (1994)
- 日本化学会編、実験化学講座<9> 物質の構造(1)-分光(上)、丸善 (2005)
- 井上悟、分光研究 45, 197-202 (1996).
- A. Barth and C. Zscherp, Quarterly Rev. Biophys. 35, 369-430 (2002).
- H. Hiramatsu et al., J. Am. Chem. Soc. 126, 3008-3009 (2004).
- W. K. Surewicz et al., Biochemistry, 32, 389-394 (1993).
- J. Kubelka and T.A.Keiderling, J. Am. Chem. Soc. 123, 12048-12058 (2001).
- E. S. Manas et al., J. Am. Chem. Soc. 122, 9883-9890 (2000).
- M. Jackson et al., Biochim. Biophys. Acta 998, 75-59 (1989).
- A. Dong et al., Biochemistry, 29, 3303-3308 (1990).