概要
等温滴定型熱量計(Isothermal Titration Calorimeter: ITC)は、一定温度下で滴定に伴う熱量変化を検出する装置で、主に分子間相互作用解析に用いられる。分子同士が結合する時に発生する微小な熱量変化を計測し、得られる滴定曲線から、結合比(\(n\))、結合定数(\(K_\mathrm{a}\))(または解離定数(\(K_\mathrm{d}\)))、結合のエンタルピー変化(\(\Delta H\))を求めることができる。さらに [1] 式から結合の Gibbs 自由エネルギー変化(\(\Delta G\))が求まり、[2] 式から結合のエントロピー変化(\(\Delta S\))を算出できる。
\[ \Delta G = -\mathrm{R} T \ln K_\mathrm{a} \tag*{[1]} \]
\[ \Delta G = \Delta H - T \Delta S \tag*{[2]} \]
特筆すべき点としては、\(\Delta H\) を実験的に決定できることから、分子間相互作用の熱力学量を他の測定手法に比べて精度よく決定できること、また分子の化学的修飾を必要としないことなどがあげられる。
装置・器具・試薬
等温滴定型熱量計
高感度な等温滴定型熱量計として、Malvern Panalytical 社や TA Instruments 社の装置が知られている。著者は Malvern Panalytical 社装置1)(図1)のユーザーでもあり、本稿では同装置の使用経験に基づき、執筆させていただく。なお同社の現時点での最新機種は PEAQ-ITC(初回リリース2015年)で、これまでの iTC200(初回リリース2007年)、VP-ITC(初回リリース1999年)、MCS-ITC(初回リリース1994年)などから、高感度化、操作性やソフトウェアの向上などが進んでいるが、実験プロトコルとしては共通部分が多い。
実験手順
- 測定試料の準備
- 試料の濃度決定
- 測定試料の脱気
- ITC 測定
- データ解析と装置の保守
実験の詳細
1. 測定試料の準備
ITC 測定にあたり、装置の滴定シリンジとサンプルセルそれぞれに、相互作用を解析する2種類の試料を充填する。表1には1回の測定に必要な試料量をまとめる。ここには Malvern Panalytical 社(MicroCal社)装置の変遷をまとめたが、TA Instruments 社の最新機種 Affinity ITC も同等の性能を有する(シリンジ体積:50 μL、セル体積:190 μL)。試料濃度は、相互作用に伴う \(\Delta H\) に大きく依存するので、適当な濃度で一度測定を行い、得られるデータから最終的に判断することになる。また \(K_\mathrm{a}\) との関連では、\(\mathrm{c} = K_\mathrm{a} \, \mathrm{M_{tot}} \, n\)(\(\mathrm{M_{tot}}\):滴定前のサンプルセル中の試料濃度)で定義される \(\mathrm{c}\) 値が、\(1 \leqq \mathrm{c} \leqq 1000\)、理想的には \(5 \leqq \mathrm{c} \leqq 500\) となるよう、\(\mathrm{M_{tot}}\) を調製する。なお一般的には、\(\mathrm{M_{tot}}\) が数 μM から数十 μM となる。滴定曲線の形状は、図2に示すように、結合が弱い相互作用ほど、なだらかな曲線となる。一方、滴定シリンジ側の試料濃度は、滴定終了後に結合がほぼ飽和するように設定する。大体の目安として、結合比が 1 : 1 で \(K_\mathrm{a}\) が \(10^{6} \, \mathrm{M^{-1}}\) 以上の場合、滴定終了時点でシリンジ側試料の物質量がセル側試料の2~3倍程度となるように設定し、\(K_\mathrm{a}\) が \(10^{6} \, \mathrm{M^{-1}}\) より小さくなる系ほどその割合を高くする必要がある。なお Malvern Panalytical 社、TA Instruments 社、ともに専用ソフト上で、事前に試料濃度や \(K_\mathrm{a}\)(または \(K_\mathrm{d}\))、\(\Delta H\) から、滴定曲線をシミュレートすることができる。
表1.必要試料量
| ITC機種 | シリンジ体積 | シリンジ用調製量 | セル体積 | セル用調製量 |
|---|---|---|---|---|
| MCS-ITC | 100 or 250 μL | 400 or 600 μL | 1.3 – 1.4 mL | 2.0 mL |
| VP-ITC | 250 μL | 400 μL | 1.3 – 1.4 mL | 2.0 mL |
| iTC200 | 40 μL | 60 μL | 0.2 mL | 0.3 mL |
| PEAQ-ITC | 40 μL | 60 μL | 0.2 mL | 0.3 mL |
滴定シリンジとサンプルセルに入れる試料の溶媒は、できるだけ同一にする必要がある。ミスマッチがあると、目的とする反応熱なのか、溶媒の混合熱なのかの判別が難しくなる。そこで準備する2種類の試料について、透析法などにより、適当な同一溶媒に置換する。ただし試料の安定性などが懸念される場合、測定直前に溶媒を付加することで、両試料溶液の組成をできるだけ同一にすることもある。またバッファーの選択にあたっては、試料とバッファー間でのプロトン交換に伴う熱量が観測されうるので2)、2種類以上の溶媒中での測定が薦められる。
2. 試料の濃度決定
\(\Delta H\) などの熱力学量決定にあたり、試料の濃度が直接影響する。そこで試料の濃度決定にあたっては、吸光度計を用いるなどして、正確さを期す必要がある。また相互作用する2種類の試料のうち、一方の試料濃度のみ正確に決定でき、結合比も別法等により予測がつく場合などは、ITC 定により得られる結合比から補正する(例えば 1 : 1 に固定する)ことで、もう一方の試料濃度を決定することもできる。
3. 測定試料の脱気
MCS-ITC や VP-ITC を使う場合、サンプルセルに入れる試料の脱気を十分に行う必要がある。仮にセル内の溶液中に気泡が入った場合、検出データのノイズの原因となる。一方、iTC200 や PEAQ-ITC を使う場合、セル体積が小さく、脱気中の蒸発により試料濃度が変わる影響も考慮し、脱気ではなく、遠心して気泡を除く方法が推奨されている。いずれの装置でも、サンプルセルへの試料充填時、セル底面近くに充填用シリンジの先端を近づけ、気泡を入れないように留意する。
4. ITC 測定
ITC 装置を起動させ、測定温度を設定する。その他、各メーカー専用ソフトの指示に従い、各種パラメータを入力、設定する。セル側試料をサンプルセルに、シリンジ側試料を滴定シリンジに充填する。なおサンプルセルは断熱シールド内に固定されており、同セルへの注入口しか目視できない。そのためサンプルセルへの溶液の出し入れは、充填用シリンジでセルの底部がどこにあるかを探りながら行う。また表1記載のように、セルの実体積よりも多めの試料量を準備し、試料充填時にセルの注入口から試料が溢れることを確認することが薦められる。一方、リファレンスセルには、通常、超純水を充填する。また滴定シリンジ側の試料の充填は、VP-ITC 以降、装置付属ポンプを利用して、専用ソフト上での入力操作で、ほぼ自動化されている。なお滴定シリンジの先端はスクリュー型(iTC200 初期までは平ら)の形状で、その先端部分から試料を滴下する構造になっている。すなわち、回転しながら滴下することで、効率的に反応が平衡状態に達する設計である。
測定パラメータの設定について、以下に概要を記載する。滴定回数は、解析時に十分なデータ点を得るため、通常は10回以上にする(1回の滴定のみで、データのデコンボリューションから相互作用パラメータを得る方法もある)。各回の滴下量は、得られる熱量の程度を鑑み、設定する。滴定回数とあわせて、最終的な滴定総物質量と、サンプルセル側試料の物質量との量比を、前述のように考慮する必要がある。また各回の滴下量は、異なる値を設定することもできる。滴定シリンジの試料注入口近くの試料量が不正確であり、1回目の滴下量を少なめに設定して、データ解析時には、この1点を除外するのは一般的である。滴定間隔は、対象とする相互作用の平衡状態にいたる時間を考慮して設定する。通常の系であれば、MCS-ITC や VP-ITC で4分程度、iTC200 や PEAQ-ITC で2分程度となる。iTC200 や PEAQ-ITC では、サンプルセル体積が小さいため必要試料量が軽減され、さらに滴定後に平衡化するまでの時間が短縮された。
測定パラメータを設定し、試料を充填して、測定開始となるが、最新の PEAQ-ITC では、ベースラインの安定化も自動検出し、測定が始まる。iTC200 以前では、測定者が各ステップを確認しながら、測定開始を決定することもできる。測定開始後、自動的に測定温度での安定化、サンプルセルとリファレンスセルとの温度差の安定化、サンプルセルへのフィードバック電力の安定化が順次行われる。なおプロトコルからは逸脱するが、このフィードバック電力について少し概説する。Malvern Panalytical 社の ITC 装置は、サンプルセルとリファレンスセルとの温度差が常にゼロになるよう、サンプルセル表面の微小ヒータに一定の電力を供給する入力補償方式が採用されている3)。すなわち、サンプルセル内での分子間相互作用に伴い、発熱が生じるとフィードバック電力を減少させ、一方、吸熱反応の場合は増加させ、リファレンスセルとの温度差をゼロにしている。実際の測定生データは、このフィードバック電力の変化を検出しており、発熱反応では、見かけ上、負の向きへのピークが、吸熱反応では正の向きへのピークが観測される。
測定開始後、終了まで、データの取り込みなど自動的に行われるが、もし途中で測定条件(各回の滴下量や滴定回数など)を変更したい場合は、そのようなアップデートも可能であり、適宜リアルタイムで表示されるデータを見ながら検討する。
滴定シリンジで高濃度に存在する試料が、サンプルセル内で希釈されることに伴う熱量、希釈熱が、試料間の反応熱に加算される可能性がある。そこでこの希釈熱の寄与を補正するため、サンプルセル内に溶媒のみを充填させ、そこに滴定シリンジから、前述の滴定実験時と同一の試料を滴下する測定を行い、試料結合熱から希釈熱分を差し引きすることが薦められる。ただし稀にこの希釈熱以外の寄与が観測されることもあり、実際の測定の滴定終了前数回の滴定では、対象試料の結合熱が観測されない(理想的には希釈熱のみが観測される)程度まで過剰の試料を滴下することが薦められる。 生体分子間相互作用の熱力学量として、熱容量変化量(\(\Delta \, C_\mathrm{p}\))も重要な情報を与える。この \(\Delta \, C_\mathrm{p}\) を得るためには、同様の ITC 測定を異なる温度で行う必要がある。すなわち各温度で得られた \(\Delta H\) の温度依存性から、\(\Delta \, C_\mathrm{p}\) を算出することになる4)。
5. データ解析と装置の保守
ITC 測定結果の解析は、通常、データ解析ソフト Origin をベースにした Malvern Panalytical 社の解析ソフト上で行う。TA Instruments 社では、NanoAnalyze というソフトが、同社 HP からダウンロードでき、利用できる。いずれも最近のソフトはユーザーフレンドリーで、自動化が進んでいるが、ここでは敢えてマニュアルで行う使用法の概要を記載する。図3A のような生データを読み込むと、各滴定ピークが自動的に積分され、さらに溶媒に試料を滴下した実験データをリファレンスデータとして、試料同士の滴定データから引き算して、図3B のようなデータが得られる(積分範囲をマニュアルで指定することも可能)。ここで各試料濃度を入力し(測定時のパラメータとしても入力可能)、不要なデータ点(例えば前述のような1回目の滴定点)を削除する。次に 1 : 1 結合のようなモデル式を利用して、フィッティングを行う(図3B の実線カーブ)。このフィッティングから、前述のように、\(n\)、\(K_\mathrm{a}\)(または \(K_\mathrm{d}\))、\(\Delta H\) が決定される。なおモデル式としては、各結合部位が等価な場合や、非等価な場合のモデルが用意されている。図3では、HIV-1 のリボヌクレアーゼ H(RNH)と \(\ce{Mn^{2+}}\) との結合実験例で5)、1 : 1 結合モデルでのフィッティングを行い、結果として結合比(\(n\))も、ほぼ2となっている。このように結合比が直接的に決定できる点は ITC の一つの魅力であり、前述のように試料濃度の決定に逆利用できることや、試料の安定性の指標(例えば図3の実験系で、蛋白質試料の一部が変性していると、見かけ上の \(n\) の値は2より小さくなる)として用いることもできる。なお RNH は \(\ce{Mg^{2+}}\) で活性化する酵素で、\(\ce{Mg^{2+}}\) 結合は弱く、その結合比の議論も続いている。ITC の結果、\(\ce{Mn^{2+}}\) との結合比は2、\(\ce{Zn^{2+}}\) との結合比は1と示唆された5)。
測定終了後も装置を最適な状態で保持すべきことは言うまでもないが、特にサンプルセルが装置内に固定化され、内部を目視できないことからも、その保持は慎重かつ十分に行う必要がある。サンプルセルの洗浄は、装置に付属の道具を用いて、水や洗剤を流して行う。PEAQ-ITC の場合、洗剤は強アルカリ性界面活性剤 Decon90 を14%にして 5 mL 程度を流し、その後、50 mL 程度の水を流す。特にサンプルセルの汚れがひどく、測定データのベースラインが安定しないなどの症状がある場合には、14% Decon90 をサンプルセルに充填し、セルの温度を60℃にして30分放置する方法が、メーカーから推奨されている。以上の洗浄後、装置未使用時も、サンプルセルには超純水を充填しておく。さらにリファレンスセルも含めて、月に一度は超純水を交換することが薦められる。
以上、最新の ITC 装置は、付属の操作ソフト、解析ソフトともに、操作性に優れ、ある意味「誰でも使える」装置になっている。さらに MicroCal PEAQ-ITC Automated(Malvern Panalytical 社)や Affinity ITC Auto(TA Instruments 社)では、試料の充填から、サンプルセルや滴定シリンジの洗浄まで、完全自動化された装置も市販されている。なお ITC 測定のいくつかの実験例がまとめられた成書があるので、ITC 測定初心者も経験者も参考にされたい6)。
工夫とコツ
試料の溶媒や混在物に注意
試料調製にあたり、滴定する側、される側の溶媒は、同一にしなければならない。高濃度の試料を希釈して用いる場合も、そのストック溶液中にグリセロールや DMSO が混在する場合には注意を要する。水溶性の低い有機化合物の溶媒に DMSO を用いる場合、滴定試料溶媒の濃度として5%以下になるよう調製し、もう一方の試料の溶媒組成も同じになるよう調製する。一般的に有機溶媒の希釈熱は非常に大きいため、特に注意が必要である。また化合物を溶解すると溶液の pH が変わる場合もあり、最終試料としての溶媒や pH の変化に気を配る必要がある。
蛋白質試料の還元剤として DTT などが良く用いられるが、この酸化熱は大きく、DTT の状態にも依存するので、試料調製や解析時には注意を要する。また試料の安定性や実験目的によって、EDTA や \(\ce{Ca^{2+}}\) などを溶液中に混在させることがあるが、見たい試料以外に相互作用しうる分子が混在する場合も気をつけなければならない。「熱量変化が見えた!」と思ったら、実は単に EDTA によるキレート反応だった、という失敗談もある。
最新型の ITC では、前述のように試料の脱気も不要であるが、サンプルセルへの充填時など気泡を混在させない配慮は必要である。特に試料によっては、泡立ちやすいものもある。さらに滴定シリンジ側の試料との結合により、凝集が引き起こされる場合など、測定生データのノイズやドリフトの要因となる。
試料濃度
試料の濃度をどうするかは良く聞かれる質問だが、こればかりは結合に伴う熱量に依存し、一度測定してみないとわからないとしか答えられない。ただし注意すべき点として、熱量変化が一見判別できない場合にも、その分子同士が結合しないとは断じられない。一般的に弱い結合の場合(\(K_\mathrm{a}\) が \(10^{3} \, \mathrm{M^{-1}}\) 以下)、一般的に \(\Delta H\) が小さく、検出そのものが困難になる場合があり、必然的に試料濃度を高くする必要性が高くなる。なお ITC では、測定後の試料を回収できるので、その試料を他の実験などに有効利用することも可能である。
熱量変化が見えない、あるいは小さい場合の対応策として、試料濃度を変えるほかに、測定温度を変える手だてもある。すなわち分子間相互作用の \(\Delta C_{\mathrm{p}}\) が負の値の場合、温度を高くすると \(\Delta H\) は負に大きくなることが予想される。吸熱反応か発熱反応かで、その対応が異なるが、例えば小さな発熱反応をより大きく観測したい場合、測定温度を高くすると、より大きな熱量変化が観測されるはずである。またバッファーを変え、プロトネーションエンタルピーを付加することで、\(\Delta H\) の増大を期待する方法もある。
強いまたは弱い結合系での対応
強い結合の場合、\(K_\mathrm{a}\) が \(10^{8} \; \mathrm{M^{-1}}\) 程度までなら、解析データのフィッティングから直接 \(K_\mathrm{a}\) を精度よく求められる。一方、それ以上の強い結合の場合、\(n\) や \(\Delta H\) は精度よく決定できるものの、\(K_\mathrm{a}\) のフィッティングエラーは大きくなる。このような場合、別のアッセイ系で得られる \(K_\mathrm{a}\) を用いるやり方もあるが、競合分子存在下で ITC 測定を行う「displacement ITC」といった手法もある7)。一方、弱い結合の場合、対策として前述のように試料濃度を高くして実験するか、「displacement ITC」の逆利用として、より強く結合する分子との共存下と、同分子単独時との比較から、弱い結合の熱力学量を決定することができる8)。
酵素活性測定
本稿では主に分子間結合実験に焦点をおいて、そのプロトコルを記述したが、ITC を用いて酵素の活性測定を行うこともできる9)。すなわち滴定シリンジとサンプルセルいずれかに、酵素または基質を充填し、滴定後の基質の変化に伴う熱力学量を経時的に観測する。この場合、滴定前での酵素と基質との混合の影響をできるだけ抑えるため、滴定シリンジに基質を、サンプルセルに酵素を入れるような実験系が推奨される。一方、濃度調整の関係などで、滴定シリンジに酵素を入れる必要がある場合、滴定シリンジへの酵素の充填後、微量の溶媒を追加充填し、セルへの注入口付近からの漏出を抑える工夫もある。
文献
- Wiseman, T. et al., Anal. Biochem., 179, 131–137 (1989)
- Fukada, H. & Takahashi, K., Proteins, 33, 159–166 (1998)
- Buzzell, A. & Sturtevant, J. M., J. Am. Chem. Soc., 73, 2454–2458 (1951)
- Oda, M. et al., J. Mol. Biol., 276, 571–590 (1998)
- Oda, M. et al., J. Therm. Anal. Calorim., 135, 2647–2653 (2019)
- 熱量測定・熱分析ハンドブック 第3版.日本熱測定学会(編集)(2020)
- Velazquez-Campoy, A. & Freire, E., Nat. Protoc., 1, 186–191 (2006)
- Zhang, Y.-L. & Zhang, Z.-Y., Anal. Biochem., 261, 139–148 (1998)
- Karim, N. & Kidokoro, S., Netsu Sokutei, 33, 27–35 (2006)
改訂履歴
| 改訂日 | 改訂内容 | 改訂前の PDF |
|---|---|---|
| 2020-09-21 |
|
改訂前の PDF |
-
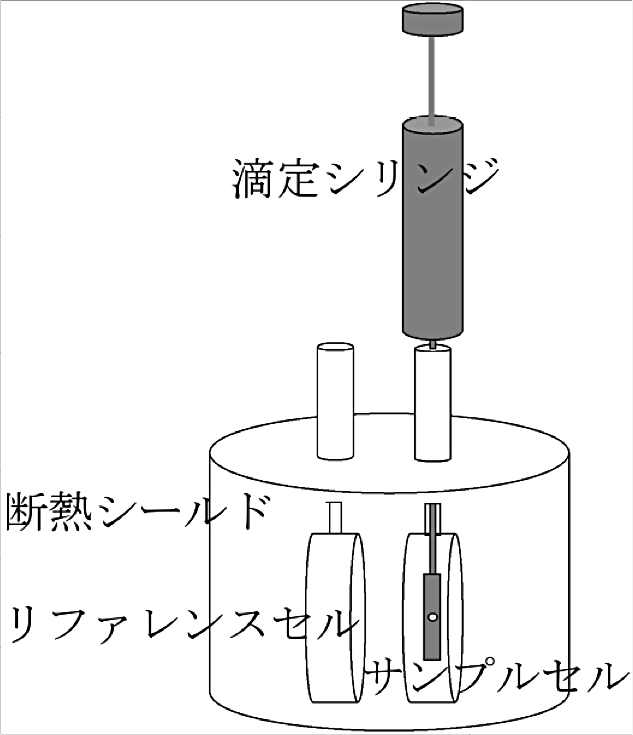
図1:ITC装置の概略 -
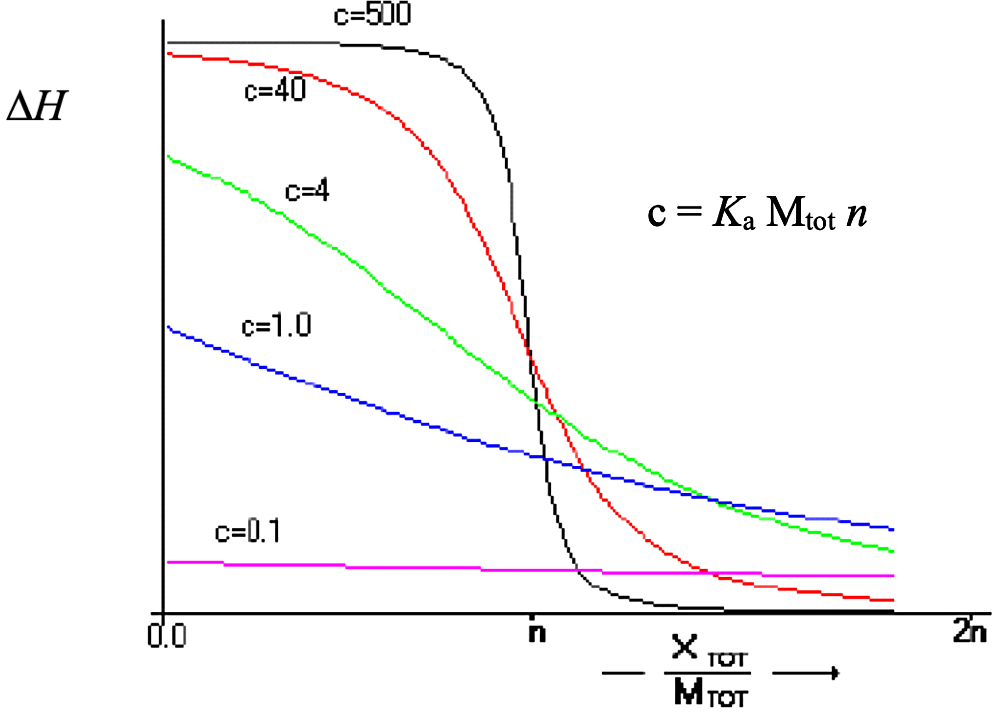
図2:各c値でのITC滴定曲線。\(\mathrm{X_{tot}} / \mathrm{M_{tot}}\):サンプルセル中に滴下された滴定シリンジからの試料濃度/滴定前のサンプルセル中の試料濃度(MicroCal ITCユーザーマニュアルより) -
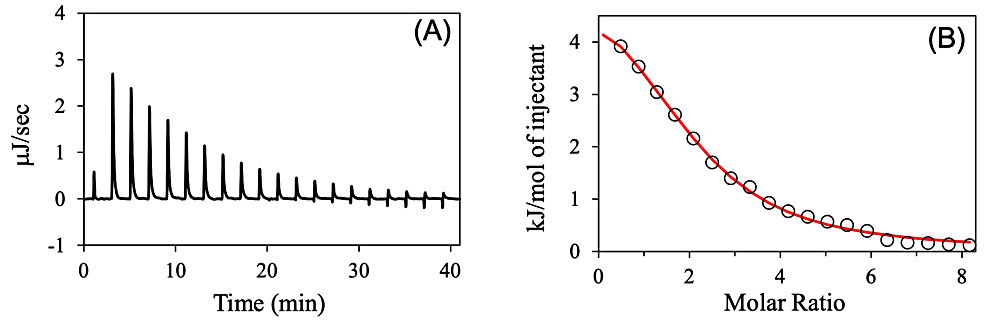
図3:ITCデータ(A)生データ、(B)解析データ。滴定シリンジに \(\ce{MnCl2}\)(4.0 mM)、サンプルセルにRNH(0.1 mM)を入れ、滴定実験を行った実験例。得られたパラメータは次の通り;\(n = 1.9\)、\(K_\mathrm{a} = 1.23 \times 10^{4} \, \mathrm{M^{-1}}\)、\(\Delta H = 5.8 \, \mathrm{kJ/mol}\)4)。


