概要
さまざまな生命現象に生体高分子の相分離が関与する可能性が示されたことにより、相分離生物学が誕生し、飛躍的に発展している。それに伴い、精製タンパク質を用いたインビトロでの相分離による液滴形成の観察もタンパク質の新しい見方として定着してきた。タンパク質溶液の相分離では、タンパク質同士の弱い相互作用による集合体が液滴として観察され、液体としての性質を見極めるために顕微鏡観察が主に行われている。相分離状態は過渡的かつ流動的であることから、そのタンパク質の相分離が誘導される条件を理解し、条件を制御しながら最適なタイミングで観察する必要がある。つまり、相分離していない状態の試料を調製し、観察前に相分離を誘導することが好ましい。タンパク質の相分離に影響を与える因子は、温度、塩濃度、pH、翻訳語修飾、核酸、低分子、イオンなど様々であるため、各種条件を検討しながら観察試料の調製を進める必要がある。本稿では相分離研究の代表的なタンパク質である Fused in sarcoma(FUS)を例にして、インビトロで相分離により形成させた液滴の基本的な顕微鏡観察法を紹介する。
装置・器具・試薬
- スライドガラス(各社)
- カバーガラス(各社)
- 倒立型蛍光顕微鏡(各社、本プロトコールではニコン Eclipse Ti2 を使用)
- 倒立型共焦点レーザー顕微鏡(各社、本プロトコールではオリンパス FV1000 を使用)
実験手順
- 液滴化条件の検討
- 観察試料のセットアップ
- 観察および解析
実験の詳細
1)液滴化条件の検討
タンパク質の相分離液滴の観察に先立って、目的タンパク質の試料調製をする必要があるが、リコンビナントにより発現させた相分離性タンパク質は取り扱いの難しいものが多く、試料調製が最大の難関といっても過言ではない。相分離させない状態を維持しながら可能な限り高純度に精製する必要があり、そのために相分離に影響を与え得る各種条件(発現コンストラクト、バッファーのpHや塩濃度、精製時の温度など)の検討を行う。また、マルトース結合タンパク質(MBP)などの可溶性の高いタグタンパク質は相分離を抑制する効果があるため、融合タンパク質として試料調製することも多い。蛍光観察のために GFP などの蛍光タンパク質を付加する場合もある。可能であれば蛍光タグは相分離ドメインの反対側に付加することで、相分離への影響を抑えられる。蛍光タンパク質はオリゴマー化しやすいものもあり、相分離を促進する可能性があるため注意が必要である。我々が FUS を精製する場合には、N末端にMBPを融合させたものを、高塩濃度(1.5 M NaCl)のバッファー溶液中で低温での精製を行い、室温で通常の塩濃度のバッファー(150 mM)に透析で置換している。
目的の精製タンパク質が得られた後は、相分離条件の検討を行う。相分離の開始のために溶液混合による塩濃度や pH のジャンプを試みる。ジャンプ時に溶液が白濁し、元の組成に戻した場合に透明に戻る場合には相分離による液滴形成が行われている可能性が高い。FUS の場合には 150 mM NaCl 以下の溶液中で MBP タグの除去をプロテアーゼによって行うことで、相分離による液滴形成が誘導される。また、FUS の液滴は温度変化に敏感であり、30℃以上では液滴を形成せず、25℃以下の温度になると相分離がはじまり、低温になるほど液滴形成が促進する。タンパク質濃度も重要なパラメータであり、液滴形成しにくい場合にはデキストランやフィコール、ポリエチレングリコールなどを終濃度5〜10%程度加える場合もある。溶液中の相分離の度合いは 400 nm または 600 nm の吸光度(濁度)によって評価できる。また、相分離による液滴は遠心によって沈降されるため、遠心前と遠心後上清をサンプリングし、SDS-PAGE でバンドを比較することで目的タンパク質が白濁に寄与しているか、どの程度の分子が液滴形成により失われたかを確認できる。
2)観察試料のセットアップ
通常、顕微鏡観察時のタンパク質濃度は数 μM にすることが多い。蛍光観察を行う場合には、蛍光標識されたタンパク質をサンプルの1〜10%混ぜておく。そうすることで、本来のタンパク質の相分離を極力妨げないようにする。我々は、スライドガラスで観察を行う場合には、図1に示したように両面テープを二つ折りにし、穴あけパンチで穴を空けたものを土手として使用している(穴あけパンチは一般的な 6 mm 径のものより少し大きめの 8 mm 径を使用している)。内側にサンプルを 2〜5 μL 程度置き、カバーガラスで挟んで円柱を形成させる。相分離による液滴はピペットによる移し替えで消失してしまう場合もあることから、可能であればガラス上で溶液を混合するなどして相分離を誘導すると良い。溶液をセットした直後にも観察できるが、観察状態にして30分ほど静置した後、ガラス面に落ちてきた液滴が観察しやすい。プレートを使用して観察する際にも言えるが、ガラス面の傷やコーティングによる影響を受ける場合があることから、同一のサンプルでも底面に落ちた液滴の見え方が観察環境によって異なる場合があるので注意をする。PEG や脂質によるコーティングの手法については、参考文献1に詳しい手順が示されているので参考にしていただきたい。プレートについては低吸着性のものが販売されている(グライナー社、セルリペレント・プレートなど)。FUS の液滴の場合、ガラスの場合は未処理でも観察に問題が無いが、プレート観察でプラスチックボトムの場合には低吸着性のものを用いた方がきれいな液滴として観察できる。
3)観察および解析
底面に落ちた液滴の観察を行うためには、倒立型顕微鏡が適している。我々の環境では、ニコン製の倒立型蛍光顕微鏡(Eclipse Ti2)またはオリンパス製の共焦点レーザー倒立型顕微鏡(FV1000)を使用している。観察には40倍から100倍のレンズを用いる。液滴の観察には、通常の明視野での観察に加えて、微分干渉観察法や位相差観察法が行われることがある。微分干渉観察法や位相差観察法にはそれぞれ専用のモジュールや対応したレンズが必要になるため、各メーカーの仕様を確認していただきたい。液滴形成初期段階では、数 μm 程度の液滴が見られる。通常の透過光源による明視野観察でも液滴を観察できるが、相分離による液滴は透明な標本のため見つけにくい場合がある。そのため、液滴を立体的に浮かび上がらせる微分干渉法は液滴観察に適した手法であり、論文で多く見かける観察法である。位相差観察法では小さな液滴は見つけやすくなるが、ハレーションを起こすため注意が必要である。各手法による観察像を図2に示した。
相分離による液滴らしさの判断基準として、液滴の融合が挙げられる。経時変化を観察することで、液滴が融合するかどうかを注意深く観察する(図3a)。明視野観察ではゴミのようなものも多くみられることもあり、目的タンパク質の相分離による液滴かどうかの判断が難しい場合もある(図2d)。そのためにも蛍光標識をしたタンパク質による蛍光観察は有効な手法である。レーザー光源がある場合には光褪色後蛍光回復法(FRAP 法)による観察を行うと良い。液滴の一部に高強度のレーザーを照射し、褪色させた後の蛍光の回復をみることで、液滴の流動性が判断できる(図3b)。相分離による液滴の場合には、〜数十秒で元の輝度近くまで回復することが多い。凝集化している場合には、回復率や回復速度が顕著に低下する。
工夫とコツ
先にも述べたが相分離性タンパク質は取り扱いが難しい場合が多く、様々なトライアンドエラーが求められる。精製条件の検討を重ねる上で見られる白濁が、相分離の条件と密接に関わるため注意深く溶液状態を観察しながら試料を取り扱う。低温条件で相分離が起こり易い傾向にあるため、一定にした室温(例えば25℃)での精製が適しているケースもある。高純度なタンパク質試料が得られるに越したことは無いが、カラムを通すたびにタンパク質が失われることもあり、精製ステップを少なくした手早い精製の方が良い場合もある。特にイオン交換カラムは溶液中の塩強度を変化させる必要があることから、相分離性のタンパク質の精製に適さないことがある。また、液滴は剪断ストレスに弱いものも多いため、ピペッティングにより液滴の消失や凝集化などの状態変化が起こる可能性があることも意識しておく。相分離による液滴は流動的かつ過渡的であるため、スムーズな観察が求められる。温度低下により相分離が誘導されるものについては、わずかでも相分離が開始してしまうことを防ぐために、プレパラートの準備の直前までタンパク質試料をブロックインキュベータで温めておく方法もある。観察顕微鏡観察時の室温も一定であることが望ましい。より厳密な温度の制御が必要な場合には、東海ヒットなどから試料台の温度を制御するモジュールが販売されている。相分離による液滴観察に関するプロトコールは様々なグループにより書かれているので併せて参照いただきたい(文献1–3)。
文献
- Alberti, S. et al., J. Mol. Biol., 430, 4806–4820 (2018).
- Ganser, L.R. and Myong, S., Trends Biochem. Sci., 45, 1004–1005 (2020).
- Wang, Z. et al., Biophysics Rep., 5, 1–9 (2019).
謝辞
本プロトコールの作成にあたり、立命館大学構造生命科学研究室(松村浩由教授)の学生である井手郁佳氏、笹原直哉氏の試料調整の協力を得た。この場を借りて感謝申し上げます。
-
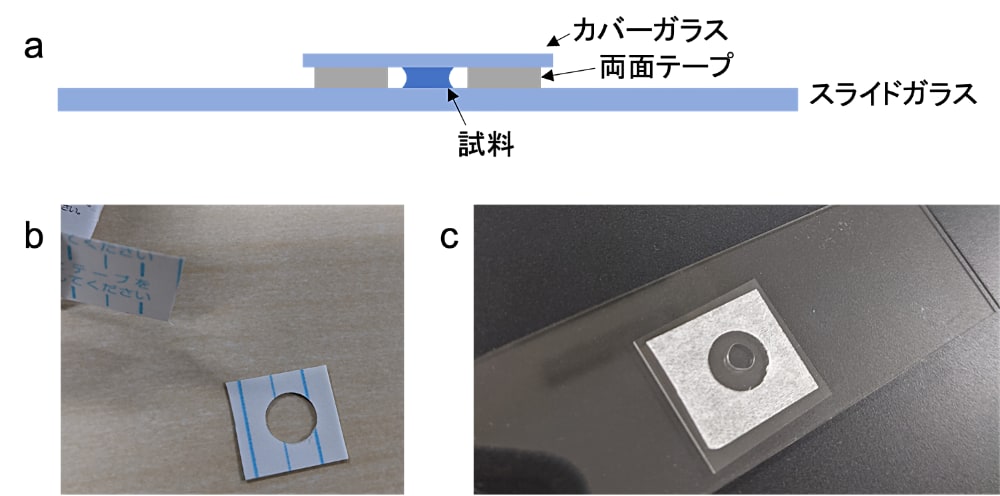
図1:観察試料の準備
(a)作成するプレパラートの模式図。試料に厚みを持たせるため、両面テープで土手をつくり観察試料をスライドガラスとカバーガラスの間にはさむ。(b)両面テープは二つ折にし、穴あけパンチで中央に穴をあけたものを使用する。(c)実際に試料をセットしたプレパラート。 -

図2:相分離液滴を各手法により観察した顕微鏡像
100倍油浸レンズを使用。(a)明視野観察法。(b)微分干渉観察法。(c)位相差観察法。(d)GFP による蛍光観察法。 -

図3:顕微鏡観察でみられる相分離液滴の一般的な特徴
(a)液滴同士の融合。近接する二つの液滴が融合し、ひとつの液滴となる。(b)FRAP 法による評価。レーザーにより蛍光消失させた領域の蛍光の回復をみる。


