概要
部位特異的光架橋法は、タンパク質の任意の部位に非天然アミノ酸であるパラベンゾイルフェニルアラニン(BPA)を導入し、BPA が持つ光架橋側鎖の特性を生かして、タンパク質間相互作用を、UV 照射により生ずる架橋産物から解析する方法である。BPA の導入部位により架橋の有無、もしくは増減が確認できるため、アミノ酸残基レベルの空間分解能で相互作用解析が出来る。今回は、出芽酵母、S. cerevisiae による、in vivo サプレッサー tRNA 法 (1) を用いた、in vivo 部位特異的光架橋法を紹介する。
イントロダクション
このアーカイブをご覧になるほとんど全ての方が、一度はタンパク質間相互作用について研究したことがあるはずだと思う。タンパク質間相互作用の解析には、共免疫沈降法、化学架橋法をはじめとした様々な方法が利用されてきたが、中でも BPA を用いた、in vivo 部位特異的光架橋法は比較的簡便な方法で、多くの情報が得られる方法であると我々は自負している。BPA を用いた部位特異的光架橋法が開発された黎明期は、タンパク質の任意の部位への BPA の導入を in vitro 無細胞タンパク質合成系に頼っていたため、BPA を含むタンパク質を合成した後に、解析対象の複合体に送り込む、もしくは相互作用している状態を人為的に作り出さなければならず、多くの相互作用解析には不向きであった(2)。しかし、Peter G. Schultz をはじめとした様々なグループにより in vivo サプレッサー tRNA 法が開発され、生細胞内で BPA が導入できるようになり、新たに in vivo 部位特異的光架橋法が可能となった(1)。in vivo サプレッサー tRNA 法による、出芽酵母細胞内での具体的な BPA 導入原理は、培地に添加された BPA が酵母細胞内にとりこまれ、人為的に酵母細胞内で発現されている改変アミノアシル tRNA 合成酵素(BpaRS)により、同じく人為的に発現されているアンバーサプレッサー tRNA(出芽酵母で最も使用頻度の低いアンバーコドン;TAG に対するアンチコドンをもつ)に BPA がチャージされ、これが目的のタンパク質の任意の部位に入れられたアンバー変異に部位特異的に BPA を導入するというものである(図1A)。BPA が導入されたタンパク質は細胞本来の機能により、目的のオルガネラや機能複合体へと輸送されるため、よほど重要なアミノ酸を BPA に置換しない限り、非常に簡便に自然な状態の相互作用解析が可能である。本稿では筆者らが行った出芽酵母、S. cerevisiae におけるミトコンドリア外膜タンパク質 Tom40 の相互作用解析(3)を例に、そのプロトコルを紹介する。なお、CHO 細胞などの動物細胞をもちいた解析についても開発されているので別途参照されたい(4,6)。
装置・器具・試薬
装置
- 遠心機(50 mL、15 mL ファルコンチューブ用)(各社)
- 冷却遠心機(1.5 mLチューブ用)(各社)
- インキュベーター(各社)
- ローテーター(各社)
- 紫外光照射器:UVP 社 B-100AP 型 100 W 365 nm(図2)
- プローブ式超音波破砕装置(各社)
- スラブ式泳動装置(各社)
- ブロッティング装置(各社)
器具
- 250 mL バッフル付き三角フラスコ(各社)
- プラスチックシャーレ(90×15 mm)(各社)
- 50 mL ファルコンチューブ(各社)
- 15 mL ファルコンチューブ(各社)
- 1.5 mL チューブ(各社)
- PVDF メンブレン(ナイトロセルロースでも可)(各社)
試薬
- -Ura, -Trp サプリメント:400 mg adenine sulfate、400 mg L-histidine-HCl、600 mg L-leucine、600 mg L-lysine-HCl を250 mLの10 mM HCl に溶かし、濾過滅菌。常温保存。
- 20% (w/v) D-グルコース溶液:精製水に溶かし、オートクレーブ、常温保存。
- 20% (w/v) ガラクトース溶液:精製水に溶かし、オートクレーブ、常温保存。
- YPGal agar 培地:2 g yeast extract、4 g polypepton、4 g agar(全てベクトン・ディッキンソン社)を180 mLの精製水に溶かし、オートクレーブ。20 mLの20% (w/v) ガラクトース溶液を加え、プラスチックシャーレに約20 mLずつ分注する。
- YP 培地:10 g yeast extract、20 g polypepton を180 mLの精製水に溶かし、オートクレーブ。
- SCGal agar 培地:1.35 g yeast nitrogen base w/o amino acids、1 g casamino asid(ともにベクトン・ディッキンソン社)、4 g agar を180 mLの精製水に溶かし、オートクレーブ、20 mLの20% (w/v) ガラクトース溶液および、2 mL -Ura, -Trp サプリメントを加え、プラスチックシャーレに約20 mLずつ分注する。
- SC 培地:6.7 g yeast nitrogen base w/o amino acids、5.0 g casamino asid を900 mLの精製水に溶かし、オートクレーブ、常温保存
- 5N NaOH
- 100 mM BPA:27 mg p-benzoyl-L-phenylalanine(バッケム社、もしくは渡辺化学工業)を100 mLの 1.0 M NaOH に溶かす。用時調製。
- 4M リチウム酢酸溶液:精製水に溶かす。
- 1M DTT:精製水に溶かす。
- TritonX-100(各社)
- Ni-NTA agarose(キアゲン社)
- 100% (w/v) トリクロロ酢酸
- 氷冷アセトン
材料
- 酵母株:Gal7-Tom40株(MATa ade2 his3 ura3 leu2 trp1 can1 GAL7-Tom40-CgHIS3)。Ura3 と Trp1 マーカーが使える株であれば何でもよい。
- プラスミド DNA:p-6xtRNA(アンバーサプレッサー tRNA と BpaRS がコードされたプラスミド、TRP1 マーカー)、pTS6-X(任意のアミノ酸 X に対応するコドンをアンバーコドンに置換した Tom40-His10 を酵母細胞内で発現するプラスミド、Ura3 マーカー)(図1A)。
実験手順
- 変異体の作製
- 酵母形質転換体の作製
- プレカルチャーの作製
- BPA を含む培地で本培養
- UV 照射および菌体回収
- Ni-NTA による精製
- SDS-PAGE による架橋産物の解析
実験の詳細
1)準備
・変異体の作製
ここではミトコンドリア外膜膜透過装置 Tom40 の相互作用解析に用いた変異体を例に挙げて説明する。Tom40 は C 末端側にタグ等を付加してもその機能に影響がないことから、架橋産物の収量を上げられるように C 末端側に His タグを付加した。BPA を導入する部位は、Tom40 のマルチプルアライメントを作成し、よく保存された残基を避けながら網羅的に選択した。具体的な方法としては、クイックチェンジ法を利用した(工夫とコツ-1)。
2)酵母形質転換体の作製
- ディープフリーザーで保存している Gal7-Tom40 株のグリセロールストックを YPGal agar プレートに起こす。30℃でコロニーがしっかりと見えるまで2-3日間インキュベートする。
- 得られたコロニーを約5 mLの YPGal 液体培地に植菌し適度に振盪しながら30℃で約12時間程度培養する。
- Gal7-Tom40 株に、p-6xtRNA および pTS6-X を導入する。導入方法は、白石らの文献6を参照のこと。白石らは SmaI で切断したプラスミドを使用していたが、未切断の環状プラスミドも同様の方法で導入可能である。形質転換体のセレクションは、SCGal(-Ura, -Trp) プレートにて行う。
3)プレカルチャーの作製
得られた形質転換体を、5 mLの SCGal (-Ura, -Trp) 液体培地に植菌し、30℃で2日間程度、OD600=約2.0程度まで培養する。SCGal (-Ura, -Trp) 培地は、45 mLの SC 培地に、5 mLの20% (w/v) ガラクトース溶液および、0.5 mL -Ura, -Trp サプリメントを加えて作製する。
4)BPAを含む培地で本培養
- SCD (-Ura, -Trp, +BPA) 培地の作製
250 mLバッフル付きフラスコに90 mL SC 培地、10 mL 20% (w/v) D-グルコース溶液、1.0 mL -Ura, -Trp サプリメントを入れよく撹拌する。さらに、用時調製した100 mM BPA 溶液を全量(約125 μL)、培地を激しく撹拌しながら加える(工夫とコツ-2)。 - プレカルチャー全量を加え、30℃で16から24時間振盪培養する(工夫とコツ-3)。
5)UV 照射および菌体回収
- 50 mLファルコンチューブに50 mLずつ培養液を回収する。
- 一方は、25 mLずつプラスチックシャーレに移す。
- 紫外光照射器(UVP 社 B-100AP 型)の下に、シャーレをふたは外した状態でセットする。
- 10分間 UV 照射する(図2)(工夫とコツ-4)(実験の安全)
- 50 mLファルコンチューブに戻し、3,500 rpm、4℃、5分間遠心し、菌体を回収する。
- 得られた菌体を-20℃で1時間以上凍結する。このまま保存することも可能(工夫とコツ-5)。
6)Ni-NTA による精製
- -20℃で保存した、菌体を室温に戻す。
- 菌体を5 mLの精製水に懸濁する。
- 5 mLの4 Mリチウム酢酸溶液を加える(終濃度2 M)。
- 氷上で5分インキュベート。
- 3,500 rpm、4℃、5分間遠心し、菌体を回収する。
- 菌体を5 mLの精製水に懸濁する。
- 5 mLの800 mN NaOH、200 mM DTT 溶液を加える。
- 3,500 rpm、4℃、5分間遠心し、菌体を回収する。
- 菌体に3 mLの1% SDS バッファーを加える。
- プローブ式超音波破砕装置を用いて菌体を破砕する(工夫とコツ-6)。
- 3,500 rpm, 25℃、10分間遠心する。
- 上清を15 mLファルコンチューブに移す。
- 11.9 mL 0.5% Triton X バッファー(pH 8.0, 50 mM Tris-HCl、150 mM NaCl、0.5% (v/v) Triton X-100)、100 μL Ni-NTA agarose を加える(工夫とコツ-7)。
- 4℃でローテーターで振盪しながら、1時間以上インキュベートする。
- 1,200 rpm、4℃、5分間遠心し、上清を取り除き、Ni-NTA agarose を回収する。
- 1 mLの0.5% Triton X バッファーを加え、レジンを懸濁する。
- 15、16と同じ操作を3回繰り返す(レジンを4回洗う)。
- 600 μLの Elute バッファー(pH 8.0、50 mM Tris-HCl、400 mM imidazole-HCl、150 mM NaCl, 0.5% (v/v) Triton X-100)を加える。
- 4℃でローテーターで振盪しながら、20分以上インキュベートする。
- 1,200 rpm、4℃、5分間遠心し、上清を1.5 mLのチューブに移す。
- 13 μLの1.5%デオキシコール酸ナトリウム溶液を加え、ボルテックスに撹拌する。
- 68 μLの100% (w/v)トリクロロ酢酸溶液を加え、ボルテックスで撹拌する。
- 氷上で10分間インキュベート。
- 15,000 rpm、4℃、10分間遠心する。
- 上清を除き500 μLの氷冷アセトンを加え、ボルテックスもしくはバスソニケーターで沈殿を懸濁する。
- 15,000 rpm、4℃、10分間遠心する。
- 上清を除き、沈殿を60 μLの SDS-PAGE サンプルバッファーに懸濁する。
- 95℃で5分間インキュベーション。
7)SDS-PAGE による架橋産物の解析
前項の28で得られたサンプル10 μLを8%トリス-グリシン系 SDS-PAGE で泳動し、PVDF メンブレンにセミドライ法で転写する。抗 Tom40 抗体を用いてウエスタンブロッティングにより架橋産物を解析する。UV 照射特異的に見られる高分子量の架橋産物が見られた場合、見かけの分子量から相互作用しているタンパク質を推定し、その抗体を用いたウエスタンブロッティングにより相互作用しているタンパク質を同定する。3に示す結果の場合、Tom40 の310番目の残基を BPA に置換した場合、約75 kDaの架橋産物が見られた。これは抗 Tom22 抗体でも検出されたため、Tom40 の310番目のアミノ酸は Tom22 と接近していることが示された(図3)。
工夫とコツ
- BPA の導入および、取り扱いについて
- BPA は、図1Bに示すように、非常に側鎖が大きくかつ、疎水性の強いアミノ酸なので、変異導入の際には、よく保存された親水性のアミノ酸は避けて導入する。BPA の導入効率は前後の配列によるが、約50%程度なので、約半分はアンバーコドンで翻訳が停止してしまったものとなるため、アンバーコドンをリードスルーし BPA が導入されたタンパク質のみを効率よく回収できるように C 末端側に His タグを付加する。
- BPA は、培地に加える際、非常に析出しやすい。よく撹拌しながら加えるか、オートクレーブ後の暖かい培地(約60℃)に加えるとよい。もし、析出してしまった場合は、培地をバーナーの炎等で、暖め溶かし、常温に戻して植菌する。
紫外線照射について
- 我々は、人の出入りの少ない部屋の照明を切り、その部屋で培養を行っている。もし、培養装置のある部屋が、電気が常についていたり、培地に外部からの太陽光があたる場合は、アルミホイル等を利用して遮光する。タンパク質への BPA の導入効率は30℃での培養が最も高効率であるため、酵母の生育に影響がない場合は、出来るだけ30℃で培養する。
- 紫外光照射器(UVP社 B-100AP 型)は、電源を入れた直後は光量が弱いので、10分程度暖機運転を行う。
酵母の破砕について
- 一度凍結した酵母の方が、凍結していない酵母より、破砕およびタンパク質の抽出率が良い。
- 通常の細胞破砕とは異なり、SDS での可溶化のための熱処理を兼ねるため、連続的に2分間、サンプルに超音波を与える。その際、泡立たないように、強度とプローブの深さを調節する。我々は細い方のプローブを使用している。
タンパク質の精製について
- Ni-NTA agarose は使用前に、水で数回洗った後に、0.5% Triton X バッファーで平衡化しておく。
今回は、細胞内で目的のタンパク質に BPA を導入し、UV 照射によりタンパク質間相互作用を解析する、最も基本的な方法を紹介した。しかし、この手法の強みは、BPA をもつタンパク質がごく自然な状態で機能的な複合体や状態を取ることが出来る点である。したがって、培養の条件を検討したり、単離オルガネラ等を利用するなど工夫次第で明らかに出来ることは無限に広がる。実際に我々は、単離ミトコンドリアに、in vitro 合成した放射性ラベルされた前駆体タンパク質を加え、基質とトランスロケーターの相互作用を検出することに成功している。
実験の安全
本実験で使用するUV照射器は非常に強力であるため、ラボコート、実験眼鏡を必ず着用すること。また掲示等で UV 照射中であることを周知し、むやみやたらに他の実験者が近づくことを避けること。人の出入りが多い場所しか取れない場合は、アルミホイル等で下部の紫外光が漏れている部分を覆うこと。
文献
- Chin, J.,W. et al., Science, 301, 964–7 (2003)
- Ellman, J. et al., Methods Enzymol., 202, 301–36 (1991)
- Shiota, T. et al., Science, 349, 1544–8 (2015)
- Hino, N. et al., Nat. Methods, 2, 201–6 (2005)
- Liu, W. et al., Nat. Methods, 4, 239–44 (2007)
- 白井充典, 蛋白質科学会アーカイブ, 6, e072 (2013)
-
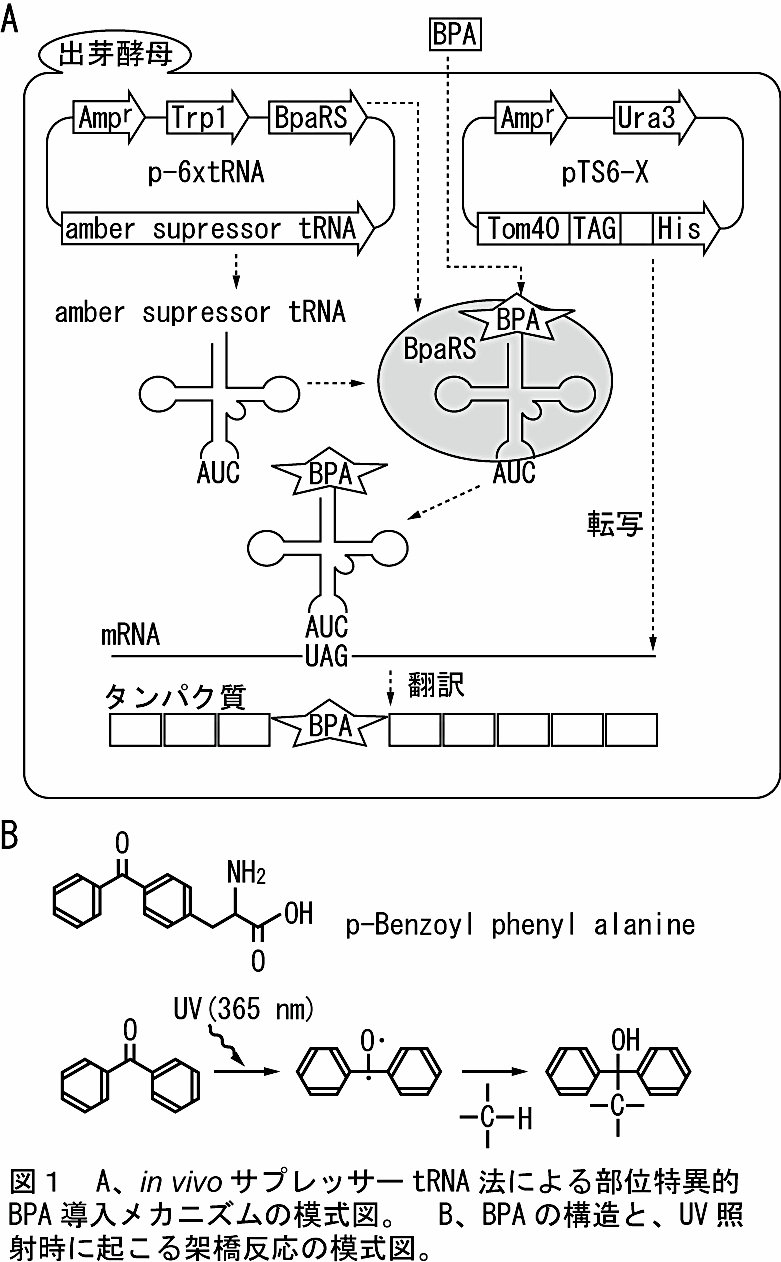
図1:A、in vivo サプレッサー tRNA 法による部位特異的 BPA 導入メカニズムの模式図。B、BPA の構造と、UV 照射時に起こる架橋反応の模式図。 -

図2:UVP 社 B-100AP 型による UV 照射の様子。 -
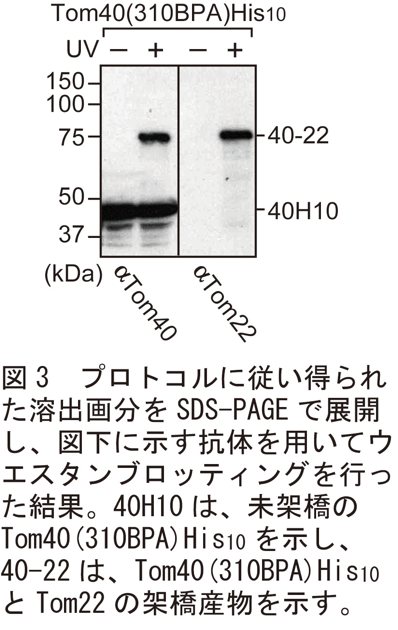
図3:プロトコルに従い得られた溶出画分を SDS-PAGE で展開し、図下に示す抗体を用いてウエスタンブロッティングを行った結果。40H10 は、未架橋の Tom40(310BPA)His10 を示し、40-22 は、Tom40(310BPA)His10 と Tom22 の架橋産物を示す。
概要
部位特異的光架橋法は、タンパク質の任意の部位に非天然アミノ酸であるパラベンゾイルフェニルアラニン(BPA)を導入し、BPA が持つ光架橋側鎖の特性を生かして、タンパク質間相互作用を、UV 照射により生ずる架橋産物から解析する方法である。BPA の導入部位により架橋の有無、もしくは増減が確認できるため、アミノ酸残基レベルの空間分解能で相互作用解析が出来る。今回は、出芽酵母、S. cerevisiae による、in vivo サプレッサー tRNA 法 (1) を用いた、in vivo 部位特異的光架橋法を紹介する。
イントロダクション
このアーカイブをご覧になるほとんど全ての方が、一度はタンパク質間相互作用について研究したことがあるはずだと思う。タンパク質間相互作用の解析には、共免疫沈降法、化学架橋法をはじめとした様々な方法が利用されてきたが、中でも BPA を用いた、in vivo 部位特異的光架橋法は比較的簡便な方法で、多くの情報が得られる方法であると我々は自負している。BPA を用いた部位特異的光架橋法が開発された黎明期は、タンパク質の任意の部位への BPA の導入を in vitro 無細胞タンパク質合成系に頼っていたため、BPA を含むタンパク質を合成した後に、解析対象の複合体に送り込む、もしくは相互作用している状態を人為的に作り出さなければならず、多くの相互作用解析には不向きであった(2)。しかし、Peter G. Schultz をはじめとした様々なグループにより in vivo サプレッサー tRNA 法が開発され、生細胞内で BPA が導入できるようになり、新たに in vivo 部位特異的光架橋法が可能となった(1)。in vivo サプレッサー tRNA 法による、出芽酵母細胞内での具体的な BPA 導入原理は、培地に添加された BPA が酵母細胞内にとりこまれ、人為的に酵母細胞内で発現されている改変アミノアシル tRNA 合成酵素(BpaRS)により、同じく人為的に発現されているアンバーサプレッサー tRNA(出芽酵母で最も使用頻度の低いアンバーコドン;TAG に対するアンチコドンをもつ)に BPA がチャージされ、これが目的のタンパク質の任意の部位に入れられたアンバー変異に部位特異的に BPA を導入するというものである(図1A)。BPA が導入されたタンパク質は細胞本来の機能により、目的のオルガネラや機能複合体へと輸送されるため、よほど重要なアミノ酸を BPA に置換しない限り、非常に簡便に自然な状態の相互作用解析が可能である。本稿では筆者らが行った出芽酵母、S. cerevisiae におけるミトコンドリア外膜タンパク質 Tom40 の相互作用解析(3)を例に、そのプロトコルを紹介する。なお、CHO 細胞などの動物細胞をもちいた解析についても開発されているので別途参照されたい(4,6)。
装置・器具・試薬
装置
- 遠心機(50 mL、15 mL ファルコンチューブ用)(各社)
- 冷却遠心機(1.5 mLチューブ用)(各社)
- インキュベーター(各社)
- ローテーター(各社)
- 紫外光照射器:UVP 社 B-100AP 型 100 W 365 nm(図2)
- プローブ式超音波破砕装置(各社)
- スラブ式泳動装置(各社)
- ブロッティング装置(各社)
器具
- 250 mL バッフル付き三角フラスコ(各社)
- プラスチックシャーレ(90×15 mm)(各社)
- 50 mL ファルコンチューブ(各社)
- 15 mL ファルコンチューブ(各社)
- 1.5 mL チューブ(各社)
- PVDF メンブレン(ナイトロセルロースでも可)(各社)
試薬
- -Ura, -Trp サプリメント:400 mg adenine sulfate、400 mg L-histidine-HCl、600 mg L-leucine、600 mg L-lysine-HCl を250 mLの10 mM HCl に溶かし、濾過滅菌。常温保存。
- 20% (w/v) D-グルコース溶液:精製水に溶かし、オートクレーブ、常温保存。
- 20% (w/v) ガラクトース溶液:精製水に溶かし、オートクレーブ、常温保存。
- YPGal agar 培地:2 g yeast extract、4 g polypepton、4 g agar(全てベクトン・ディッキンソン社)を180 mLの精製水に溶かし、オートクレーブ。20 mLの20% (w/v) ガラクトース溶液を加え、プラスチックシャーレに約20 mLずつ分注する。
- YP 培地:10 g yeast extract、20 g polypepton を180 mLの精製水に溶かし、オートクレーブ。
- SCGal agar 培地:1.35 g yeast nitrogen base w/o amino acids、1 g casamino asid(ともにベクトン・ディッキンソン社)、4 g agar を180 mLの精製水に溶かし、オートクレーブ、20 mLの20% (w/v) ガラクトース溶液および、2 mL -Ura, -Trp サプリメントを加え、プラスチックシャーレに約20 mLずつ分注する。
- SC 培地:6.7 g yeast nitrogen base w/o amino acids、5.0 g casamino asid を900 mLの精製水に溶かし、オートクレーブ、常温保存
- 5N NaOH
- 100 mM BPA:27 mg p-benzoyl-L-phenylalanine(バッケム社、もしくは渡辺化学工業)を100 mLの 1.0 M NaOH に溶かす。用時調製。
- 4M リチウム酢酸溶液:精製水に溶かす。
- 1M DTT:精製水に溶かす。
- TritonX-100(各社)
- Ni-NTA agarose(キアゲン社)
- 100% (w/v) トリクロロ酢酸
- 氷冷アセトン
材料
- 酵母株:Gal7-Tom40株(MATa ade2 his3 ura3 leu2 trp1 can1 GAL7-Tom40-CgHIS3)。Ura3 と Trp1 マーカーが使える株であれば何でもよい。
- プラスミド DNA:p-6xtRNA(アンバーサプレッサー tRNA と BpaRS がコードされたプラスミド、TRP1 マーカー)、pTS6-X(任意のアミノ酸 X に対応するコドンをアンバーコドンに置換した Tom40-His10 を酵母細胞内で発現するプラスミド、Ura3 マーカー)(図1A)。
実験手順
- 変異体の作製
- 酵母形質転換体の作製
- プレカルチャーの作製
- BPA を含む培地で本培養
- UV 照射および菌体回収
- Ni-NTA による精製
- SDS-PAGE による架橋産物の解析
実験の詳細
1)準備
・変異体の作製
ここではミトコンドリア外膜膜透過装置 Tom40 の相互作用解析に用いた変異体を例に挙げて説明する。Tom40 は C 末端側にタグ等を付加してもその機能に影響がないことから、架橋産物の収量を上げられるように C 末端側に His タグを付加した。BPA を導入する部位は、Tom40 のマルチプルアライメントを作成し、よく保存された残基を避けながら網羅的に選択した。具体的な方法としては、クイックチェンジ法を利用した(工夫とコツ-1)。
2)酵母形質転換体の作製
- ディープフリーザーで保存している Gal7-Tom40 株のグリセロールストックを YPGal agar プレートに起こす。30℃でコロニーがしっかりと見えるまで2-3日間インキュベートする。
- 得られたコロニーを約5 mLの YPGal 液体培地に植菌し適度に振盪しながら30℃で約12時間程度培養する。
- Gal7-Tom40 株に、p-6xtRNA および pTS6-X を導入する。導入方法は、白石らの文献6を参照のこと。白石らは SmaI で切断したプラスミドを使用していたが、未切断の環状プラスミドも同様の方法で導入可能である。形質転換体のセレクションは、SCGal(-Ura, -Trp) プレートにて行う。
3)プレカルチャーの作製
得られた形質転換体を、5 mLの SCGal (-Ura, -Trp) 液体培地に植菌し、30℃で2日間程度、OD600=約2.0程度まで培養する。SCGal (-Ura, -Trp) 培地は、45 mLの SC 培地に、5 mLの20% (w/v) ガラクトース溶液および、0.5 mL -Ura, -Trp サプリメントを加えて作製する。
4)BPAを含む培地で本培養
- SCD (-Ura, -Trp, +BPA) 培地の作製
250 mLバッフル付きフラスコに90 mL SC 培地、10 mL 20% (w/v) D-グルコース溶液、1.0 mL -Ura, -Trp サプリメントを入れよく撹拌する。さらに、用時調製した100 mM BPA 溶液を全量(約125 μL)、培地を激しく撹拌しながら加える(工夫とコツ-2)。 - プレカルチャー全量を加え、30℃で16から24時間振盪培養する(工夫とコツ-3)。
5)UV 照射および菌体回収
- 50 mLファルコンチューブに50 mLずつ培養液を回収する。
- 一方は、25 mLずつプラスチックシャーレに移す。
- 紫外光照射器(UVP 社 B-100AP 型)の下に、シャーレをふたは外した状態でセットする。
- 10分間 UV 照射する(図2)(工夫とコツ-4)(実験の安全)
- 50 mLファルコンチューブに戻し、3,500 rpm、4℃、5分間遠心し、菌体を回収する。
- 得られた菌体を-20℃で1時間以上凍結する。このまま保存することも可能(工夫とコツ-5)。
6)Ni-NTA による精製
- -20℃で保存した、菌体を室温に戻す。
- 菌体を5 mLの精製水に懸濁する。
- 5 mLの4 Mリチウム酢酸溶液を加える(終濃度2 M)。
- 氷上で5分インキュベート。
- 3,500 rpm、4℃、5分間遠心し、菌体を回収する。
- 菌体を5 mLの精製水に懸濁する。
- 5 mLの800 mN NaOH、200 mM DTT 溶液を加える。
- 3,500 rpm、4℃、5分間遠心し、菌体を回収する。
- 菌体に3 mLの1% SDS バッファーを加える。
- プローブ式超音波破砕装置を用いて菌体を破砕する(工夫とコツ-6)。
- 3,500 rpm, 25℃、10分間遠心する。
- 上清を15 mLファルコンチューブに移す。
- 11.9 mL 0.5% Triton X バッファー(pH 8.0, 50 mM Tris-HCl、150 mM NaCl、0.5% (v/v) Triton X-100)、100 μL Ni-NTA agarose を加える(工夫とコツ-7)。
- 4℃でローテーターで振盪しながら、1時間以上インキュベートする。
- 1,200 rpm、4℃、5分間遠心し、上清を取り除き、Ni-NTA agarose を回収する。
- 1 mLの0.5% Triton X バッファーを加え、レジンを懸濁する。
- 15、16と同じ操作を3回繰り返す(レジンを4回洗う)。
- 600 μLの Elute バッファー(pH 8.0、50 mM Tris-HCl、400 mM imidazole-HCl、150 mM NaCl, 0.5% (v/v) Triton X-100)を加える。
- 4℃でローテーターで振盪しながら、20分以上インキュベートする。
- 1,200 rpm、4℃、5分間遠心し、上清を1.5 mLのチューブに移す。
- 13 μLの1.5%デオキシコール酸ナトリウム溶液を加え、ボルテックスに撹拌する。
- 68 μLの100% (w/v)トリクロロ酢酸溶液を加え、ボルテックスで撹拌する。
- 氷上で10分間インキュベート。
- 15,000 rpm、4℃、10分間遠心する。
- 上清を除き500 μLの氷冷アセトンを加え、ボルテックスもしくはバスソニケーターで沈殿を懸濁する。
- 15,000 rpm、4℃、10分間遠心する。
- 上清を除き、沈殿を60 μLの SDS-PAGE サンプルバッファーに懸濁する。
- 95℃で5分間インキュベーション。
7)SDS-PAGE による架橋産物の解析
前項の28で得られたサンプル10 μLを8%トリス-グリシン系 SDS-PAGE で泳動し、PVDF メンブレンにセミドライ法で転写する。抗 Tom40 抗体を用いてウエスタンブロッティングにより架橋産物を解析する。UV 照射特異的に見られる高分子量の架橋産物が見られた場合、見かけの分子量から相互作用しているタンパク質を推定し、その抗体を用いたウエスタンブロッティングにより相互作用しているタンパク質を同定する。3に示す結果の場合、Tom40 の310番目の残基を BPA に置換した場合、約75 kDaの架橋産物が見られた。これは抗 Tom22 抗体でも検出されたため、Tom40 の310番目のアミノ酸は Tom22 と接近していることが示された(図3)。
工夫とコツ
- BPA の導入および、取り扱いについて
- BPA は、図1Bに示すように、非常に側鎖が大きくかつ、疎水性の強いアミノ酸なので、変異導入の際には、よく保存された親水性のアミノ酸は避けて導入する。BPA の導入効率は前後の配列によるが、約50%程度なので、約半分はアンバーコドンで翻訳が停止してしまったものとなるため、アンバーコドンをリードスルーし BPA が導入されたタンパク質のみを効率よく回収できるように C 末端側に His タグを付加する。
- BPA は、培地に加える際、非常に析出しやすい。よく撹拌しながら加えるか、オートクレーブ後の暖かい培地(約60℃)に加えるとよい。もし、析出してしまった場合は、培地をバーナーの炎等で、暖め溶かし、常温に戻して植菌する。
紫外線照射について
- 我々は、人の出入りの少ない部屋の照明を切り、その部屋で培養を行っている。もし、培養装置のある部屋が、電気が常についていたり、培地に外部からの太陽光があたる場合は、アルミホイル等を利用して遮光する。タンパク質への BPA の導入効率は30℃での培養が最も高効率であるため、酵母の生育に影響がない場合は、出来るだけ30℃で培養する。
- 紫外光照射器(UVP社 B-100AP 型)は、電源を入れた直後は光量が弱いので、10分程度暖機運転を行う。
酵母の破砕について
- 一度凍結した酵母の方が、凍結していない酵母より、破砕およびタンパク質の抽出率が良い。
- 通常の細胞破砕とは異なり、SDS での可溶化のための熱処理を兼ねるため、連続的に2分間、サンプルに超音波を与える。その際、泡立たないように、強度とプローブの深さを調節する。我々は細い方のプローブを使用している。
タンパク質の精製について
- Ni-NTA agarose は使用前に、水で数回洗った後に、0.5% Triton X バッファーで平衡化しておく。
今回は、細胞内で目的のタンパク質に BPA を導入し、UV 照射によりタンパク質間相互作用を解析する、最も基本的な方法を紹介した。しかし、この手法の強みは、BPA をもつタンパク質がごく自然な状態で機能的な複合体や状態を取ることが出来る点である。したがって、培養の条件を検討したり、単離オルガネラ等を利用するなど工夫次第で明らかに出来ることは無限に広がる。実際に我々は、単離ミトコンドリアに、in vitro 合成した放射性ラベルされた前駆体タンパク質を加え、基質とトランスロケーターの相互作用を検出することに成功している。
実験の安全
本実験で使用するUV照射器は非常に強力であるため、ラボコート、実験眼鏡を必ず着用すること。また掲示等で UV 照射中であることを周知し、むやみやたらに他の実験者が近づくことを避けること。人の出入りが多い場所しか取れない場合は、アルミホイル等で下部の紫外光が漏れている部分を覆うこと。
文献
- Chin, J.,W. et al., Science, 301, 964–7 (2003)
- Ellman, J. et al., Methods Enzymol., 202, 301–36 (1991)
- Shiota, T. et al., Science, 349, 1544–8 (2015)
- Hino, N. et al., Nat. Methods, 2, 201–6 (2005)
- Liu, W. et al., Nat. Methods, 4, 239–44 (2007)
- 白井充典, 蛋白質科学会アーカイブ, 6, e072 (2013)


