概要
本記事では、水素重水素交換質量分析(hydrogen-deuterium exchange mass spectrometry; HDX-MS)に焦点を当て、筆者らの研究室で行われた蛋白質–蛋白質間相互作用(protein-protein interaction; PPI)測定および、その低分子制御剤を用いた PPI 阻害アッセイに関する一連の手法を記す。本記事の一連の測定(条件検討、時間依存測定)を終えるのには2–3日ほど時間を要するものの、オートサンプラー機能の向上や解析ソフトウェアの改良で、よりユーザーフレンドリーになっている。
目的・イントロダクション
PPI は細胞内外で多様な生命現象を司っている。PPI が関与する疾患も多く報告されていることから、創薬標的としても注目を集めている(1)。PPI を検出する機器には、表面プラズモン共鳴法(SPR)、等温滴定型熱量測定(ITC)、蛍光共鳴エネルギー移動(FRET)、核磁気共鳴(NMR)等を始めとして様々な測定原理に基づくものが用いられる(2)。その中で、質量分析を PPI 研究に応用する事例も見られる。蛋白質複合体の会合状態を精査できる Native mass spectrometry(Native MS)(3,4)や本記事で紹介する HDX-MS5 がこれに該当する。
HDX-MS 測定は、蛋白質分子中に含まれる水素の重水素への交換を質量分析の力を借りてモニタリングする手法である。蛋白質中の水素の内、アミノ酸側鎖に含まれるものや炭素に直接結合しているものは質量分析で追跡可能な交換速度にないため考慮しない。HDX-MS で焦点となるのは、ペプチド結合におけるアミド水素である。それらのアミド水素の内、弱い水素結合を形成する(すなわち、蛋白質中で柔軟性が高い領域の)ものや蛋白質表面に露出するものほど重水素へ交換されやすい。また、水素重水素交換速度は低 pH・低温条件で十分遅くなるため、HDX-MS ではその性質を利用して交換反応をクエンチしている。交換反応のクエンチ後、蛋白質は低 pH・低温条件でも使用可能なペプシンカラムによってペプチド断片化され、LC-MS によって各ペプチドにおける交換反応前後での質量変化が測定される。ペプチド中の一つの水素が重水素に交換されれば質量がおよそ1増加することから、あるペプチド中の交換しうる全ての水素に対して何割が重水素に置き換わったかという重水素交換率を算出できる。ここまで概説した一連の測定のフローを図1に示す。なお、実際のMS測定はまず蛋白質由来のペプチドを検出する full_scan および、その各ペプチドが蛋白質のどの部分に由来するかを同定する MS/MS の2種類で構成される。この一連の過程で、蛋白質上のどの残基において柔軟性が高いか、溶媒に露出しているかといった蛋白質の高次構造情報を得る。HDX-MS は、結晶構造解析や NMR 解析が困難な蛋白質に対し比較的少量(1.5 mg/mL 程度の濃度で 100 μL 未満)で、蛋白質の高次構造の情報を与える重要な技術の一つとも言える。
HDX-MS はもともと、重水素交換率をもとに蛋白質のコンフォメーション変化を検出する(6)手法として開発された。近年では、抗体–抗原相互作用のエピトープ解析(7)・バイオ医薬品のコンパラビリティ解析(8)・蛋白質–リガンド相互作用に基づくアロステリック作用解析(9)などさまざまな応用事例に本手法が使用されている。
本記事では、HDX-MS によって相互作用界面に関する情報が得られるという利点を PPI の検出に応用した研究例について述べる。本記事ではある蛋白質 A と蛋白質 B の PPI の検出およびその PPI 阻害剤の効果を検証する実験を想定する。また、筆者らの PPI 阻害解析事例(細胞接着因子のホモ二量体化に関するもの(10)であり、その解離定数は数 10 μM と比較的弱い相互作用である)も交えつつ述べることにする。通常の PPI 検出系はヘテロな蛋白質同士の相互作用検出を想定しているため、筆者らの標的のようなホモ複合体形成に関与する PPI 検出には必ずしも適さない。本手法は適切なコントロールの設定により他手法に比べて容易にホモ複合体形成に関与するPPIも検知できるという点で有用性が高い。
装置・器具・試薬・材料・解析ソフトウェア
装置
- HDx-3 PAL(LEAP Technologies)
- UltiMate3000RSLCnano(Thermo Fisher Scientific)
- Q Exactive HF-X mass spectrometer(Thermo Fisher Scientific)
- 遠心機(各社)
器具
- Enzymate Pepsin Column(2.1 × 30 mm, 5 μm; Waters)
- Acclaim PepMap300 C18(1.0 × 15 mm; Thermo Fisher Scientific)
- Hypersil Gold columns(1.0 × 50 mm, 1.9 μm; Thermo Fisher Scientific)
- 試薬用バイアル(大)
- サンプル用バイアル(小)
試薬
- 重水,99.8%(各社)
- Urea,生化学用(各社)
- Tris(2-carboxyethyl)phosphine hydrochloride(TCEP),≧99.0%(各社)
- グアニジン塩酸塩,特級(各社)
- クエン酸,特級(各社)
- DMSO,≧99.0%(各社、化合物溶解に用いる)
- 水酸化ナトリウム,特級(各社)
- ギ酸,HPLC 用(各社)
- アセトニトリル,HPLC 用(各社)
材料
- 精製蛋白質
- 低分子阻害剤の阻害実験を行う場合、阻害剤の低分子
解析ソフトウェア
- Proteome Discoverer 2.2(Thermo Fisher Scientific)
- HDExaminer software(Sierra Analytics, Modesto, CA)
実験手順
- 試料の準備
- 蛋白質溶液
- 重水ベースの buffer
- Quenching buffer の調製
- Cleaning buffer の調製
- 水素重水素交換反応のクエンチ条件の検討
- 時間依存的な重水交換反応と MS 測定
- 実際に行う測定上の機械操作
- UltiMate3000RSLCnano のパージ
- 測定用メソッドの作成
- HDx-3 PAL のセッティング
- 結果の解析
- 軽水ベースのサンプルを用いたペプチドの同定および蛋白質に対する sequence coverage の算出
- 重水交換後のサンプルを用いた各ペプチドの重水素交換率の算出
実験の詳細
1. 試料の準備
測定に際し予め用意すべき試料を、ⅰ 〜 ⅳ にまとめる。
ⅰ. 蛋白質溶液
筆者らの実験系では大腸菌発現系で調製した蛋白質を、Ni-アフィニティクロマトグラムによる粗精製を経て、サイズ排除クロマトグラフィで最終精製を行い測定に用いている。蛋白質は 1.5 mg/mL ほどの濃度を必要とした。サンプル量は何段階の水素重水素交換反応の経時変化を追跡するかに応じて異なる。通常行う実験系では水素重水素交換反応の時間を段階的に7段階増やし、かつ軽水 buffer 下でのコントロール実験も実施しているが、この時最小で 100 μL のサンプル量が必要である。なお、このとき蛋白質溶液は軽水ベースで調製する。
ⅱ. 重水ベースの buffer
水素重水素交換反応を行うにあたっては、上記で調製した蛋白質溶液に対して5〜10倍量の重水ベースの buffer を添加する。蛋白質溶液を調製するのに使用している buffer を重水ベースで作製することになる。筆者らは buffer 中に含まれる各組成を粉末で秤量し、それを重水で溶解することによって当該 buffer を調製している。粉末の秤量を正確に行う都合上、重水ベースの buffer は通常 5〜10 mL ほど作製している。Buffer は測定に先立ち、0.2 μm のフィルターを通してから使用している。以下、全ての buffer に関して同様の処理をしている。これらのサンプル類は、専用のバイアルに充填して workstation(HDx-3PAL)に設置する。その後 workstation のオートサンプラー機能によって自動で測定が実施される。図2に HDx-3PAL を示した。
ここで、蛋白質 A–蛋白質 B 間 PPI の蛋白質 A における相互作用界面を調査することを目的とする実験系を想定して、実際に用意する蛋白質サンプルを説明する(以降の項目においても蛋白質 A、蛋白質 B などの例示はこの想定に基づく)。本実験系においては、2種類のサンプルが最低必要である。すなわち、蛋白質 A と蛋白質 B の混合サンプルおよび、蛋白質 A のみのサンプル(いわばコントロール)である。混合サンプルの時のみ重水素交換率が低い領域があれば、その領域が蛋白質 A 上での蛋白質 B との相互作用界面であると予測され、またこの PPI を検出できていることを示唆する。PPI 阻害剤による阻害効果を検証したい場合は、上記2種類に加え、蛋白質 A と蛋白質 B の混合サンプルに PPI 阻害剤となる化合物を添加するサンプルを作製することになる。実際の測定時には、上述した通り用意した蛋白質溶液が重水ベースの buffer により5〜10倍ほど希釈されることに注意されたい。希釈後の蛋白質濃度が検出したい PPI の持つ解離定数付近になっていることが望ましく、同様に、化合物を添加している場合にも希釈後の化合物終濃度が化合物の蛋白質に対する解離定数付近になっているように調整する必要があると考える。場合によっては重水ベースの buffer にも化合物を添加することも検討すべきである。
なお、筆者らの実験例においては、ホモ二量体化に関するPPIを検出することを目指していたためコントロールの取り方が上記と異なる。筆者らの場合はホモ二量体化を阻害する点変異を導入した変異体蛋白質(モノマー変異体)をコントロールとすることによって、WT の場合にのみ重水素交換率が下がる部分がホモ二量体化 PPI の界面だと分かった。
ⅲ. Quenching buffer の調製
詳細は下記 2. 水素重水素交換反応のクエンチ条件の検討 を参照のこと。
ⅳ. Cleaning buffer の調製
Cleaning buffer は HDX-MS 測定中、ペプシンカラムを洗浄するためにサンプルごとに使用される buffer である。以下に cleaning buffer の組成を示す。
| 終濃度 | |
|---|---|
| グアニジン塩酸塩 | 2 M |
| クエン酸 | 100 mM |
| to 50 mL | pH 2.3 |
2. 水素重水素交換反応のクエンチ条件の検討
水素重水素交換反応は、workstation のオートサンプラー機能によって自動で各反応時間に応じてクエンチされる。水素重水素反応のクエンチ条件は、後のペプシン消化後に得られるペプチドの蛋白質全体への網羅性(sequence coverage)に影響する。そのため、筆者らの研究室では、各蛋白質に対し初回測定時にはクエンチ条件の検討を行っている。反応のクエンチは、quenching buffer を添加することによって実施される。条件検討として、初回は4種類(Urea の濃度と pH でそれぞれ2通り)の quenching buffer を調製する。以下に quenching buffer の組成を示す。
| 終濃度 | |
|---|---|
| Urea | 8 M or 2 M |
| TCEP | 1 M |
| to 10 mL | pH 3.0 or 4.0 |
これら4種類の quenching buffer を使用した時の sequence coverage を解析ソフト(Proteome Discoverer 2.2)によって算出し(解析方法の詳細は割愛)、最も sequence coverage が高い値を示した条件を続く測定で使用するクエンチ条件として設定する。Proteome Discoverer 2.2 においては、MS/MS のデータと、蛋白質 A の配列情報(.fasta)をもとにペプシン消化された蛋白質由来の各ペプチドが、蛋白質のどの領域由来のものかと、どれほど蛋白質全体を網羅できているか(sequence coverage)を算出できる。Sequence coverage が100%に近づくほど蛋白質全体の情報を網羅的に得ることができる。ペプチドの sequence coverage は数値で表示される他、HDExaminer software 上で視覚的にも確認することができる。図3に示したように、アミノ酸残基番号に対応したバーで得られているペプチド断片が確認できる。
なお、quenching buffer を作る際、Urea と TCEP の粉末を量り取ると、それだけでかなりの体積を占めることになる。慎重に pH 調製とメスアップを行わねば、すぐに目的の体積を超えてしまう。筆者らは37℃に昇温しながら溶液を作製するなど、なるべく少ない水で粉末を溶かし、メスアップ前に目的の体積を超えないようにしていた。
3. 時間依存的な重水交換反応とMS測定
2. で決定したクエンチ条件を用いて PPI 測定に移る。ソフトウェア上で水素重水素交換反応の時間を設定すると workstation のオートサンプラー機能によってその設定通りに水素重水素交換反応が進行し、その後反応はクエンチされる。筆者らは、60 sec〜3840 sec までの7段階の反応時間を設定することが多い。クエンチ後の蛋白質溶液は、続く UltiMate3000RSLCnano における Enzymate Pepsin Column を用いたペプシン消化を経て、脱塩カラム(Acclaim PepMap300 C18)を通過し HPLC カラム(Hypersil Gold columns)による分離後、MS 測定(Q Exactive HF-X mass spectrometer)へと続くことになる。LC-MS の移動相には A buffer(0.1%ギ酸含有超純水)と B buffer(0.1%ギ酸含有アセトニトリル)を使用し、45 μL/min で9分間、10%〜90%のグラジエントにより各ペプチドを分離する。このグラジエント条件は4. ⅱ. で作成する測定メソッドに組み込まれるものであり、測定する蛋白質の種類ごとに変更するものではない。なお、この一連の過程はクエンチ条件の検討の時も同様である。測定にあたり筆者らが設定している MS に関するパラメータは下記のとおりである。
| Electrospray voltage | 3.8 kV |
| Ion mode | Positive |
| Shealth and auxiliary nitrogen flow rate | 20 and 2 a.u |
| Ion transfer tube temperature | 275℃ |
| Auxiliary gas heater temperature | 100℃ |
| Mass range | m/z (w/o TCEP) 200–2,000, (w/ TCEP) 260–2,000 |
| Normalized collision energy | 27 a.u. |
4. 実際に行う測定上の機械操作
以下、実際に筆者らが測定に際し行っている操作を記す。詳細な操作方法は膨大な説明を要するためここでは割愛する。
ⅰ. UltiMate3000RSLCnano のパージ
UltiMate3000RSLCnano は LC-MS を行う際に使用する HPLC 装置(図2a)のことである。HPLC 使用時には各種ポンプのパージ(エア抜き)が必要になる。本 HPLC でパージが必要になるのは3か所ある。すなわち、グラジエント分離に用いられるバイナリグラジエントポンプを構成するポンプヘッドおよびフローメータ、ペプシン消化後のペプチドサンプルをトラップカラムへと送るローディングポンプの3つである。パージ操作は HPLC を制御するソフトウェアである Xcalibur の Direct control 画面上で行う。これらのパージを全て行うと1時間弱かかるため、慣れてくれば下記 ⅱ.,ⅲ. を並行して行うのもよい。なお、パージ操作の前には忘れずに buffer を脱気しておく。
ⅱ. 測定用メソッドの作成
ここで述べる測定用メソッドとは、HPLC,MS,オートサンプラーの全てを統合するソフトウェア Chronos 上で作成するメソッドを指す。この Chronos で作成するメソッドの中には HPLC,MS の制御ソフトウェアで予め作成したグラジエントメソッド、Tune ファイル、full_scan および MS/MS 用のスキャン条件が選択され、組み込まれることになる。
Chronos において設定する条件を下表にまとめる。なお、下記項目は測定するサンプルそれぞれに対し入力する必要がある。実際の測定では、まず MS/MS 測定のために軽水ベースの蛋白質サンプル測定を最低3回、その後重水素交換の時間依存の測定を行う(前述したように筆者らは 0 sec,60 sec〜3840 sec の計8条件)ため、11サンプル分に関して下記項目を記入する。表中で指定した項目を全て入力すると、ソフトウェアが測定に必要な時間を自動で算出する。上記のような11サンプルの場合、測定開始から終了までに8時間半ほどかかると想定される。
| 項目名 | 内容 |
|---|---|
| Sample ID | サンプルの名前 |
| Exchange time | 重水素ラベルの時間を指定 |
| Protein Sample Tray / Position | 蛋白質サンプルを置いた場所を指定 |
| Label Plate / Initial Vial | 重水素ラベルに用いるバイアルの開始位置を指定 |
| Quench plate | クエンチに用いるプレートを指定 |
| Quench Source / Vial | Quenching buffer の位置を指定 |
| Deuterium Tray / Vial | 重水素ベースの buffer の位置を指定 |
| Deuterium Wash Tray / Vial | 洗浄に用いる重水素ベースの buffer の位置を指定 |
| Data System Output Dir | データの保存場所を指定 |
| Data system method | 測定に用いるメソッドを指定 ここにfull_scan,MS/MS の情報が加わる |
| LC Clean Blank Method | Clean Blank に用いるメソッドを指定 |
| Clean Blank Source | Clean Blank 時に注入する buffer を指定 |
ⅲ. HDx-3 PAL のセッティング
オートサンプラーである HDx-3 PAL のトレイ置き場(図2b,2c)に各種サンプルバイアルおよび水素重水素交換反応用バイアル、クエンチ用バイアルを設置する。水素重水素交換反応用の各蛋白質サンプルそれぞれに対して測定条件数に対応したバイアル数が必要になる。本記事の想定では、3種類の蛋白質サンプル(蛋白質 A と蛋白質 B の混合サンプル、蛋白質 A のみのサンプル、化合物を添加した蛋白質 A と蛋白質 B の混合サンプル)に対して0,60,120,240,480,960,1920,3840 sec の8測定点を実施することになり、3 * 8 = 24個および full_scan 3回分の27個のバイアルが水素重水素交換反応、クエンチ用で計54個必要になる。
以上の操作を完了したら、Chronos で作成したメソッドを開始する。4. で述べた操作だけで2時間程度は要すると思われる(これに加え測定自体の時間を要する)。
5. 結果の解析
解析は大きく分けて次の2段階に分けられる。すなわち、ⅰ. 軽水ベースのサンプルを用いたペプチドの同定および蛋白質に対する sequence coverage の算出、ⅱ. 重水交換後のサンプルを用いた各ペプチドの重水素交換率の算出である。
ⅰ. 軽水ベースのサンプルを用いたペプチドの同定および蛋白質に対する sequence coverage の算出
Sequence coverage が100%に近いほど、未知の相互作用界面の同定も期待出来る。一方、sequence coverage が低い場合は、得られたペプチド配列の中だけで議論せざるを得ない。相互作用界面が既知でかつ、得られたペプチド配列の中に含まれていれば(ⅱ)の解析に進める。
ⅱ. 重水交換後のサンプルを用いた各ペプチドの重水素交換率の算出
続いて、ⅰ. で同定したペプチドのそれぞれに対し、どれほど重水素化されたかを HDExaminer software にて算出する。ここも、ソフトウェア使用に関する詳細は割愛する。まずは蛋白質 A、蛋白質 B の各ペプチド番号における重水素交換率(D%)の詳細な解析を行う(図4a–c)。続いて、各ペプチドに対する重水素交換率の相対評価(residual plot と呼ぶ)を行う。この residual plot において、蛋白質 A と蛋白質 B の混合サンプルの重水素交換率から、蛋白質 A 単体での重水素交換率を差し引いたとき、重水素交換率の差分(ΔD%)が負の値に転ずる領域があれば、その部分が PPI の相互作用界面である可能性が高い。PPI 阻害剤の効果を検証したい場合には、例えば蛋白質 A と蛋白質 B の混合物の重水素交換率から、化合物を添加した蛋白質 A と蛋白質 B の混合サンプルの重水素交換率を差し引いた residual plot において、先ほどと同様の位置で重水素交換率が負に転ずれば、PPI 阻害剤が相互作用を解離させたことを示唆するデータとなる。データのクオリティを判断する上では、重水素交換率の変化が経時的であるか、同じ領域が含まれる別のペプチドでも同様の重水素交換率の変化が観察されているか、に留意されたい。これらが満たされない場合、その重水素交換率の変化は false positive である可能性が高い。
筆者らの事例ではホモ二量体化に関する PPI を検出するため、まずホモ二量体の重水素交換率からモノマー変異体の重水素交換率を差し引いた(図4d)。差分が負に転じた(モノマー変異体においてより溶媒に露出する)領域は、既報のX線結晶構造から判断される PPI 界面の領域とよく整合した。この時負に転じた領域は、ホモ二量体の重水素交換率からホモ二量体に PPI 阻害剤を添加した場合の重水素交換率を差し引いた場合においても似通った変化が見られた(図4e)ことから、阻害剤の PPI 界面への寄与が示唆された。関与するペプチドの重水素交換率においても、阻害剤の添加によって界面領域の重水素交換率が経時的かつ有意に上昇していることを確認した(図4f)。
なお、HDX-MS においては全ての PPI 界面において重水素交換率に差が生じるわけではないことも多い。実際、筆者らのホモ二量体化蛋白質の測定事例においても、いくつかある PPI 界面の内、高い柔軟性を有すると思われるアミノ酸領域は、モノマーとダイマーの重水素交換率で差が見られなかった。この部分は水素と重水素の交換が素早く、検出するのが困難だったものと考えられる。
工夫とコツ
・翻訳後修飾された蛋白質の測定に関して
サンプルによっては大腸菌発現系でなく、哺乳細胞発現系での調製により翻訳後修飾されていることも想定できる。翻訳後修飾されたアミノ酸を含むペプチド領域は Proteome Discoverer 2.2 にて同定は可能であるが、その後の HDExaminer による解析において、あるペプチド鎖に対して固定された修飾としてしか設定できないため、解析にはやや不向きである。
・システイン残基を多く含む蛋白質に関して
筆者らの経験から、システイン残基を多く含む蛋白質はデータや解析結果の質が低下する傾向にある。システイン残基による非特異的なジスルフィド結合が蛋白質の凝集や望ましくない変性状態を誘発している可能性があると思われる。
・低分子の測定への影響
本記事においては PPI 阻害剤として低分子を選択していた。しかし一般的には低分子はイオン化効率や、ひいては水素重水素交換反応にも影響を与える可能性がある。実際筆者らの実験例でも高濃度化合物を添加した場合の MS のデータクオリティが悪くなる事例が多発した。
・温度管理
HDX-MS 測定ではいくつかのシステムを低温で管理する。これは重水素に交換された状態を維持する(Back exchange を抑える)ためである。筆者らの場合は重水交換させるトレイ(図2b)は10℃、クエンチ反応用トレイ(図2c)は0℃、ペプシンカラム(図2d)は8℃、分離カラムなどを収納したチャンバー(図2e)は2℃に設定している。そのために、水滴や霜が発生しやすい。それらは、定期的に除去することが望ましい。
・Quenching bufferの析出
Quenching buffer には高濃度の TCEP が含まれている。TCEP は低温条件で容易に析出するため、0℃のトレイでなく、10℃のトレイに設置する。
・ペプシンカラムの劣化
蛋白質消化に用いられるペプシンカラムは消耗品であり、その劣化はそのまま検出できるペプチドの数に影響する。筆者らは定期的にシトクロム C など標品サンプルを用いて検出されるペプチドの数が減少していないか確認している。同じ測定条件で測定し、標品において検出されるペプチド数が減ってきた場合、ペプシンカラムを交換したほうがよい。
・データの質を向上させるには
- 調製した蛋白質溶液は測定直前に 0.2 μm フィルターもしくは遠心処理してゴミや凝集物を出来る限り除去する。
- 蛋白質の濃度は最大でも 2.0 mg/mL ほどに収めるのがよい。高濃度の蛋白質をサンプルとして使用した場合、蛋白質の凝集によりペプシン流路やカラム内でつまりが発生したり、ペプシンカラムの限界容量を超えてしまったりすることで測定や解析に支障が出たり、測定が滞ったりする可能性がある。
実験の安全
- 以下の薬品は各物性を把握した上で注意して取り扱う。
- 水酸化ナトリウム…強塩基
- Urea、グアニジン塩酸塩…蛋白質変性剤、塩基
- TCEP…強力な還元剤、酸
- ギ酸…有機酸であり、強酸
- アセトニトリル…可燃性の有機溶媒
- Q Exactive HF-X mass spectrometer のイオントランスファーチューブ部分は高温になるため、洗浄に際しては十分温度が下がったことを確認する。
文献
- Scott D. E., et al., Nat. Rev. Drug Discov., 16, 533–550 (2016)
- Bosch J., Drug Discov. Today, 24, 3–9 (2014)
- Heck A. J. R., Nat. Methods, 5, 927–933 (2008)
- 石井健太郎ら, 蛋白質科学会アーカイブ, 11, e090 (2018)
- Wei H., et al., Drug Discov. Today, 19, 95–102 (2014)
- Houde D., et al., Anal. Chem., 81, 2644–2651 (2009)
- Eguchi A., et al., Biotechnol. Bioeng., 116, 1742–1751 (2019)
- Houde D., et al., J. Pharm. Sci., 100, 2071–2086 (2011)
- Wu D., et al., Nat. Chem. Biol., 15, 367–376 (2019)
- Senoo A., et al., Commun. Biol., 4, 1041 (2021)
謝辞
本プロトコールを作成するにあたり、サーモフィッシャーサイエンティフィック株式会社の永島良樹様、渡辺史生様、肥後大輔様に多大なご協力を賜りました。また、プロトコール作成に関連する研究は国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業創薬等先端技術支援基盤プラットフォーム(BINDS)の課題番号 JP20am0101094、JSPS 科研費 JP20H02531、JP18H02082、JP18H05425、JSPS 特別研究員奨励費 JP19J14451 の助成を受けたものです。心より感謝申し上げます。
概要
本記事では、水素重水素交換質量分析(hydrogen-deuterium exchange mass spectrometry; HDX-MS)に焦点を当て、筆者らの研究室で行われた蛋白質–蛋白質間相互作用(protein-protein interaction; PPI)測定および、その低分子制御剤を用いた PPI 阻害アッセイに関する一連の手法を記す。本記事の一連の測定(条件検討、時間依存測定)を終えるのには2–3日ほど時間を要するものの、オートサンプラー機能の向上や解析ソフトウェアの改良で、よりユーザーフレンドリーになっている。
目的・イントロダクション
PPI は細胞内外で多様な生命現象を司っている。PPI が関与する疾患も多く報告されていることから、創薬標的としても注目を集めている(1)。PPI を検出する機器には、表面プラズモン共鳴法(SPR)、等温滴定型熱量測定(ITC)、蛍光共鳴エネルギー移動(FRET)、核磁気共鳴(NMR)等を始めとして様々な測定原理に基づくものが用いられる(2)。その中で、質量分析を PPI 研究に応用する事例も見られる。蛋白質複合体の会合状態を精査できる Native mass spectrometry(Native MS)(3,4)や本記事で紹介する HDX-MS5 がこれに該当する。
HDX-MS 測定は、蛋白質分子中に含まれる水素の重水素への交換を質量分析の力を借りてモニタリングする手法である。蛋白質中の水素の内、アミノ酸側鎖に含まれるものや炭素に直接結合しているものは質量分析で追跡可能な交換速度にないため考慮しない。HDX-MS で焦点となるのは、ペプチド結合におけるアミド水素である。それらのアミド水素の内、弱い水素結合を形成する(すなわち、蛋白質中で柔軟性が高い領域の)ものや蛋白質表面に露出するものほど重水素へ交換されやすい。また、水素重水素交換速度は低 pH・低温条件で十分遅くなるため、HDX-MS ではその性質を利用して交換反応をクエンチしている。交換反応のクエンチ後、蛋白質は低 pH・低温条件でも使用可能なペプシンカラムによってペプチド断片化され、LC-MS によって各ペプチドにおける交換反応前後での質量変化が測定される。ペプチド中の一つの水素が重水素に交換されれば質量がおよそ1増加することから、あるペプチド中の交換しうる全ての水素に対して何割が重水素に置き換わったかという重水素交換率を算出できる。ここまで概説した一連の測定のフローを図1に示す。なお、実際のMS測定はまず蛋白質由来のペプチドを検出する full_scan および、その各ペプチドが蛋白質のどの部分に由来するかを同定する MS/MS の2種類で構成される。この一連の過程で、蛋白質上のどの残基において柔軟性が高いか、溶媒に露出しているかといった蛋白質の高次構造情報を得る。HDX-MS は、結晶構造解析や NMR 解析が困難な蛋白質に対し比較的少量(1.5 mg/mL 程度の濃度で 100 μL 未満)で、蛋白質の高次構造の情報を与える重要な技術の一つとも言える。
HDX-MS はもともと、重水素交換率をもとに蛋白質のコンフォメーション変化を検出する(6)手法として開発された。近年では、抗体–抗原相互作用のエピトープ解析(7)・バイオ医薬品のコンパラビリティ解析(8)・蛋白質–リガンド相互作用に基づくアロステリック作用解析(9)などさまざまな応用事例に本手法が使用されている。
本記事では、HDX-MS によって相互作用界面に関する情報が得られるという利点を PPI の検出に応用した研究例について述べる。本記事ではある蛋白質 A と蛋白質 B の PPI の検出およびその PPI 阻害剤の効果を検証する実験を想定する。また、筆者らの PPI 阻害解析事例(細胞接着因子のホモ二量体化に関するもの(10)であり、その解離定数は数 10 μM と比較的弱い相互作用である)も交えつつ述べることにする。通常の PPI 検出系はヘテロな蛋白質同士の相互作用検出を想定しているため、筆者らの標的のようなホモ複合体形成に関与する PPI 検出には必ずしも適さない。本手法は適切なコントロールの設定により他手法に比べて容易にホモ複合体形成に関与するPPIも検知できるという点で有用性が高い。
装置・器具・試薬・材料・解析ソフトウェア
装置
- HDx-3 PAL(LEAP Technologies)
- UltiMate3000RSLCnano(Thermo Fisher Scientific)
- Q Exactive HF-X mass spectrometer(Thermo Fisher Scientific)
- 遠心機(各社)
器具
- Enzymate Pepsin Column(2.1 × 30 mm, 5 μm; Waters)
- Acclaim PepMap300 C18(1.0 × 15 mm; Thermo Fisher Scientific)
- Hypersil Gold columns(1.0 × 50 mm, 1.9 μm; Thermo Fisher Scientific)
- 試薬用バイアル(大)
- サンプル用バイアル(小)
試薬
- 重水,99.8%(各社)
- Urea,生化学用(各社)
- Tris(2-carboxyethyl)phosphine hydrochloride(TCEP),≧99.0%(各社)
- グアニジン塩酸塩,特級(各社)
- クエン酸,特級(各社)
- DMSO,≧99.0%(各社、化合物溶解に用いる)
- 水酸化ナトリウム,特級(各社)
- ギ酸,HPLC 用(各社)
- アセトニトリル,HPLC 用(各社)
材料
- 精製蛋白質
- 低分子阻害剤の阻害実験を行う場合、阻害剤の低分子
解析ソフトウェア
- Proteome Discoverer 2.2(Thermo Fisher Scientific)
- HDExaminer software(Sierra Analytics, Modesto, CA)
実験手順
- 試料の準備
- 蛋白質溶液
- 重水ベースの buffer
- Quenching buffer の調製
- Cleaning buffer の調製
- 水素重水素交換反応のクエンチ条件の検討
- 時間依存的な重水交換反応と MS 測定
- 実際に行う測定上の機械操作
- UltiMate3000RSLCnano のパージ
- 測定用メソッドの作成
- HDx-3 PAL のセッティング
- 結果の解析
- 軽水ベースのサンプルを用いたペプチドの同定および蛋白質に対する sequence coverage の算出
- 重水交換後のサンプルを用いた各ペプチドの重水素交換率の算出
実験の詳細
1. 試料の準備
測定に際し予め用意すべき試料を、ⅰ 〜 ⅳ にまとめる。
ⅰ. 蛋白質溶液
筆者らの実験系では大腸菌発現系で調製した蛋白質を、Ni-アフィニティクロマトグラムによる粗精製を経て、サイズ排除クロマトグラフィで最終精製を行い測定に用いている。蛋白質は 1.5 mg/mL ほどの濃度を必要とした。サンプル量は何段階の水素重水素交換反応の経時変化を追跡するかに応じて異なる。通常行う実験系では水素重水素交換反応の時間を段階的に7段階増やし、かつ軽水 buffer 下でのコントロール実験も実施しているが、この時最小で 100 μL のサンプル量が必要である。なお、このとき蛋白質溶液は軽水ベースで調製する。
ⅱ. 重水ベースの buffer
水素重水素交換反応を行うにあたっては、上記で調製した蛋白質溶液に対して5〜10倍量の重水ベースの buffer を添加する。蛋白質溶液を調製するのに使用している buffer を重水ベースで作製することになる。筆者らは buffer 中に含まれる各組成を粉末で秤量し、それを重水で溶解することによって当該 buffer を調製している。粉末の秤量を正確に行う都合上、重水ベースの buffer は通常 5〜10 mL ほど作製している。Buffer は測定に先立ち、0.2 μm のフィルターを通してから使用している。以下、全ての buffer に関して同様の処理をしている。これらのサンプル類は、専用のバイアルに充填して workstation(HDx-3PAL)に設置する。その後 workstation のオートサンプラー機能によって自動で測定が実施される。図2に HDx-3PAL を示した。
ここで、蛋白質 A–蛋白質 B 間 PPI の蛋白質 A における相互作用界面を調査することを目的とする実験系を想定して、実際に用意する蛋白質サンプルを説明する(以降の項目においても蛋白質 A、蛋白質 B などの例示はこの想定に基づく)。本実験系においては、2種類のサンプルが最低必要である。すなわち、蛋白質 A と蛋白質 B の混合サンプルおよび、蛋白質 A のみのサンプル(いわばコントロール)である。混合サンプルの時のみ重水素交換率が低い領域があれば、その領域が蛋白質 A 上での蛋白質 B との相互作用界面であると予測され、またこの PPI を検出できていることを示唆する。PPI 阻害剤による阻害効果を検証したい場合は、上記2種類に加え、蛋白質 A と蛋白質 B の混合サンプルに PPI 阻害剤となる化合物を添加するサンプルを作製することになる。実際の測定時には、上述した通り用意した蛋白質溶液が重水ベースの buffer により5〜10倍ほど希釈されることに注意されたい。希釈後の蛋白質濃度が検出したい PPI の持つ解離定数付近になっていることが望ましく、同様に、化合物を添加している場合にも希釈後の化合物終濃度が化合物の蛋白質に対する解離定数付近になっているように調整する必要があると考える。場合によっては重水ベースの buffer にも化合物を添加することも検討すべきである。
なお、筆者らの実験例においては、ホモ二量体化に関するPPIを検出することを目指していたためコントロールの取り方が上記と異なる。筆者らの場合はホモ二量体化を阻害する点変異を導入した変異体蛋白質(モノマー変異体)をコントロールとすることによって、WT の場合にのみ重水素交換率が下がる部分がホモ二量体化 PPI の界面だと分かった。
ⅲ. Quenching buffer の調製
詳細は下記 2. 水素重水素交換反応のクエンチ条件の検討 を参照のこと。
ⅳ. Cleaning buffer の調製
Cleaning buffer は HDX-MS 測定中、ペプシンカラムを洗浄するためにサンプルごとに使用される buffer である。以下に cleaning buffer の組成を示す。
| 終濃度 | |
|---|---|
| グアニジン塩酸塩 | 2 M |
| クエン酸 | 100 mM |
| to 50 mL | pH 2.3 |
2. 水素重水素交換反応のクエンチ条件の検討
水素重水素交換反応は、workstation のオートサンプラー機能によって自動で各反応時間に応じてクエンチされる。水素重水素反応のクエンチ条件は、後のペプシン消化後に得られるペプチドの蛋白質全体への網羅性(sequence coverage)に影響する。そのため、筆者らの研究室では、各蛋白質に対し初回測定時にはクエンチ条件の検討を行っている。反応のクエンチは、quenching buffer を添加することによって実施される。条件検討として、初回は4種類(Urea の濃度と pH でそれぞれ2通り)の quenching buffer を調製する。以下に quenching buffer の組成を示す。
| 終濃度 | |
|---|---|
| Urea | 8 M or 2 M |
| TCEP | 1 M |
| to 10 mL | pH 3.0 or 4.0 |
これら4種類の quenching buffer を使用した時の sequence coverage を解析ソフト(Proteome Discoverer 2.2)によって算出し(解析方法の詳細は割愛)、最も sequence coverage が高い値を示した条件を続く測定で使用するクエンチ条件として設定する。Proteome Discoverer 2.2 においては、MS/MS のデータと、蛋白質 A の配列情報(.fasta)をもとにペプシン消化された蛋白質由来の各ペプチドが、蛋白質のどの領域由来のものかと、どれほど蛋白質全体を網羅できているか(sequence coverage)を算出できる。Sequence coverage が100%に近づくほど蛋白質全体の情報を網羅的に得ることができる。ペプチドの sequence coverage は数値で表示される他、HDExaminer software 上で視覚的にも確認することができる。図3に示したように、アミノ酸残基番号に対応したバーで得られているペプチド断片が確認できる。
なお、quenching buffer を作る際、Urea と TCEP の粉末を量り取ると、それだけでかなりの体積を占めることになる。慎重に pH 調製とメスアップを行わねば、すぐに目的の体積を超えてしまう。筆者らは37℃に昇温しながら溶液を作製するなど、なるべく少ない水で粉末を溶かし、メスアップ前に目的の体積を超えないようにしていた。
3. 時間依存的な重水交換反応とMS測定
2. で決定したクエンチ条件を用いて PPI 測定に移る。ソフトウェア上で水素重水素交換反応の時間を設定すると workstation のオートサンプラー機能によってその設定通りに水素重水素交換反応が進行し、その後反応はクエンチされる。筆者らは、60 sec〜3840 sec までの7段階の反応時間を設定することが多い。クエンチ後の蛋白質溶液は、続く UltiMate3000RSLCnano における Enzymate Pepsin Column を用いたペプシン消化を経て、脱塩カラム(Acclaim PepMap300 C18)を通過し HPLC カラム(Hypersil Gold columns)による分離後、MS 測定(Q Exactive HF-X mass spectrometer)へと続くことになる。LC-MS の移動相には A buffer(0.1%ギ酸含有超純水)と B buffer(0.1%ギ酸含有アセトニトリル)を使用し、45 μL/min で9分間、10%〜90%のグラジエントにより各ペプチドを分離する。このグラジエント条件は4. ⅱ. で作成する測定メソッドに組み込まれるものであり、測定する蛋白質の種類ごとに変更するものではない。なお、この一連の過程はクエンチ条件の検討の時も同様である。測定にあたり筆者らが設定している MS に関するパラメータは下記のとおりである。
| Electrospray voltage | 3.8 kV |
| Ion mode | Positive |
| Shealth and auxiliary nitrogen flow rate | 20 and 2 a.u |
| Ion transfer tube temperature | 275℃ |
| Auxiliary gas heater temperature | 100℃ |
| Mass range | m/z (w/o TCEP) 200–2,000, (w/ TCEP) 260–2,000 |
| Normalized collision energy | 27 a.u. |
4. 実際に行う測定上の機械操作
以下、実際に筆者らが測定に際し行っている操作を記す。詳細な操作方法は膨大な説明を要するためここでは割愛する。
ⅰ. UltiMate3000RSLCnano のパージ
UltiMate3000RSLCnano は LC-MS を行う際に使用する HPLC 装置(図2a)のことである。HPLC 使用時には各種ポンプのパージ(エア抜き)が必要になる。本 HPLC でパージが必要になるのは3か所ある。すなわち、グラジエント分離に用いられるバイナリグラジエントポンプを構成するポンプヘッドおよびフローメータ、ペプシン消化後のペプチドサンプルをトラップカラムへと送るローディングポンプの3つである。パージ操作は HPLC を制御するソフトウェアである Xcalibur の Direct control 画面上で行う。これらのパージを全て行うと1時間弱かかるため、慣れてくれば下記 ⅱ.,ⅲ. を並行して行うのもよい。なお、パージ操作の前には忘れずに buffer を脱気しておく。
ⅱ. 測定用メソッドの作成
ここで述べる測定用メソッドとは、HPLC,MS,オートサンプラーの全てを統合するソフトウェア Chronos 上で作成するメソッドを指す。この Chronos で作成するメソッドの中には HPLC,MS の制御ソフトウェアで予め作成したグラジエントメソッド、Tune ファイル、full_scan および MS/MS 用のスキャン条件が選択され、組み込まれることになる。
Chronos において設定する条件を下表にまとめる。なお、下記項目は測定するサンプルそれぞれに対し入力する必要がある。実際の測定では、まず MS/MS 測定のために軽水ベースの蛋白質サンプル測定を最低3回、その後重水素交換の時間依存の測定を行う(前述したように筆者らは 0 sec,60 sec〜3840 sec の計8条件)ため、11サンプル分に関して下記項目を記入する。表中で指定した項目を全て入力すると、ソフトウェアが測定に必要な時間を自動で算出する。上記のような11サンプルの場合、測定開始から終了までに8時間半ほどかかると想定される。
| 項目名 | 内容 |
|---|---|
| Sample ID | サンプルの名前 |
| Exchange time | 重水素ラベルの時間を指定 |
| Protein Sample Tray / Position | 蛋白質サンプルを置いた場所を指定 |
| Label Plate / Initial Vial | 重水素ラベルに用いるバイアルの開始位置を指定 |
| Quench plate | クエンチに用いるプレートを指定 |
| Quench Source / Vial | Quenching buffer の位置を指定 |
| Deuterium Tray / Vial | 重水素ベースの buffer の位置を指定 |
| Deuterium Wash Tray / Vial | 洗浄に用いる重水素ベースの buffer の位置を指定 |
| Data System Output Dir | データの保存場所を指定 |
| Data system method | 測定に用いるメソッドを指定 ここにfull_scan,MS/MS の情報が加わる |
| LC Clean Blank Method | Clean Blank に用いるメソッドを指定 |
| Clean Blank Source | Clean Blank 時に注入する buffer を指定 |
ⅲ. HDx-3 PAL のセッティング
オートサンプラーである HDx-3 PAL のトレイ置き場(図2b,2c)に各種サンプルバイアルおよび水素重水素交換反応用バイアル、クエンチ用バイアルを設置する。水素重水素交換反応用の各蛋白質サンプルそれぞれに対して測定条件数に対応したバイアル数が必要になる。本記事の想定では、3種類の蛋白質サンプル(蛋白質 A と蛋白質 B の混合サンプル、蛋白質 A のみのサンプル、化合物を添加した蛋白質 A と蛋白質 B の混合サンプル)に対して0,60,120,240,480,960,1920,3840 sec の8測定点を実施することになり、3 * 8 = 24個および full_scan 3回分の27個のバイアルが水素重水素交換反応、クエンチ用で計54個必要になる。
以上の操作を完了したら、Chronos で作成したメソッドを開始する。4. で述べた操作だけで2時間程度は要すると思われる(これに加え測定自体の時間を要する)。
5. 結果の解析
解析は大きく分けて次の2段階に分けられる。すなわち、ⅰ. 軽水ベースのサンプルを用いたペプチドの同定および蛋白質に対する sequence coverage の算出、ⅱ. 重水交換後のサンプルを用いた各ペプチドの重水素交換率の算出である。
ⅰ. 軽水ベースのサンプルを用いたペプチドの同定および蛋白質に対する sequence coverage の算出
Sequence coverage が100%に近いほど、未知の相互作用界面の同定も期待出来る。一方、sequence coverage が低い場合は、得られたペプチド配列の中だけで議論せざるを得ない。相互作用界面が既知でかつ、得られたペプチド配列の中に含まれていれば(ⅱ)の解析に進める。
ⅱ. 重水交換後のサンプルを用いた各ペプチドの重水素交換率の算出
続いて、ⅰ. で同定したペプチドのそれぞれに対し、どれほど重水素化されたかを HDExaminer software にて算出する。ここも、ソフトウェア使用に関する詳細は割愛する。まずは蛋白質 A、蛋白質 B の各ペプチド番号における重水素交換率(D%)の詳細な解析を行う(図4a–c)。続いて、各ペプチドに対する重水素交換率の相対評価(residual plot と呼ぶ)を行う。この residual plot において、蛋白質 A と蛋白質 B の混合サンプルの重水素交換率から、蛋白質 A 単体での重水素交換率を差し引いたとき、重水素交換率の差分(ΔD%)が負の値に転ずる領域があれば、その部分が PPI の相互作用界面である可能性が高い。PPI 阻害剤の効果を検証したい場合には、例えば蛋白質 A と蛋白質 B の混合物の重水素交換率から、化合物を添加した蛋白質 A と蛋白質 B の混合サンプルの重水素交換率を差し引いた residual plot において、先ほどと同様の位置で重水素交換率が負に転ずれば、PPI 阻害剤が相互作用を解離させたことを示唆するデータとなる。データのクオリティを判断する上では、重水素交換率の変化が経時的であるか、同じ領域が含まれる別のペプチドでも同様の重水素交換率の変化が観察されているか、に留意されたい。これらが満たされない場合、その重水素交換率の変化は false positive である可能性が高い。
筆者らの事例ではホモ二量体化に関する PPI を検出するため、まずホモ二量体の重水素交換率からモノマー変異体の重水素交換率を差し引いた(図4d)。差分が負に転じた(モノマー変異体においてより溶媒に露出する)領域は、既報のX線結晶構造から判断される PPI 界面の領域とよく整合した。この時負に転じた領域は、ホモ二量体の重水素交換率からホモ二量体に PPI 阻害剤を添加した場合の重水素交換率を差し引いた場合においても似通った変化が見られた(図4e)ことから、阻害剤の PPI 界面への寄与が示唆された。関与するペプチドの重水素交換率においても、阻害剤の添加によって界面領域の重水素交換率が経時的かつ有意に上昇していることを確認した(図4f)。
なお、HDX-MS においては全ての PPI 界面において重水素交換率に差が生じるわけではないことも多い。実際、筆者らのホモ二量体化蛋白質の測定事例においても、いくつかある PPI 界面の内、高い柔軟性を有すると思われるアミノ酸領域は、モノマーとダイマーの重水素交換率で差が見られなかった。この部分は水素と重水素の交換が素早く、検出するのが困難だったものと考えられる。
工夫とコツ
・翻訳後修飾された蛋白質の測定に関して
サンプルによっては大腸菌発現系でなく、哺乳細胞発現系での調製により翻訳後修飾されていることも想定できる。翻訳後修飾されたアミノ酸を含むペプチド領域は Proteome Discoverer 2.2 にて同定は可能であるが、その後の HDExaminer による解析において、あるペプチド鎖に対して固定された修飾としてしか設定できないため、解析にはやや不向きである。
・システイン残基を多く含む蛋白質に関して
筆者らの経験から、システイン残基を多く含む蛋白質はデータや解析結果の質が低下する傾向にある。システイン残基による非特異的なジスルフィド結合が蛋白質の凝集や望ましくない変性状態を誘発している可能性があると思われる。
・低分子の測定への影響
本記事においては PPI 阻害剤として低分子を選択していた。しかし一般的には低分子はイオン化効率や、ひいては水素重水素交換反応にも影響を与える可能性がある。実際筆者らの実験例でも高濃度化合物を添加した場合の MS のデータクオリティが悪くなる事例が多発した。
・温度管理
HDX-MS 測定ではいくつかのシステムを低温で管理する。これは重水素に交換された状態を維持する(Back exchange を抑える)ためである。筆者らの場合は重水交換させるトレイ(図2b)は10℃、クエンチ反応用トレイ(図2c)は0℃、ペプシンカラム(図2d)は8℃、分離カラムなどを収納したチャンバー(図2e)は2℃に設定している。そのために、水滴や霜が発生しやすい。それらは、定期的に除去することが望ましい。
・Quenching bufferの析出
Quenching buffer には高濃度の TCEP が含まれている。TCEP は低温条件で容易に析出するため、0℃のトレイでなく、10℃のトレイに設置する。
・ペプシンカラムの劣化
蛋白質消化に用いられるペプシンカラムは消耗品であり、その劣化はそのまま検出できるペプチドの数に影響する。筆者らは定期的にシトクロム C など標品サンプルを用いて検出されるペプチドの数が減少していないか確認している。同じ測定条件で測定し、標品において検出されるペプチド数が減ってきた場合、ペプシンカラムを交換したほうがよい。
・データの質を向上させるには
- 調製した蛋白質溶液は測定直前に 0.2 μm フィルターもしくは遠心処理してゴミや凝集物を出来る限り除去する。
- 蛋白質の濃度は最大でも 2.0 mg/mL ほどに収めるのがよい。高濃度の蛋白質をサンプルとして使用した場合、蛋白質の凝集によりペプシン流路やカラム内でつまりが発生したり、ペプシンカラムの限界容量を超えてしまったりすることで測定や解析に支障が出たり、測定が滞ったりする可能性がある。
実験の安全
- 以下の薬品は各物性を把握した上で注意して取り扱う。
- 水酸化ナトリウム…強塩基
- Urea、グアニジン塩酸塩…蛋白質変性剤、塩基
- TCEP…強力な還元剤、酸
- ギ酸…有機酸であり、強酸
- アセトニトリル…可燃性の有機溶媒
- Q Exactive HF-X mass spectrometer のイオントランスファーチューブ部分は高温になるため、洗浄に際しては十分温度が下がったことを確認する。
文献
- Scott D. E., et al., Nat. Rev. Drug Discov., 16, 533–550 (2016)
- Bosch J., Drug Discov. Today, 24, 3–9 (2014)
- Heck A. J. R., Nat. Methods, 5, 927–933 (2008)
- 石井健太郎ら, 蛋白質科学会アーカイブ, 11, e090 (2018)
- Wei H., et al., Drug Discov. Today, 19, 95–102 (2014)
- Houde D., et al., Anal. Chem., 81, 2644–2651 (2009)
- Eguchi A., et al., Biotechnol. Bioeng., 116, 1742–1751 (2019)
- Houde D., et al., J. Pharm. Sci., 100, 2071–2086 (2011)
- Wu D., et al., Nat. Chem. Biol., 15, 367–376 (2019)
- Senoo A., et al., Commun. Biol., 4, 1041 (2021)
謝辞
本プロトコールを作成するにあたり、サーモフィッシャーサイエンティフィック株式会社の永島良樹様、渡辺史生様、肥後大輔様に多大なご協力を賜りました。また、プロトコール作成に関連する研究は国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業創薬等先端技術支援基盤プラットフォーム(BINDS)の課題番号 JP20am0101094、JSPS 科研費 JP20H02531、JP18H02082、JP18H05425、JSPS 特別研究員奨励費 JP19J14451 の助成を受けたものです。心より感謝申し上げます。
-
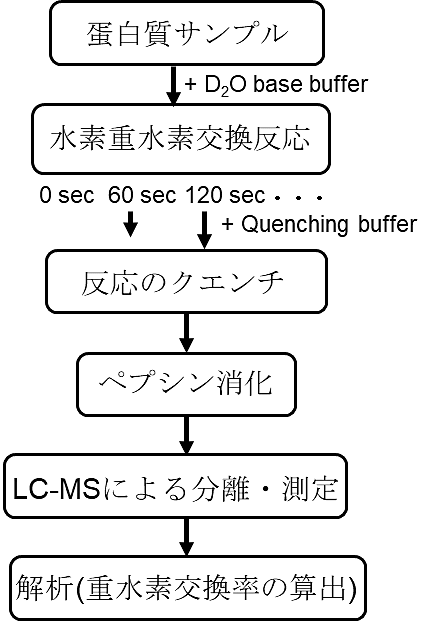
図1:HDX-MS の測定フロー -

図2:HDX-MS のシステム。(a)HPLC ポンプ類。(b)~(f)HDx-3PAL システム。(b)重水反応用トレイ置き場。(c)クエンチ反応用トレイ置き場。(d)ペプシンカラム。(e)分離カラム格納チャンバー。(f)質量分析計。(g)Chronos 制御を行うパソコン。 -

図3:ペプチドの sequence converge を HDExaminer で表示させた例。数字はアミノ酸残基番号。数字に対応したバーが検出されたペプチドを示している。検出されたペプチドの信頼度に応じて緑色もしくは黄色となる(緑色の方が信頼度が高い)。この事例においては90%近い sequence converge が得られている。 -
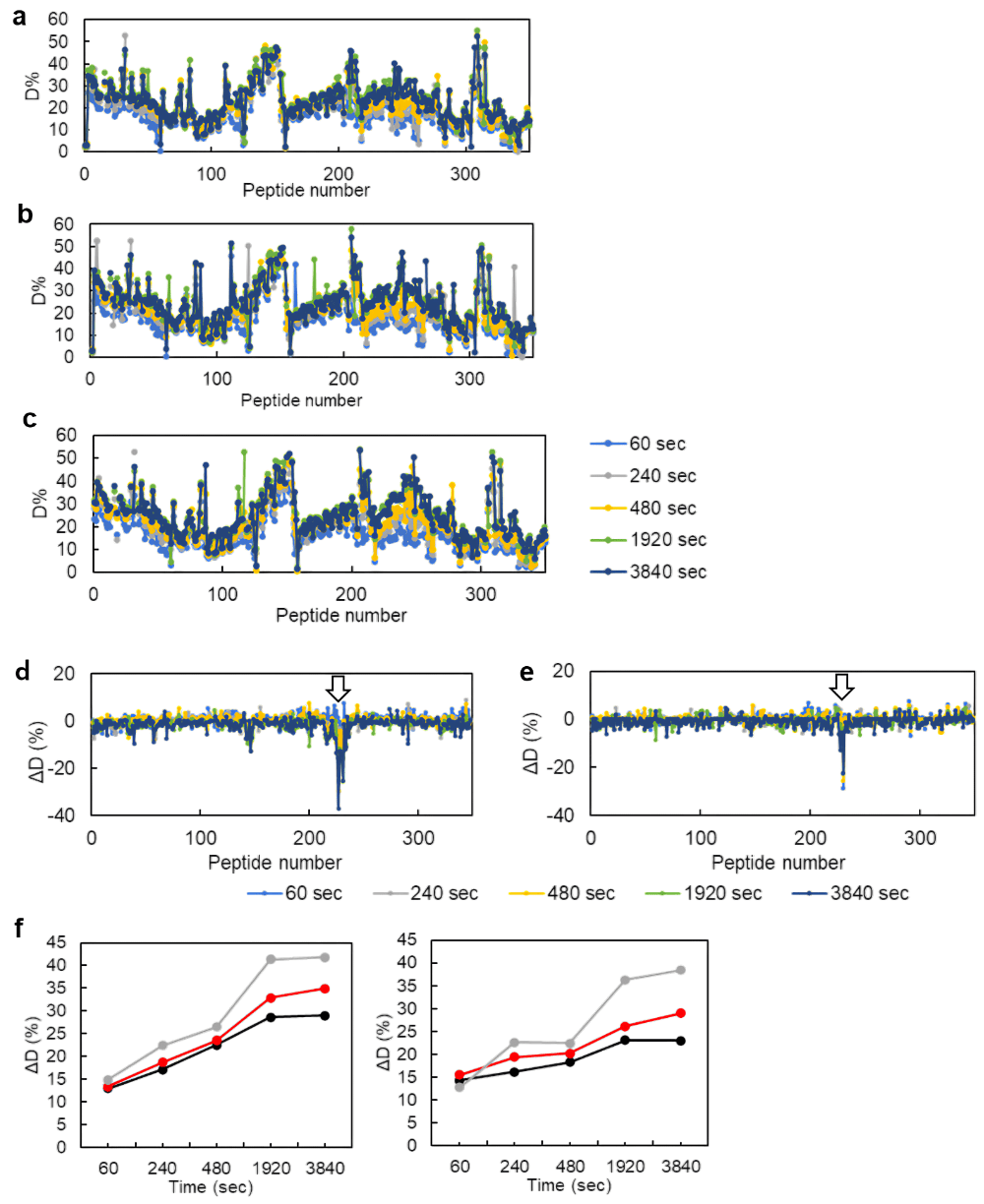
図4:PPI の検出事例。(a)ホモ二量体、(b)阻害剤入りホモ二量体、(c)モノマー変異体における各ペプチド番号における重水素交換率。(d)ホモ二量体よりモノマー変異体の重水素交換率を引いた差分。(e)ホモ二量体より阻害剤入りホモ二量体の重水素交換率を差し引いた差分。矢印の部分で差分が歩に転じた。(f)界面付近の二種のペプチドに関する重水素交換確率の経時変化。黒:ホモ二量体、赤:阻害剤入りホモ二量体、灰色:モノマー変異体。Senoo et al., Commun. Biol. 4, 1041 (2021) より一部改変し引用。


