概要
ウエスタンブロッティングとは、電気泳動で分離した蛋白質をニトロセルロース膜等に転写し、抗体で目的蛋白質のみを発色させる手法のことである。混合物中に特定の蛋白質が存在するかどうかを迅速かつ高感度に検出できるので、組換え型蛋白質の発現チェックや、生体組織における特定蛋白質の存在確認等に頻繁に利用される。また、抗リン酸化ペプチド抗体による蛋白質のリン酸化解析や、特定のアミノ酸配列に結合する抗体を用いた構造解析など、工夫次第で非常に多くの知見が得られる。本稿では、迅速さと経済性に優れたセミドライ式による操作手順をまず紹介する。次に、タンク式との比較や発色方法の選択、Nativeゲルや尿素ゲルから転写する際の注意点について解説する。
装置・器具・試薬
- セミドライ式ブロティング装置と専用電源(各社)
- プラスチックトレー 6個:トレーA, B1, B2, C, M, Wとラベルする。 [*1]
- ろ紙: ゲルと同じサイズのもの6枚
- PVDF(poly vinilidene difluoride)膜: ゲルと同じサイズのもの1枚 [*2]
- Buffer A: 300 mM Tris base-10%メタノール [*3]
- Buffer B: 25 mM Tris base-10%メタノール [*3]
- Buffer C: 25 mM Tris base-10%メタノール-40 mM 6-アミノカプロン酸 [*3]
- TBS: 150 mM NaCl-25 mM Tris-HCl, pH 7.4
- Washing buffer: TBS +1/1000容のTween 20 [*4]
- Blocking buffer: 5% スキムミルクin Washing buffer, 用時調製 [*5]
- BCIP-NBT溶液キット: ナカライテスク社製03937-60
【Tips】
*1: CBB染色など他の用途に使用しているトレーと混合使用せずウエスタン専用にする。また、抗体や試薬の節約のため、トレーはゲルより一回り大きい程度が良い。
*2: カットする際は必ず手袋を着用し、水色のスペーサー紙と一緒に切る。節約のため、サイズを「縦=ゲルと同じ, 横=必要なレーンをカバーできる長さ」にしても良い。
*3: 低分子量の蛋白質を転写する場合はメタノールを20%にする。→【工夫とコツ、転写bufferのメタノール濃度を参照】
*4: 大量に使用するので、頻繁にウエスタンを行う研究室は、10 L調製して蛇口付きポリタンクに保存しても良い。
*5: スキムミルクは雪印乳業社製がお勧め。
実験手順の概要:セミドライ半日コース
電気泳動(SDS-PAGE)
↓
ゲルの洗浄・平衡化 [15分]
↓
膜への転写 [20分]
↓
膜の洗浄 [1分]
↓
膜のブロッキング [15分]☆
↓
膜の洗浄 [1分]
↓
一次抗体の結合 [45分]
↓
膜の洗浄 [9分]★
↓
二次抗体の結合 [45分]★
↓
膜の洗浄 [15分]
↓
バンドの発色(BCIP-NBT) [2分]
☆抗体がスキムミルクと交叉する場合はブロッキング剤を変える(BSAやゼラチンなど)
★一次抗体に発色酵素が付加されている場合は不要なステップ
実験手順の詳細
両手には必ずグローブを着用し、PVDF膜はピンセットで扱うこと。
- 各トレーに以下の試薬を入れる(量は底面積約100cm2のトレー使用時の目安)。
- トレーA :約50 mlのbuffer A
- トレーB1 :約100 mlのbuffer B
- トレーB2 :約50 mlのbuffer B
- トレーC :約50 mlのbuffer C
- トレーM :PVDF膜が浸る程度の100%メタノール
- トレーW :約50 mlのWashing buffer
- PVDF膜をトレーMに浸した後、トレーB1に入れ10分以上振とうする。
- 電気泳動終了後、ゲルを取り出し、トレーB2に浸して15間分振とうする。[*6]
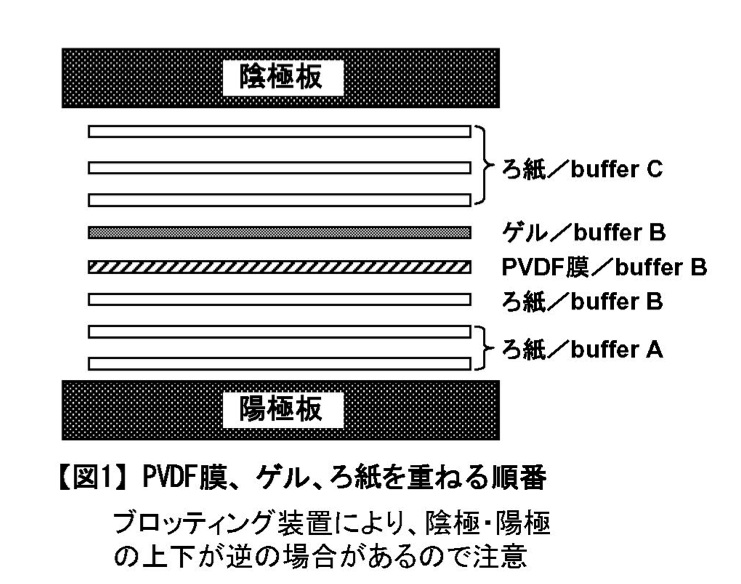
- ろ紙をトレーAに2枚、トレーB1に1枚、トレーCに3枚入れる。
- ブロッティング装置の電極版を純水で湿らし、余分な水分をキムタオルで拭う。
- [図1]のようにPVDF膜、ゲル、ろ紙を重ねる。この時、上側の電極板を置く前に、手で(グローブ着用!)ろ紙の上を中心から外へ押し伸ばし、空気を追い出すこと。
- 定電流で、ゲルの面積(cm2)×2.5 mAの電流を、20分間通電する。[*7]
- 転写終了後、PVDF膜を蛋白質が転写された側を上にして、トレーWに入れる。[*8]
- 手で軽く振って(約1分)膜をWashing bufferで洗浄する。また、ゲルはCBB染色し、転写が上手くいったかどうか確認する。
- Washing bufferを捨て、約50 mlのBlocking bufferを入れて、室温で5分間シェーカー上で振とうする。同操作を、Blocking bufferを入れ替えて合計3回繰り返す。
- Blocking bufferを捨て、約50 mlのWashing bufferを入れて手で軽く振り(約1分)、膜を洗浄する。
- Washing bufferを捨て、一次抗体を添加した10 mlのBlocking bufferを入れて、室温にて45分間(抗体の力価により要調整)シェーカー上で振とうする。この時、bufferがムラ無く膜に行きわたるよう、振とう方法に注意する。[*9]
- Blocking bufferを捨て、約50 mlのWashing bufferを入れて手で軽く振り(数秒)膜を洗浄する。その後このbufferを捨てる。
- 約100 mlの Washing bufferで3分間振とうして膜を洗浄し、bufferを捨てる。この操作を3回繰り返す。
- Washing bufferを捨てた後、二次抗体を添加した10 mlのBlocking bufferを入れて、室温にて45分間(抗体の力価により要調整)シェーカー上で振とうする。
- 上記(13)(14)と同様にして膜を洗浄する。
- 約100 mlのTBSで3分間振とうして膜を洗浄する。この操作を2回繰り返す。
- TBSを捨て、BCIP-NBT溶液キット付属のALP bufferを5 ml入れた後、50μlのBCIP-NBTを加えて、発色が見られるまで手で振る。その後、純水で洗浄して風乾する。
【Tips】
*6:長くbufferに浸し過ぎるとゲルがふやけ、蛋白質が拡散する。極力15分を厳守する。
*7:通電時間は適宜調整する。
*8★重要★以後の操作も、PVDF膜は必ず蛋白質が転写された側を上にして行う。
*9:回転式よりも水平振幅式やシーソー式の方が良い。
工夫とコツ
ブロッティング装置:タンク式とセミドライ式
タンク式の短所として、「大量のbufferが必要」「大電流が流せる電源が必要」「冷却装置が必要」などがよく挙げられるが、筆者が思う一番の短所は、「転写に要する時間が長く、電気泳動を含めると全操作を一日で終えるのが難しい」点である。タンク式でウエスタンを行う際は、かなり気合を入れて朝から取り掛かるか、結果を得るのに二日かかるかのいずれかである。一方で、セミドライ式よりも転写効率が良く、高分子量の蛋白質や塩基性蛋白質の場合はタンク式を選択せざるをえない。また、アガロースゲルから転写する場合も、やはりタンク式を使用することになる。
転写bufferのメタノール濃度
メタノールは蛋白質の膜への吸着を高めるが、一方で、蛋白質をゲル中に固定して抜け難くする。従って、転写効率が悪い場合はメタノール濃度を5%くらいまで下げると改善する(ただしPVDF膜使用の場合のみ可能。ニトロセルロース膜では不可)。逆に、膜を通り抜ける恐れがある低分子量のペプチドなどを転写する場合は、メタノール濃度20%に上げる。また、通電時間の長いタンク式では20%が一般的である。
PVDF膜とニトロセルロース膜
PVDF膜はニトロセルロース膜に比べ高価である。しかし、蛋白質の吸着量・保持力ともPVDF膜の方が優れており、まずはPVDF膜を選択することをお勧めする。ニトロセルロース膜を使用する場合は、蛋白質の吸着力を高めるため、メタノール濃度を20%に上げる。
Nativeゲルのウエスタンブロッティング
ウエスタンブロッティングのプロトコールを取り上げる参考書やウェブサイトは非常に多いが、そのほとんどがSDSゲルからの転写である。この方法はNativeゲルにも適用可能であろうか?
SDS-PAGEとNative-PAGEとでは、泳動蛋白質の電荷が大きく異なる。SDS-PAGEでは、蛋白質にSDSが結合しているため、Native-PAGEのサンプルよりも大きな負電荷を持つ。即ち、Nativeゲルからの転写はSDSゲルからよりも効率が悪い。従って、工夫する点は以下の4つである。
- メタノール濃度を0~5%にする。
- 転写の通電時間を「少し」長くする:ただし、メタノール濃度を下げるので、長すぎると蛋白質が膜を通り抜ける恐れがある。
- PVDF膜を使用する:メタノール濃度を下げるので吸着力が劣るニトロセルロース膜は避ける。
- タンク式を試す:ただし、メタノール濃度は0~5%にする。
まずは、セミドライ式-5%メタノール-PVDF膜の系で試し、上手くいかない場合はメタノール濃度を0にする。更に通電時間を60分に延ばし、それでもダメな場合はタンク式を試すという手順で筆者は検討している。また、尿素を含むゲルを転写する場合は、ゲルを25 mM Trisで3分間×3回洗浄してから、Nativeゲルと同様の転写操作を行う。
発色方法
本稿で取り上げたBCIP-NBT法は、発色酵素がAP(alkaline phosphatase) の場合にのみ適用できる。発色酵素がHRP(horseradish peroxidase)の場合はDAB法で発色させる。BCIP-NBT法の方がDAB法よりも発色が良く退色も遅いが、APを含む生体組織の分析には利用できない。
BCIP-NBT法、DAB法ともに、明確にバンドを検出するには0.1μg程度の蛋白質量が必要であるが、最近は化学発光(Chemiluminescence)を利用した様々な発色キットが販売されており、これらを利用するとピコグラムレベルの蛋白質量でも検出可能である。しかし、化学発光を検出するには、X線フィルムで感光するか、専用のライトキャプチャー等が必要で、キットの価格を含めて高コストである。また、露出時間や感度の調節等も意外に難しく、1回の撮影で思惑通りの画像が得られることは少ない。
化学発光を利用する場合は、膜に転写する蛋白質が微量であるため、オーバーブロッキング(目的蛋白質の上にブロッキング蛋白質が結合してしまうこと)が起こる可能性が高まる。よって、スキムミルクの濃度を0.3~0.5%くらいに下げ、室温にて1時間かけてブロッキングを行う。
参考文献
- Kyhse-Andersen, J., J. Biochem. Biophys. Methods, 10, 203-209 (1984)
- Sambrook, J., et al., A laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (1989)