概要
IF-FISH法とは、免疫蛍光染色(immunofluorescence,IF)と蛍光in situハイブリダイゼーション(fluorescence in situ hybridization,FISH)を同時に行うことで、細胞内の蛋白質と核酸の両方を検出する手法である。本プロトコールでは、IF-FISH法によりmRNAと翻訳ペプチドを1分子感度で可視化することで、細胞内のmRNA一つ一つの翻訳活性をin situイメージングする手法について紹介する。
イントロダクション
はじめに、本手法の原理について簡単に説明したい。本手法は人工的なレポーターmRNAを利用したものであり、1種類のmRNAに対して40種類ほどの蛍光プローブをハイブリダイズするsingle-molecule FISH(smFISH)(文献1,2)により、mRNAを1分子感度で検出することができる。また、このレポーターmRNAの翻訳領域には、酵母由来のGCN4エピトープが20回ほど反復したSunTagペプチド(文献3)がコードされており、GCN4抗体を用いたIFにより、翻訳ペプチドを1分子感度で検出することができる。GCN4エピトープはフォールディングを必要としないため、mRNAから合成されてリボソームから出てきたばかりの翻訳ペプチドを検出することができ、このmRNA上に観察されるSunTagシグナルが翻訳活性にあたる(文献4,5)。こうした原理により、mRNAをsmFISHで、翻訳ペプチドをIFで、それぞれ1分子感度で可視化することで、細胞内のmRNA一つ一つの翻訳活性をin situイメージングすることができる。本プロトコールでは、レポーターmRNAを発現するヒト由来のU2OS細胞(文献5)を例に、IF-FISH法によりmRNAと翻訳ペプチドを可視化する具体的な手順をまとめる。なお、U2OS細胞は培養が容易で接着性も高く、RNAイメージングの領域でよく使用されているが、本プロトコールは他の細胞にも広く転用することができる。
装置・器具・試薬
装置
- ボルテックス
- インキュベーター
- シェーカー
器具
*滅菌処理したものが望ましい
- 24ウェルプレート
- カバーグラス(0.17 mm)
- パラフィルム
- 10 cmディッシュ
- 15 cmディッシュ
- キムワイプ
- ピンセット
- スライドグラス
試薬
*RNaseフリーのものが望ましい
- パラホルムアルデヒド(PFA)(有害性あり)
- リン酸緩衝液(PBS)
- Triton X-100
- 水
- Saline-sodium citrate緩衝液(SSC)
- ホルムアミド(有害性あり)
- ウシ血清アルブミン(BSA)
- RNase inhibitor(Thermo Fisher,AM2696を推奨)
- tRNA
- デキストラン硫酸ナトリウム(Merck,D8906を推奨)
- smFISHプローブ(文献5)
- 一次抗体(文献5)
- 二次抗体(文献5)
- マウンティング溶液(Thermo Fisher,P36971を推奨)
実験手順
- 細胞の固定と透過処理
- プリハイブリダイゼーション
- ハイブリダイゼーションと一次抗体処理
- 二次抗体処理
- マウンティング
実験の詳細
1. 細胞の固定と透過処理
IF-FISHを行うための事前準備として、レポーターmRNAを発現するU2OS細胞をカバーグラスに接着させておく。U2OS細胞の場合、24ウェルプレートにカバーグラスを1枚ずつ入れ、細胞懸濁液を加えれば、数時間でカバーグラスに接着する。接着性が低い細胞を使用する場合は、カバーグラスをコラーゲン処理することを推奨する。細胞がカバーグラスに接着したら、まず、細胞を固定する。具体的には、24ウェルプレートから培地を除き、4% PFAを加え、室温で10分間インキュベートする。この時、IF-FISHの効率が低下する原因になるため、固定時間が長くなり過ぎないよう注意する。固定が終わったら、細胞を1×PBSで3回洗う。次に、細胞の透過処理を行う。具体的には、24ウェルプレートから1×PBSを除き、0.1% Triton X-100を加え、室温で10分間インキュベートする。透過処理が終わったら、細胞を1×PBSで3回洗う。
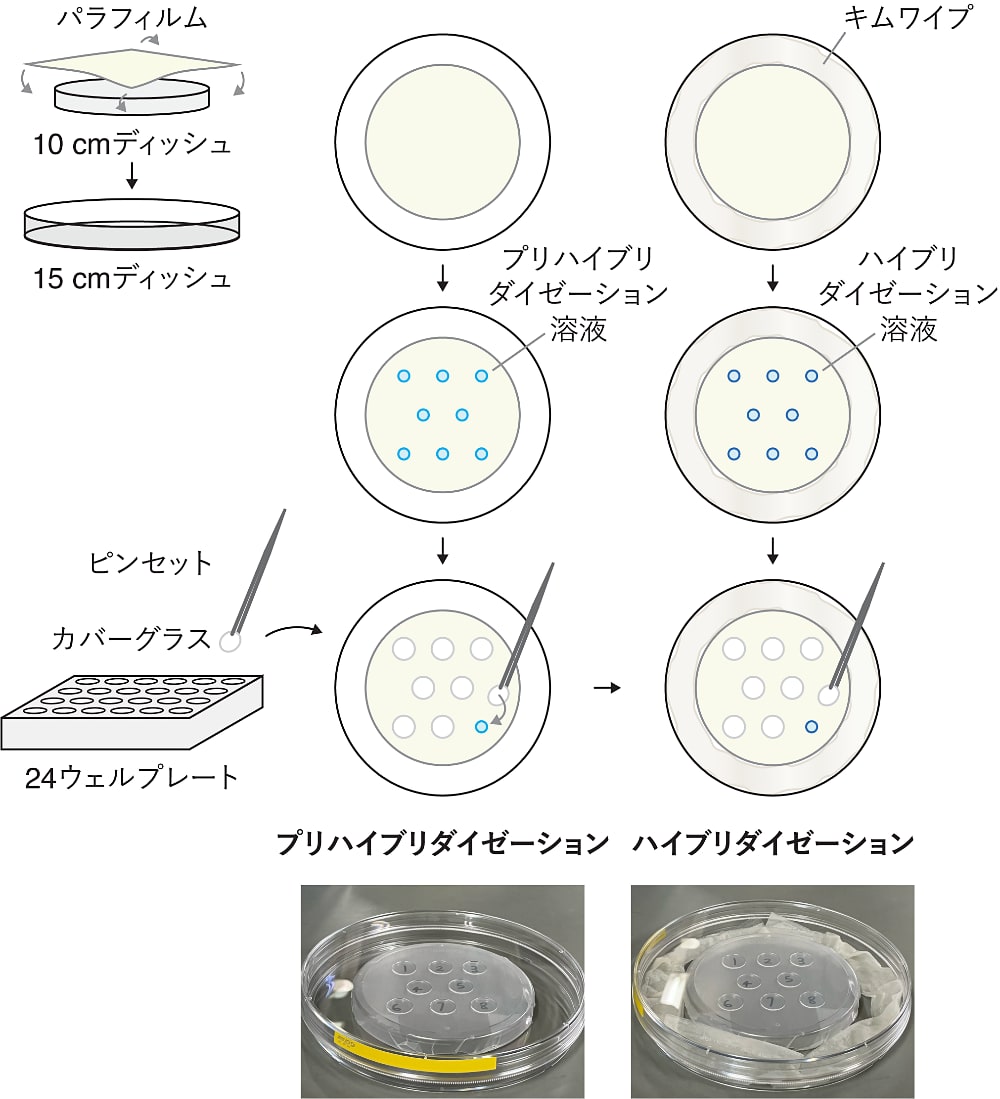
以上の作業中に、IF-FISH用のチャンバーを準備しておく。IF-FISHに使用する試薬はsmFISHプローブをはじめ高額なものが多い。そこで、我々は試薬の使用量を減らすため、そのまま24ウェルプレート内でIF-FISHするのではなく、自作のチャンバー上にIF-FISH溶液を少量滴下し、その上に反転させたカバーグラスを乗せている(図1)。この方法だと、試薬の使用量を1/5ほどに節約することができる。IF-FISH用のチャンバーは以下のようにして、プリハイブリダイゼーション用と、ハイブリダイゼーション用に2つ準備している。
- まず、10 cmディッシュの蓋をパラフィルムで覆う。パラフィルムの表面が平らになるよう四隅を均等に引っ張り、蓋にしっかり固定する。
- 次に、パラフィルムで覆った10 cmディッシュの蓋を、15 cmディッシュの中央に置く。プリハイブリダイゼーション用はこれで完成である(図1左)。
- さらに、ハイブリダイゼーション用については、15 cmディッシュの隙間に水で浸したキムワイプを敷きつめる(図1右)。プリハイブリダイゼーションは室温で30分間の処理である一方、ハイブリダイゼーションは37℃で3時間の処理となる。そのため、この一手間を惜しむと、ハイブリダイゼーション溶液が蒸発してしまい、ムラのある染色結果となる。
2. プリハイブリダイゼーション
次に、細胞をプリハイブリダイゼーション溶液で平衡化する。具体的には、まず、RNaseフリーの水を用いて、以下の組成になるようにプリハイブリダイゼーション溶液を調製する。
- 2×SSC
- 10%ホルムアミド
- 0.5% BSA
- RNase inhibitor(我々は、Thermo Fisher AM2696を、40 U/mLで使用)
溶液が調製できたら、準備したチャンバー(プリハイブリダイゼーション用)の上にプリハイブリダイゼーション溶液を50 µLずつ滴下する(図1左)。この時、細胞が不均一に処理される原因になるため、気泡が入らないよう注意する。次に、24ウェルプレート内のカバーグラスをピンセットで持ち上げ、カバーグラスの端をキムワイプに軽く触れさせて余分な水分を除く。そして、カバーグラスの細胞側が下になるように反転させ、滴下したプリハイブリダイゼーション溶液の上に乗せる。ここでもやはり、細胞が不均一に処理されることを避けるべく、気泡が入らないよう注意する。最後に、15 cmディッシュの蓋を被せて、室温で30分間インキュベートする。この段階では、蛍光標識された試薬は入っていないため、我々は特に遮光していない。
3. ハイブリダイゼーションと一次抗体処理
続いて、レポーターmRNAにsmFISHプローブをハイブリダイズさせ、同時に、翻訳ペプチド(SunTag)を一次抗体でラベルする。具体的には、まず、RNaseフリーの水を用いて、以下の組成になるようにハイブリダイゼーション溶液を調製する。なお、デキストラン硫酸ナトリウムは粘性が非常に高く、溶液を均一に混ぜる上で厄介な試薬である。そこで、我々は1 – 7までを調製し均一に混ぜてから、そこにデキストラン硫酸ナトリウムを加え、最後にボルテックスを十分かけるようにしている。ハイブリダイゼーション溶液が均一に混ざっていないと、smFISHプローブや一次抗体が均一に行き渡らず、ムラのある染色結果となる。なお、smFISHプローブは蛍光標識されているため、手早く作業し、光に長時間あてないよう注意する。
- 2×SSC
- 10%ホルムアミド
- 0.05% BSA
- RNase inhibitor(我々は、Thermo Fisher AM2696を、40 U/mLで使用)
- 1 mg/mL tRNA
- 50 nM smFISHプローブ
- 一次抗体(1/100希釈)
- 10%デキストラン硫酸ナトリウム
溶液が調製できたら、準備したチャンバー(ハイブリダイゼーション用)の上にハイブリダイゼーション溶液を50 µLずつ滴下する(図1右)。この時、細胞が不均一に処理される原因になるため、気泡が入らないよう注意する。次に、プリハイブリダイゼーション溶液上のカバーグラスをピンセットで持ち上げ、カバーグラスの端をキムワイプに軽く触れさせて余分な水分を除く。そして、カバーグラスの細胞側が下になる向きのまま、滴下したハイブリダイゼーション溶液の上に乗せる。ここでもやはり、細胞が不均一に処理されることを避けるべく、気泡が入らないよう注意する。最後に、15 cmディッシュの蓋を被せて、37℃で3時間インキュベートする。この時、インキュベーターが遮光できない仕様である場合は、チャンバーをアルミホイルなどで覆い遮光する。なお、このタイミングで、次の手順で使用する2×SSC,10%ホルムアミド溶液を調製し、37℃インキュベートに入れて温めておくと、以降の実験がスムーズに進む。
4. 二次抗体処理
続いて、翻訳ペプチド(SunTag)に結合させた一次抗体を、蛍光標識した二次抗体で可視化する。具体的には、まず、温めておいた2×SSC,10%ホルムアミド溶液(以下、SSCホルムアミド溶液)で細胞を3回洗う。参考までに、我々の方法を以下に紹介する。
- 新しい24ウェルプレートに、SSCホルムアミド溶液を分注する。
- ハイブリダイゼーション溶液上のカバーグラスをピンセットで持ち上げ、カバーグラスを細胞側が上になるように反転させ、24ウェルプレート内のSSCホルムアミド溶液に浸す。
- 24ウェルプレート内で、SSCホルムアミド溶液で細胞を2回洗う。
細胞の洗浄が終わったら、次に、蛍光標識した二次抗体をSSCホルムアミド溶液で1/1000希釈し、二次抗体溶液を調製する。そして、24ウェルプレートからSSCホルムアミド溶液を除き、二次抗体溶液を加える。最後に、24ウェルプレートの蓋を被せて、37℃で30分間インキュベートする。ハイブリダイゼーションの時と同様に、インキュベーターが遮光できない仕様である場合は、24ウェルプレートをアルミホイルなどで覆い遮光する。
5. マウンティング
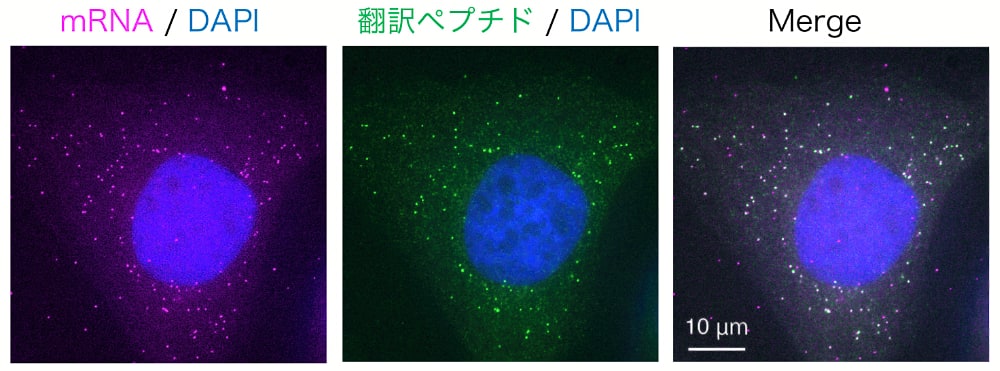
最後に、mRNAと翻訳ペプチドを可視化した細胞をマウンティング溶液で封入し、蛍光イメージング用のスライドを作成する。具体的には、まず、二次抗体処理した細胞を2×SSCで3回洗う。なお、我々は洗浄の効率を高めることを目的に、3回目の洗浄については遮光した状態でシェーカーに乗せ、10分間ほど穏やかに撹拌している。細胞の洗浄が終わったら、次に、スライドグラスの上にマウンティング溶液を15 µLずつ滴下する。続いて、24ウェルプレート内のカバーグラスをピンセットで持ち上げ、カバーグラスの端をキムワイプに軽く触れさせて余分な水分を除く。そして、カバーグラスの細胞側が下になるように反転させ、滴下したマウンティング溶液の上に乗せる。ここでもやはり、気泡が入らないように注意する。最後に、そのスライドを遮光した状態で一晩置き、マウンティング溶液を硬化させれば、蛍光イメージング用のスライドの完成である。このスライドを蛍光顕微鏡にセットすれば、mRNAと翻訳ペプチドがそれぞれ1分子感度で可視化された細胞をその目で見ることができる(図2)。
工夫とコツ
カバーグラスの取り扱い
カバーグラスは厚さ0.17 mmのものを使用する。カバーグラスをピンセットで持ち上げる際は、カバーグラスが割れないように優しく掴む。カバーグラスを思うように持ち上げられない時、イライラして無理やり持ち上げようとすると、高確率で割れる。カバーグラスの取り扱いは、心を穏やかに保つことがコツである。
細胞の取り扱い
細胞は乾燥すると構造が壊れてしまう。IF-FISHの手順には、古い溶液を除き、新しい溶液を加える、といった作業が多々あるが、いずれの手順も手早く行う。例えば我々は、左手で古い溶液を除き、右手で新しい溶液を加えるようにしている。IF-FISHの手順には、カバーグラスの端をキムワイプに軽く触れさせて余分な水分を除く作業があるが、これも入念に行うのではなく手早く行う。
また、細胞がカバーグラスから剥がれる原因になるため、細胞に強い力がかかることも避けたい。細胞をPBSなどで洗う際、あるいは新しい溶液を加える際は、穏やかに溶液を加えるようにする。例えば我々は、ウェルの壁づたいに溶液をゆっくり加えるようにしている。
RNAの取り扱い
RNAは分解されやすい物質であるため、IF-FISHを行う際はRNaseのコンタミネーションが起こらないよう注意する。IF-FISHに使用する一連の試薬はRNaseフリーのものを使用することが望ましい。また、IF-FISHの一連の作業は、素手ではなくグローブをして行う。
蛍光標識試薬の取り扱い
IF-FISHでは、smFISHプローブと二次抗体が蛍光標識されている。これらの試薬自体、これらの試薬を加えた溶液、これらの試薬で処理した細胞などは、蛍光の褪色を防ぐために、光に長時間あてないよう注意する。作成した蛍光イメージング用のスライドも、蛍光顕微鏡で観察するまでは遮光しておく。
実験の安全
PFAは、GHS分類における物理化学的危険性は指摘されていないが、健康有害性および環境有害性がある。また、ホルムアミドについても、GHS分類における物理化学的危険性および環境有害性は指摘されていないが、健康有害性があり、消防法における危険物第四類引火性液体第三石油類 水溶性液体にもあたる。そのため、IF-FISHを安全に行うためには、各研究室の責任のもとに、各研究室の実験環境を踏まえて適切にリスクアセスメントを行う必要がある。
文献
- K Femino, A. M. et al., Science, 280, 585–590 (1998).
- Raj, A.et al., Nat. Methods, 5, 877–879 (2008).
- Tanenbaum, M. E. et al., Cell, 159, 635–646 (2014).
- Wu, B. et al., Science, 352, 1430–1435 (2016).
- Kobayashi, H. & Singer, R. H., Nat. Commun., 13, 1435 (2022).