概要
逆相HPLC(high performance liquid chromatography)カラムは、立体構造の変性が問題になりにくいペプチドの精製で幅広く用いられているが、蛋白質の精製にも、立体構造の変性が可逆な場合や、変性が以後の実験で問題にならない場合に利用されている。本稿では、蛋白質を対象とした精製への逆相 HPLC の利用法について、初心者が迷いやすい点を中心に概説する。なお、逆相 HPLC 精製は一般に専用の装置を用いて行い、1回の精製は数時間以内で可能である。
目的・イントロダクション
逆相HPLC精製に用いられるカラムには、基材に疎水性の強い官能基(C4, C8, C18(オクタデシル、ODSとも呼ばれる)などの直鎖アルキル官能基、芳香族官能基のフェニルなど)が共有結合した担体を充填したものが用いられる。この疎水性の担体に対して吸着したペプチド・蛋白質を、その疎水性の違いにより有機溶媒で分離、溶出する。逆相HPLCは、様々な化学物質の分離・精製に広く用いられる方法であるが、蛋白質の精製には、比較的限られた種類のカラムと溶媒系が用いられることが多い。一般には、蛋白質分子が浸入可能な比較的大きな孔径(200-300Å以上でワイドポアと呼ばれる)のシリカまたはポリマーの基材がプレパックされたカラムを用いて、溶媒としては、水、アセトニトリルのそれぞれに0.1%程度のTFA(トリフルオロ酢酸)を加え、リニアグラジエントで混合して利用する系が多用されている。また、逆相HPLCによる精製では、高い分離能を達成するために数μm-10μm程度の粒子径の小さい担体が使われるため、高圧送液ポンプを含む専用の装置が一般に用いられる。装置は、ポンプの他に、溶媒の混合比を経時的に変化させてグラジエント溶出を行うコントローラーとミキサー、試料をカラムに添加するためのサンプルループを備えたインジェクター、溶出した蛋白質を検出するためのUVディテクター等が備えられているのが一般的であるが、必要に応じて、脱気装置やオートサンプラー、各種ディタクター、パソコンを利用してデータ管理が容易なワークステーションなど様々な装置構成が可能である。
ポンプ等の装置構成にもよるが、蛋白質の純度を確認するための分析から、試料精製を目的とした分取まで幅広い実験に使用される。逆相HPLC担体は非常に多種類が発売されているが、蛋白質の精製に限れば、ワイドポアの担体を使用することになり、各社とも発売しているカラムの種類はそれほど多くないため、選択の範囲を絞ることができる。以下に、4.6×250mm程度の一般的な逆相HPLC用カラムを用いて著者のグループが行っている蛋白質の精製の手順(1,2)を例示する。
装置・器具・試薬
- HPLC用装置(各社)
- デガッサー(各社)
- HPLC用ポンプ(各社)
- グラジエントコントローラー(各社)
- ミキサー(各社)
- インジェクター(各社)
- UVディテクター(各社)
- インテグレーター(各社)またはワークステーション(各社)
- フラクションコレクター(各社)
- インジェクト用シリンジ(各社)
- サンプルフィルター(各社)
- 超純水
- HPLCグレード アセトニトリル(各社)
- HPLCグレード TFA(各社)
実験手順
1)溶媒の準備
2)カラムの取り付け・平衡化
3)試料調製
4)試料の添加と溶出
実験の詳細
1) 溶媒の準備
蛋白質の逆相HPLC精製では、水とアセトニトリルのリニアグラジエントによる分離が用いられることが多い。アセトニトリルには、圧力上昇の原因となる粘度が低い、水との混合による気泡の発生が起こり難いなど、すぐれた点が多く、条件検討の際に参考となる使用例も非常に多いため、最も使いやすい溶媒と考えて間違いない。目的物質の溶出の検出には、トリプトファンやチロシンを含まないペプチドの精製では、210nm付近の吸収を利用することが多く、吸収をもつ有機物質の溶媒への混入が検出の障害となるため、HPLCグレードとして市販されている溶媒が使用されることが多い。非常に粒子径の小さいプレパックのカラムを使用することがほとんどであるため、溶媒へのゴミの混入はカラムの詰まり・圧力上昇の原因となり致命的であり、HPLCグレードの試薬を使用しない場合には、0.45μm等のフィルターによる溶媒のろ過が必須となる。水については、Milli-Q水等の超純水を利用するとフィルターろ過もされており、安心である。蛋白質の精製では、280nm付近の吸収を用いて検出を行うため、HPLCグレードの溶媒が必須というわけではないが、通常はHPLCグレードの試薬を使用することが多い。
また、ペプチド・蛋白質を対象とした逆相HPLC精製では、溶媒の水とアセトニトリルに通常0.05-0.1%でTFAを加えて使用する。溶媒に加えられたTFAは蛋白質の塩基性の解離基と結合して、水溶性の高いペプチドや蛋白質の逆相カラムへの保持力を向上する働きがあるとされている。さらに、シリカを基材として用いるカラムでは、分析中のカラムをpH2程度の低いpHに保つことで、シリカ表面に残存するシラノール基の解離を防ぎ、シラノール基と蛋白質との相互作用に起因するピークのテーリングを防ぐ効果もある。このTFAについても、HPLCグレードの試薬を用いることでろ過の手間を省くことが出来る。TFAは揮発性の強い酸で取り扱いに注意が必要であるが、著者のグループでは、1mLのアンプルに入ったHPLC用のTFAを購入し、1Lの水またはアセトニトリルに対して、混合することで0.1%溶液の調製を簡便に行っている。もし、ろ過を行う場合には、水及び、アセトニトリルとTFAを混合した後に、溶媒に耐性のあるフィルターでろ過を行うこととなる。
著者のグループでは、グラジエント用のA液として水/0.1% TFA、B液としてアセトニトリル/0.1% TFAを使用している。2液のミキサーでの混合がスムーズになるように各液の組成が95%程度になるように初めから少量を混合しておくテクニックもあるようだが、著者のグループでは、試薬調製の簡便さと、幅広いグラジエントの条件を容易に設定するためなどの理由で、この方法は用いていない。
HPLC装置にオンラインのデガッサーが装備されていない場合は、調製後の溶媒を脱気した後に装置にセットすることになる。超音波洗浄機、真空ポンプ、またはその両方を用いて数分間脱気を行う。TFAやアセトニトリルなどの揮発性の成分は脱気によって蒸発しやすいため注意が必要である。また、オンラインデガッサーが装備されている装置でも、すでに生じている気泡は取り除くことが出来ないので注意する。なお、ろ過や脱気の終了後に溶媒の容器を入れ替えると思った以上に空気中のゴミなどが溶媒の中に入ってしまうことがあるので、注意が必要である。著者のグループでは、脱気等の処理後、出来るだけ容器を移し変えなくて良いように工夫して使用している。
HPLC装置の溶媒を新しい溶媒に交換した際には、流路をよく洗浄してからカラムの取り付けを行うようにする。特に、ポンプ内に気泡などが残らないよう、装置の取り扱い説明に従い、速い流速でのパージなどの操作を行う。
カラムの取り付けに移る前に、その実験に使用するサンプルループの交換を行う場合もある。著者のグループでは、分析が目的、あるいは分取が目的でも比較的少量の試料をカラムに添加する場合には、容量の少ないサンプルループを、大量の試料を添加して分取する場合には、容量の多いサンプルループを用意して使い分けている。容量が少ないサンプルループを用いて多数回インジェクトを行うことも可能であるが、ループ付替えと作業の手間を考え合わせて適宜選択している。
2) カラムの取り付け・平衡化
HPLC装置にカラムを取り付ける前に、カラムの取り扱い説明書等で推奨される最大圧力の確認を行う。著者のグループで分析や分取に使用しているシリカが基材のカラムの場合150kgf/cm2程度が最大限界圧である。HPLC用のポンプには通常は圧力計が内蔵されているため、限界圧を超えない範囲を確認しながら、流速を設定して使用することになる。限界圧を越えて使用すると、カラム内の担体にダメージが加わり、カラムを使用できなくなる可能性が高いので注意する。たいていのHPLC装置では安全のため、限界圧の設定が可能であり、操作ミスなどの際にポンプの自動停止が可能な仕組みになっている。なお、水と比較すると、アセトニトリルの方が粘度は低いが、水とアセトニトリルの混合比によっては、水よりも粘度が高い領域があるので注意が必要である。
HPLC装置へのカラムの取り付けの際に注意する点は、カラム内に空気を入れないようにすることである。コツとしては、カラムの入り口に少し溶媒を滴下して濡らしておいて、接続用のネジを締め付ける前に、少し緩んだ状態で送液を続けて、気泡を追い出してから、ネジを強く締めて接続を行うか、逆方向への送液を許しているカラムの場合には、出口から極少量の溶媒を送液して、入口側の気泡を追い出してから接続する、といった方法がある。いずれの方法で取り付ける場合でも、実際の精製の際に使用する流速よりもかなり遅い流速(5-10分の1程度)でカラムを接続する。著者のグループで使用している4.6x250mmのカラムの場合、0.1mL/minから0.2mL/min程度の流速でカラムの接続を行っている。なお、カラムの取り付けには、フェラルが一体型となったPEEK樹脂製の押しネジ(ピークフィッティングなどと呼ばれる)が最近はよく用いられており、これを用いることで、手締めでも200kgf/cm2程度の耐圧性が得られるため、金属性のネジと比較すると取り扱いが容易である。ただし、カラムの付け外しを繰り返すことで次第に劣化するので注意が必要である。カラムをHPLC装置に取り付けた後、圧力に注意しながら、実際に使用する流速まで段階的に流速をあげる。
使用流速まで流速をあげた後、カラムの平衡化を行う。逆相HPLCに用いられるカラムに使用されている疎水性の強い官能基は、一般に水になじみにくいとされているため、100%のB液(アセトニトリル/0.1% TFA)をカラム体積の数倍程度流した後、100%のA液(水/0.1% TFA)を同程度流して平衡化を行う。著者のグループで使用している4.6x250mmのカラム(カラム体積は4mL程度)の場合、流速1mL/minで使用しており、各溶媒共に20分程度を平衡化の際の目安として流している。なお、手動のサンプルインジェクターを使用している場合には、平衡化の際にINJECTのポジションにセットしておくとサンプルループ内を溶媒が通り、ループ内の洗浄の手間がなく試料の添加に備えることが出来る。
3) 試料調製
サンプルはA液(水/0.1% TFA)に溶解して使用することが好ましい。他の溶媒に溶けている試料であれば、含まれている緩衝液などが問題にならない程度に十分な量のA液で希釈することで、pH等を平衡化の条件に近づけることが可能である。このようにサンプルの条件を一定にするのは、再現性の良い分析などを行うためには重要である。
カラムに添加可能なサンプルの量は、分析、分取など実験の目的によって異なってくるが、担体1mLあたり1mg程度が上限で、下限は検出の限界により決まる。この量はあくまで目安であり、目的ピークの近くに夾雑物のピークが存在する場合には、添加可能な量は大きく減少する。分析、分取、いずれの目的の場合でも、少量の試料の添加あるいは再分析により十分な分離が得られているかを確認する必要がある。
溶解した後の試料については、マイクロチューブに入れて可能な限り高速の遠心分離を行い沈殿やゴミを取り除き、その上清を用いる。さらに、試料が十分量存在している場合には、0.45μm等の試料の前処理用フィルターを使用して、ろ過を行う。試料が少量しかない場合にはフィルターへの吸着などが問題となる場合もあるので注意すること。
4) 試料の添加と溶出
分析が目的の実験などの場合には、必要に応じて、試料を添加せずに、あるいは、試料を溶解している溶媒のみを添加し、グラジエント溶出のプログラムを走らせて、ベースラインを確認しておくことで、試料のピークを確実に見分けることが出来る。
以下に、手動式のインジェクターを使用した、著者のグループでの一般的な試料の添加の手順を示す。
- 必要に応じて、INJECTの位置でニードルポートを洗浄する。
- インジェクターをLOADの位置に切り替える(溶媒はループ内を流れない)
- インジェクト用シリンジ内に気泡をすわないように注意しながら試料を吸い込む
- シリンジを試料注入口に差し込み、試料をサンプルループ内に注入する
- シリンジを差したまま、インジェクターをINJECTの位置に切り替える(溶媒がループ内を流れはじめ、試料がカラムに添加される)
- グラジエント溶出のプログラムを実行し、インテグレーターの記録を始める
- シリンジを外し、次の分析に備えて洗浄をする
平衡化の際にインジェクターをINJECTの位置に合わせていた場合には、LOADの位置に切り替えた後に、すぐにループ内に試料を導入することが出来る。LOADの位置のまま平衡化を行った場合は、ループ内を洗浄してから試料を導入する必要がある。なお、ニードルポートの洗浄は、INJECTの位置に切り替える際にニードルポート内に極少量漏れる試料を洗浄するために行うもので、これが問題にならない場合には必要ない。
インジェクト用のシリンジは、インジェクターのメーカー毎に専用の形状のニードルが備わったガラス製のものが発売されており、ニードルの種類を間違えて使用するとインジェクターの内部を痛めることがあるので注意が必要である。ニードルのみでも市販されているので、好みのシリンジに取り付けて使用することが可能であるが、プラスチック製のシリンジにセットした場合、気泡が抜けにくいので注意して扱う必要がある。また、通常のインジェクターでは流路を切り替える際に、一瞬、送液が止まるため、装置の圧力が上昇する。このため、素早い切り替え操作が必要となる。この問題を避けるため、最近はバイパス機構を内蔵したインジェクターが市販されている。
試料を注入後にシリンジを差したまま、INJECTへの切り替え操作を行うのは、シリンジを抜いた際にサンプルループ内に気泡が入るのを防ぐためである。試料注入後は早めにシリンジを洗浄することが望ましい。なお、溶媒がループ内を流れる際には、中央部では速く、壁面近くでは逆にゆっくりと流れるため、ループ内部の試料または溶媒全てが交換するには想像以上に多くの液量が必要となる。そのため、サンプルループに試料をオーバーフローさせることで容量を一定にして分析の目的などに使用する場合には、ループ容量の数倍程度を導入してループ内を完全に試料に置換する必要がある。逆に、シリンジの目盛りを用いておおよその容量を測る、あるいは分取の目的で試料を逃さず完全に注入したい場合には、ループ容量の2分の1以下を目安にすると試料がループから排出されることなくカラムに添加することが出来る。分取が目的の際にサンプルループが試料量よりも少なく、数度に分けて注入を行う際にも、このことを念頭に置き、INJECTに切り替えた後、十分な時間を置いてから、LOADに戻し、次の試料を注入する必要がある。
プログラムを実行する際に、INJECTの位置で実行するのか、LOADの位置で実行するのかは、それぞれメリット、デメリットがある。INJECTの位置のまま実行した場合、分析の間は常にサンプルループ内を溶媒が流れることになり、サンプルループ内は清浄に保たれるが、装置にセットしているサンプルループを交換した際には、溶出時間が異なることになってしまう。LOADの位置に戻してプログラムを実行する場合、この問題は起きないが、試料注入後に十分な時間を置いてからLOADの位置に切り替えなければ、試料がサンプルループに残る原因になり、次の分析の際にループを洗浄する必要が出てくる。また、インジェクターとスタートスイッチが連動している機種では、基本的にはINJECTの位置に切り替えた際に自動的にプログラムがスタートするために注意が必要である。
著者のグループでは、溶出に用いるプログラムについては、初めて扱う溶出濃度が不明な蛋白質試料の場合には、0-30分で0-60%(1分あたり2%)のような急な勾配を用いて分析を行い、溶出アセトニトリル濃度のおよその確認を行っている。その後、必要に応じてグラジエントプログラムを組みなおして、分析や分離に最適な条件を探している。インジェクターをINJECTの位置のままで分析する際には、溶出プログラムのリニアグラジエントがかかる前に、5-10分程度A液(水/0.1% TFA)100%を送液するようにプログラムを組んでおくと、素通りの成分も記録できて便利である。
どのようなプログラムを用いる場合でも、最終的にB液(アセトニトリル/0.1% TFA)100%での洗浄とA液(水/0.1% TFA)100%へ戻す過程を組み込むことで、次の試料添加の準備が整った状態でプログラムを終了することが出来る。通常のHPLC装置の場合、プログラム終了後もポンプは動作し続けるために、A液を適量送液した後に、ベースラインが安定したことを確認して、次の試料を添加することとなる。なお、前述のように、一般の逆相HPLC担体の疎水性の表面は水になじみにくいため、長時間の水のみの送液は避けるべきであり、連続してすぐに次の試料の精製を続けない場合には注意が必要である。
蛋白質の溶出を280nmで検出する場合には問題にならないが、210-220nm付近のより短波長側で検出する必要がある場合には、TFAの吸収が水中とアセトニトリル中で異なるため、ベース変動の原因となり、感度を上げての分析では注意が必要となる。
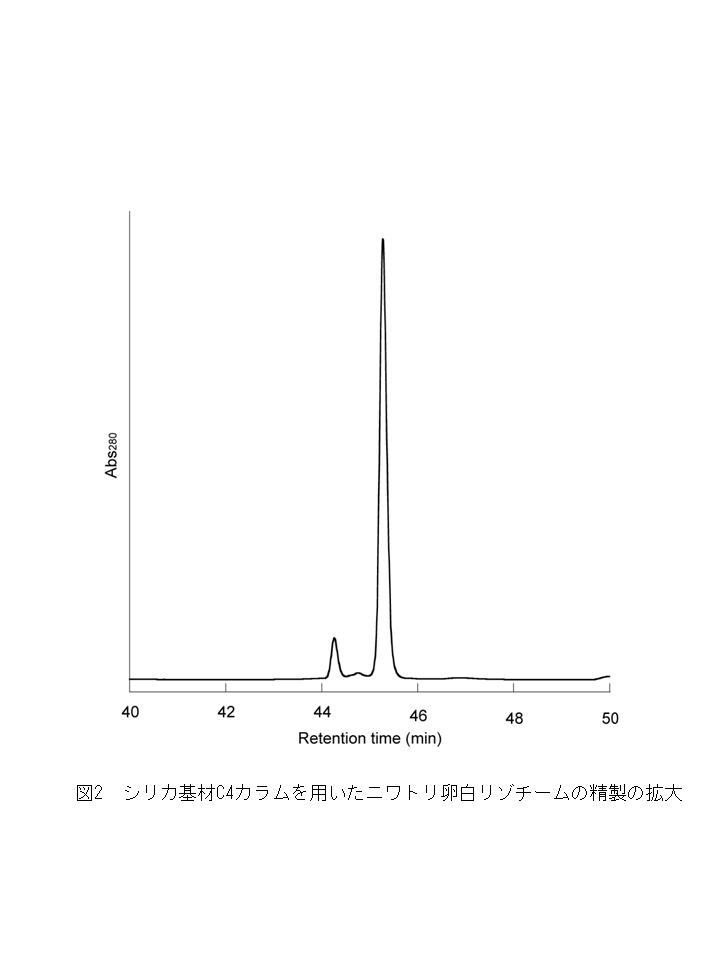
図1~4に、市販のニワトリ卵白リゾチームについて、逆相HPLCカラムを用いて本稿に示した手順で同じ試料を同じ条件で異なるカラムを用いて分離した結果を示す。図1は基材にシリカを用いたC4カラムを用いた分析結果で、図2はその拡大図である。図3は同じメーカーのC18カラムを用いた結果で、図4はポリマーを基材としたC18カラムを用いた結果である。一般にC4と比較するとアルキル鎖が長いC18は保持力が強いとされる。蛋白質は基本的には分子量が大きいものほど疎水性が強く、逆相カラムへの保持力が強くなる傾向にあるため、C18は分子量1万程度の比較的小さい蛋白質やペプチドの分離に用いられることが多い。基本的には、保持力が強いカラムのほうが、より広いグラジエント濃度で溶出可能になるため、分離能は良くなる。ただし、ペプチドと比較して分子量が大きい蛋白質の場合には、アルキル鎖の違いによる保持時間の違いはそれほど大きくないことも多いため、分子量にこだわらずピークの挙動を見ながらカラムを選択することで分離が改善するケースもある。また、基材にポリマーを用いたカラムはシリカを用いたものと比較すると分離能が落ちるとされるが、アルカリで洗浄可能である点などのメリットも多い。
使用後の後始末で重要なことは、使用後のカラムからは0.1%TFAを取り除き保管する必要があることである。酸性条件下では、導入されているアルキル鎖とシリカ間の結合が加水分解を受けカラムが劣化するためである。通常、アセトニトリルやメタノールなどカラム出荷時に使用されている溶媒を用いてカラムを十分に置換した後にHPLC装置からとりはずして保管する必要がある。
工夫とコツ
装置内の後始末
カラムはTFAを洗浄してから保管する必要があることを述べたが、装置の方はどうであろう?著者のグループでは、ペプチド・蛋白質の分析にもっぱら用いているHPLC装置は、TFAを含む溶媒を置換せずに使用を終了していることが多いが、今のところは問題になったことはない。オンラインデガッサーを用いているため、この中の溶媒を交換するにはかなりの手間がかかるのが、そのまま使用終了をしている大きな理由である。TFAを加えて調製済みの溶媒を長期にわたって使用するのは良いことではないので、溶媒の交換は必要であるが、装置内の溶媒は放置しても大丈夫なのではないか?と考えている。以前、几帳面な学生が装置内のラインを純水に置換してくれた後に、長期間HPLC装置を放置したところ、ライン内に藻が生えてしまったことがあった。TFAを含んだ水の場合、この心配もない…。
リゾチームの謎のピーク
著者のグループでは、蛋白質の逆相HPLCのテストにニワトリ卵白リゾチームを愛用している。結晶化により精製した製品が各社から発売されており、安価に手に入り調製しやすいだけでなく、この製品にはリゾチームより極わずかに保持時間の短い不純物が必ず含まれており、分離のチェックに便利なのである(図参照)。この不純物はカラムメーカーの蛋白質精製のアプリケーションガイド等でリゾチームの分析結果を例示している場合にも、必ず分離して見えている。分子量等から推定して、この不純物もリゾチームであることは間違いないようなので、脱アミド化などの化学修飾が起きた分子種ではないかと考えているが、いずれにせよ、不精な著者にはありがたいピークである。
アルカリ洗浄
ポリマー製のカラムはアルカリによる洗浄が可能であることを本文で述べたが、アルカリで洗浄する際には、装置側の耐性も確認する必要があるので注意が必要である。著者は昔、カラムが詰まってしまった際に、焦ってアルカリによる洗浄を試そうと考え、ラインの耐性のみを確認した後、インジェクターからアルカリを注入したところ、インジェクター内の部品で耐アルカリ性のないものがあり、ダメにしてしまったことがあった。苦い思い出である。
文献
- Nonaka, Y. et al., Proteins, 72, 313-22 (2008)
- Saito, S. et al., Proteins, 72, 414-26 (2008)