概要
様々な宿主を用いて遺伝子組換え蛋白質を大量発現した後、簡便で効率の良い精製法として幅広く用いられるのが、Ni-NTA(nickel-nitrilotriacetic acid)アフィニティークロマトグラフィーに代表される、IMAC(immobilized-metal affinity chromatography)である。本稿では、大腸菌による遺伝子組換え蛋白質精製において、Ni-NTA 担体は可溶性蛋白質、不溶性蛋白質、膜蛋白質など、幅広い範囲の蛋白質の精製への利用が可能であることを例示しつつ、初心者が迷いやすい点について概説する。Ni-NTA 担体による精製は非常に簡便であるため、精製自体は1日以内で操作可能である。
目的・イントロダクション
遺伝子組換えにより、大腸菌や酵母、培養細胞などを利用して、あるいは無細胞系を用いて、なんらかの実験に用いる目的で蛋白質の大量発現を試みる場合には、発現の成功の可否の検討や、後の精製の簡便化のために、タグ配列の付加を行う場合が多い。様々なタグ配列、タグ分子が開発されているが、中でもヒスチジン残基がクラスターを形成すると金属イオンへ高いアフィニティーを持つ、という性質を利用した His タグ配列は、極めて多くの利点を有することから、最もよく使われるタグ分子の一つと考えて間違いないだろう。他のタグと比較して、短い配列で機能するために、タグ配列の導入が容易な上に、目的蛋白質本来の機能を阻害しないことが期待出来る点が魅力的である。加えて、変性剤存在条件化でも精製に利用可能であることから、目的蛋白質の可溶型での発現が不幸にも失敗した場合でも、不溶性蛋白質(封入体、インクルージョンボディー)の精製にも利用できるというメリットもある。His タグを付加した蛋白質の精製に現在最もよく利用されるのが、\(\ce{Ni^{2+}}\) が配位した担体を利用した、Ni-NTA アフィニティークロマトグラフィーであろう。この担体の価格が、他のアフィニティー精製に用いられる担体と比較するとかなり安価であるのも魅力の一つである。
ただし、他の分子量の大きいタグ配列では、目的蛋白質の可溶化への貢献を期待して導入されるものが多いのに対して、His タグはむしろ不溶化の原因となるケースがあるといわれている。また、著者の経験では、His タグはアフィニティークロマトグラフィーとはいえ、精製後の純度が上がりにくく、実験の目的にもよるが、他の精製法との組み合わせが必要な場合が多いという問題もある。しかし、これらの問題点も、His タグの機動性を生かして、他のタグ蛋白質と併用して使用することで解決されることも多い(すなわち、GST、チオレドキシンなどのタグ蛋白質にさらに His タグを付けたり、目的蛋白質の N 末端にタグ蛋白質、C 末端 His タグを導入したり、という作戦をとる)。
精製の詳細について述べる前に、His タグ導入のメリットとも言うべき、His タグ付加の簡便な方法及び、大量発現成功の可否を判別する方法について、簡単に述べておく。まず、His タグ配列には、6xHis タグと呼ばれる、6つのヒスチジンが並んだ典型的な His タグだけでなく、相互作用を強くするため個数の異なるもの(8xHis, 10xHis など)や、HAT タグ(BD Bioscience 社)のように、Ni-NTA に対するアフィニティーを持ちながら、偏った His の並びを避け、不溶性を改善できるとされる配列もある。変わったところでは、チオレドキシン分子内にヒスチジン残基を導入し一次配列上は離れた3つの His によって、金属イオンに対するアフィニティーを持たせた、His-Patch Thiofusion(Invitorogen 社)等を利用する方法もある。
導入するタグ配列が決まり、市販のベクターにはじめから組み込まれたタグ配列を利用する場合には、それぞれ適当なベクターを購入して利用することになる。しかし、His タグは短い配列であることから、PCR プライマーを利用して目的蛋白質の遺伝子増幅の際に付加したり、すでに完成している発現用ベクター上の目的蛋白質の N 末端や C 末端に QuikChange site-directed mutagenesis Kit(Stratagene 社)などを利用したりして、導入することも容易に可能である。また、His タグは末端に位置していなくても、十分に長いリンカーなどであれば、その部位に存在しても機能する。なお、His タグの付加がその後の実験において問題になりそうで、除去の検討が必要な場合には、目的蛋白質との間にプロテアーゼ切断サイトを導入する方法のほかに、TAGZyme(Qiagen 社)のようなエキソプロテアーゼでN末端に付加した His タグを除去する方法もある。
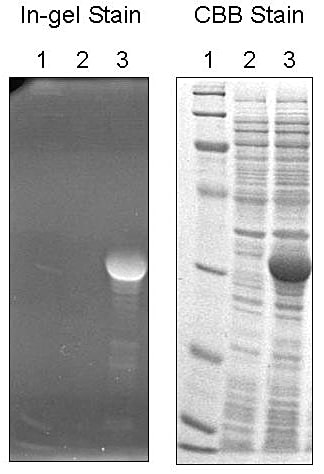
組換え体の調整が終了した後は、一般には試験的な培養を行い、目的の His タグ融合蛋白質が、意図通りに大量発現をしたかどうかを SDS-PAGE 等で確認することになる。この際、残念ながら発現量が比較的少ないケースでも、各社(Qiagen 社、GE ヘルスケアバイオサイエンス社、Clontech 社他)から発売されている様々な抗 His タグ抗体を利用することで、精製無しでウェスタンブロッティングによる検出が可能であり便利である。なお、各種抗 His タグ抗体の認識配列が、His タグそのものに加え、各メーカー発売のベクター由来の His タグ前後の配列を認識するようにデザインされているケースもあるので注意が必要である。発現の検出に著者のグループが愛用しているキットは、Invitrogen 社から発売されている、InVision His-tag In-gel Stain kit である。His タグタンパク質を SDS-PAGE 後のゲル中において蛍光色素で染色し検出するキットであるが、通常の UV トランスイルミネーターが使用でき、検出までにかかる時間も極めて短いため便利である。抗体を使用した検出と比較すると、感度や特異性にやや難がある感は否めないが、素早い検出には欠かせないし、使用後にゲルを CBB 染色できるのも魅力である(図1)。
組換え蛋白質が検出でき、目的の実験に使用可能な量が得られる可能性が高い場合には、いよいよ精製に進むことになる。以下の実験手順では、大腸菌での発現を例にして、可溶性蛋白質の精製手順を述べた後、不溶性蛋白質、膜蛋白質の相違点を説明する。
装置・器具・試薬
- 遠心機(各社)
- 菌体破砕装置(各社の超音波破砕機、フレンチプレス、ビーズ式破砕機など)
- Ni-NTA アガロース等の IMAC 担体またはプレパックカラム(各社)
- プラスチック、ガラス等のオープンカラム(各社)
- Tris(Tris(hydroxymethyl)aminomethane)(各社)
- 塩酸(各社)
- イミダゾール(各社)
- \(\ce{NaCl}\)(各社)
- エタノール(各社)
- \(\ce{NiSO4}\)(各社)
- 塩酸グアニジン(各社)
- 尿素(各社)
- Triton X-100(各社)
- DDM(n-Dodecyl-β-D-maltoside)(各社)
実験手順
- ① 可溶性蛋白質の精製
- 1.菌体の回収と破砕の準備
- 2. 破砕処理
- 3. カラム担体の準備とサンプルの添加・溶出
- ② 不溶性蛋白質の精製
- ③ 膜蛋白質の精製
実験の詳細
① 可溶性蛋白質の精製
1. 菌体の回収と破砕の準備
培養終了後の大腸菌の菌体を、遠心機を用いて沈殿として回収する。高速で遠心操作すると培地上清を容易に取り除くことが出来るが、その分、後の懸濁作業が大変になる。なお、全ての操作は特別な場合を除き、プロテアーゼ等による分解を防ぐため、可能な限り氷冷または低温室で行うことが多い。
沈殿を破砕用のバッファーで懸濁する。破砕用のバッファーに求められる性質は、
- pH は8.0以上であること(His の解離基の pKa の関係でこれ以下だとカラムに結合できない)
- 目的蛋白質を可溶化すること(これが一番難しい。活性を失わず、可溶化できる成分を予備実験で探す必要あり)
- Ni-NTA 担体への結合を阻害しないこと(担体を購入したメーカーの取り扱い説明書に阻害物と濃度の上限の一覧が記載されている。濃いバッファーやキレート剤、チオール試薬や界面活性剤など様々な成分が問題となるので、必ず確認する。例えば、Cys を含む蛋白質の場合には、ジスルフィド結合の形成を防ぐために、メルカプトエタノール等の還元剤を加えることも可能だが、濃度に上限があるのでメーカーのマニュアル等に従う)
- 上の条件を満たすならば、夾雑蛋白質の結合を阻害する成分を加える(\(\ce{NaCl}\) などの塩、ごく低い濃度のイミダゾール等により非特異的結合を妨げることが期待出来る)。
破砕用バッファーの液量は、少ないほど後の担体への添加が容易になるが、目的蛋白質の可溶性を維持できる範囲にとどめる。著者のグループでは、20 mM Tris-HCl(pH 8.0)のバッファーをベースに必要に応じて、他の試薬を加えて使用しており、培地量の20分の1量程度の破砕用バッファーを用いて処理することが多い。かなり高い菌体密度まで培養した大腸菌中に発現したかなり大量の遺伝子組換え蛋白質でもこの程度の濃縮率ならば、破砕後、可溶性が問題になったことは無く、また、破砕後の pH も問題なく8.0を維持できる。なお、Tris バッファーは、目的蛋白質の担体への結合を妨げる可能性があるとされており、リン酸バッファーを用いたプロトコールが多いが、著者のグループでは Tris バッファーで結合が弱くなり困った経験は今のところない。
2. 菌体破砕処理
超音波、フレンチプレス、ビーズ式破砕機などの各種装置を用いて、菌体の破砕をおこなう。機種、方法などにより条件が異なるが、いずれの方法でも、温度が上昇する可能性があるので、氷冷を行う、間隔をあけて操作する、などの注意が必要となる。また、適切な破砕条件かどうかは、破砕の過程で、少量のサンプリングを行い、遠心分離後に上清と沈殿を SDS-PAGE により分析し、目的蛋白質が上清に移行する様子を指標にすることが出来る。なお、各社から市販されている試薬を用いた菌体破砕方法は効率もよく簡便であるが、大量の蛋白質調整の場合にはコストが問題になることもあるので検討が必要である。また、リゾチームや DNase、RNase を菌体処理の際に加えるプロトコールも、試薬のみの処理の場合には、それぞれ細胞壁の破壊や核酸による粘性の防止に必須であるが、超音波破砕等の際には問題にならないことが多い。
破砕後の試料は遠心分離により、上清と沈殿を分離することになるが、この際可能な範囲で高速での遠心操作を行うと、上清の取り扱いが容易になる。著者のグループでは、カラムに詰めた担体を用いて精製する場合には、念のため、0.45 μm 程度のフィルターを通した後、カラムに添加している。
3. カラム担体の準備とサンプルの添加・溶出
Ni-NTA 担体は各社(Qiagen 社、GE ヘルスケア社他多数)から発売されており、精製をバッチ法で行うのか、カラム法で行うのか(この場合、さらにプレパックか、手詰めのオープンカラムか)などによって、粒子径や樹脂の強度に広い選択の余地がある。特に、各社とも簡便な精製に利用できる His タグの性質を生かすために、様々な工夫した樹脂を発売しているので、多検体を処理する場合などは効率的に処理することが出来る。また、Ni-NTA 以外にも、\(\ce{Co^{2+}}\) が配位した TALON レジン(Clontech 社)などがあり、こちらも選択肢となる。メーカーによって多少異なるが、担体 1 mL あたり、およそ数 mg ~数十 mg のヒスタグ蛋白質が結合可能である、として販売されているケースが多い。
著者のグループでは、カラムを用いて本格的な大量精製を行う前に、マイクロチューブ等を使い小スケールでのバッチ法やスピンカラムなどを用いて、His タグ蛋白質の担体への吸着の確認をすることが多い。His タグを持つ蛋白質試料の溶出には、His の pKa 以下に pH を下げて Ni-NTA から解離させる方法、His と似た構造を持つイミダゾールとの競合による方法、EDTA による方法などが用いられる。よって、夾雑蛋白質をカラムから除去する洗浄にも、試料が溶出しない範囲の濃度でイミダゾールの添加(数mM – 数十 mM 程度)が有効である。著者のグループでは、Ni-NTA アフィニティークロマトグラフィーでの精製には、手詰めのオープンカラムを用いることが多く、グラジエント溶出よりは、イミダゾールの濃度を変えての、ステップワイズでの精製を行うことが多いため、初めて作成した組換え蛋白質の場合、担体への吸着をバッチ法などで簡単に確認した後、カラムを用いて、適切な洗浄と溶出の条件を探している(グラジエント溶出による精製を試みたこともあるが、His タグによる精製の場合には、残念ながら期待したほど精製後の純度が改善されないことが多かった)。
適当なイミダゾール濃度の溶液を簡便に調整するために、Tris バッファーにイミダゾールを 1 M 程度の高濃度に溶解して、pH を8.0に調整した溶液を用意しておき、イミダゾールを含まない Tris バッファーと適当な混合比で混ぜることで、各濃度のイミダゾール溶液を調整すると便利である。
His タグ蛋白質と Ni-NTA 担体のアフィニティーはかなり強いケースが多いため、必ずしもカラムに詰めた担体にサンプルを添加する方法でなく、バッチ法により試料溶液中に Ni-NTA 担体を加えて、撹拌した後、カラムに詰めて溶出する方法が選択されることも多い。ただし、目的蛋白質のカラムに対する結合能が低い場合や目的蛋白質の濃度が低い場合には、バッチ法を選択すると十分に目的蛋白質を回収できなくなる可能性が高くなる。この場合には、カラム法を用いる、素通りを再度カラムにかける、バッファー組成を検討する、目的蛋白質が濃縮されるような前処理を行う、などの工夫により結合能を改善し回収率を改善できる可能性もある。 以下に著者のグループで可溶性のHisタグ導入蛋白質を \(\ce{Ni^{2+}}\) プレチャージの Ni-NTA アガロース担体を使用して、カラムでの精製を行う際に用いているプロトコールを示す (1,2)。
- 市販の50%スラリーの樹脂を適当なオープンカラムに詰める。
- カラムベッド体積の5倍程度のサンプル破砕に用いた破砕バッファーで平衡化を行う。
- 試料溶液をカラムに添加する。
- 素通り液は、SDS-PAGE 用試料として適宜回収する。
- カラムベッド体積の5倍程度の洗浄バッファーで洗浄する。
- カラムベッド体積の5倍程度の溶出バッファーで溶出し、フラクションを回収する。
- 必要に応じて、溶出バッファーのイミダゾール濃度を上げて、6を繰りかえす。
- 最終的に、カラムベッド体積の5倍程度の 500 mM イミダゾール、1 M \(\ce{NaCl}\) を含む洗浄バッファーで洗浄する。
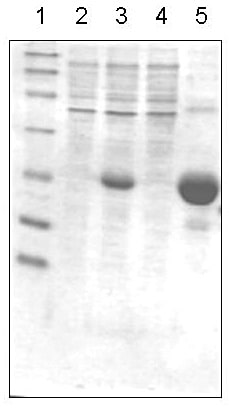
図2に精製の経過のSDS-PAGEの結果を示した。
なお、通常の精製の際には、カラム担体の準備は、破砕処理前か、破砕処理と平行して行うと破砕後のサンプルを長時間放置せずに、すぐにカラムに添加することが出来る。
洗浄及び、溶出に用いるイミダゾール濃度を最適化することで、精製純度の改善が期待出来るため、初めての精製の際には、イミダゾール濃度を必要に応じて 50–100 mM 程度の刻みで変えて、溶出条件を検討している。
数社の担体を試した経験では、200–300 mM 程度のイミダゾール濃度で試料が溶出されることが多く、500 mM まで結合しているケースはないので、洗浄にはこの程度の濃度で十分と考えている。使用後のカラムを繰り返し同じ試料の精製に使用する場合には、カラム体積の数倍の純水で洗浄した後、腐敗防止のため、30%エタノールなどに置換して低温で保管している。\(\ce{Ni^{2+}}\) の結合力が高いカラムではそのまま再使用することも可能であるが、100 mM 程度の \(\ce{NiSO4}\) を添加することで、\(\ce{Ni^{2+}}\) を再結合させてから使用しても良い。また、本格的に再生を行う場合には、メーカーのプロトコールに従って、変性剤や界面活性剤を用いた洗浄を行うことができる。
② 不溶性蛋白質の精製
His タグを付加した不溶性蛋白質(封入体、インクルージョンボディーとして発現)の精製では、1. 菌体の回収と破砕の準備、及び 2. 破砕処理の部分が、①の可溶性蛋白質の精製と異なる。
不溶性蛋白質の精製の場合には、目的蛋白質を可溶化してカラムに添加する必要があるため、6 M 塩酸グアニジンまたは 8 M 尿素を加えた溶液で可溶化した後にカラムに添加することになる。このため、可溶性蛋白質の精製とは異なり、破砕バッファーは適当なものでかまわない。ただし、超音波などによる破砕の場合、強い条件や長時間の破砕では、封入体が砕けてしまい、以後の精製の効率が悪くなるため、注意が必要である。著者の経験では、過剰な超音波処理により一見すると多少は可溶性画分に発現したように見えていた蛋白質が、実は不溶性であったことがある。また、破砕後の封入体は、界面活性剤に溶解し難いため、破砕後遠心により分離した沈殿を、Triton X-100 等を含むバッファーを少量加えて、穏やかに撹拌し、再度遠心する、という操作を繰り返して洗浄を行うことで、膜蛋白質などの夾雑蛋白質を除去し精製の純度を高める効果が期待出来る。
洗浄後の封入体は、上述のように、6 M 塩酸グアニジンまたは8 M尿素を加えた可溶化バッファーで溶解し、可溶化バッファーで平衡化したカラムで精製を行う。可溶化に用いるバッファー量は蛋白質の発現量等にもよるが、1 L の菌体あたりおよそ数 mL – 数十 mL 程度で十分である。全てのバッファーに変性剤を含む以外は、可溶性蛋白質の精製と同様の手順で精製が可能である。著者の経験では、変性剤存在下でも His タグのアフィニティーは十分強いと感じている。
変性剤として尿素を用いる際の注意として、Ni-NTA 精製では、前述のように中性以上の pH 条件下で操作を行う必要があり、この条件では尿素の分解物であるシアン酸イオンが蛋白質のアミノ基と反応しやすく蛋白質がカルバモイル化の修飾反応を受け易いという問題点がある。中性以上の pH 条件では尿素中に試料を長期間放置しない、低温で保存するといった注意が必要となるが、さらに大きな問題になる場合には、尿素をイオン交換樹脂で前処理して使用する方法もある。
なお、変性剤存在下で精製した蛋白質は無論、失活している可能性が高いので、適切な条件での巻き戻し(リフォールディング)が必要になるので注意が必要である。
③ 膜蛋白質の精製
His タグを付加した膜蛋白質の精製でも、適切な界面活性剤存在下で可溶化した試料を用いることで効率よい精製に Ni-NTA 担体利用することができる。例えば、著者のグループで研究している大腸菌で His タグ付き組換え蛋白質として発現したバクテリア由来7回膜貫通型のハロロドプシンの精製 (3) では、膜蛋白質が発現した大腸菌を破砕し遠心分離して回収した膜画分に、終濃度1.5%で n-Dodecyl-β-D-maltoside(DDM)を加え、ホモジナイザーで処理した後、数時間スターラーで撹拌して充分可溶化、その後、超遠心により可溶化できなかった膜画分を取り除いた上清から、Ni-NTA 担体を用いたバッチ法で目的蛋白質を回収している。溶出は 0.1% DDM を含むバッファーで行っている。これについても、バッファーに界面活性剤を含む以外は、可溶性蛋白質の精製と同様の手順で精製が可能であるが、可溶化の適切な条件は膜蛋白質によって全く異なるので注意が必要である。
工夫とコツ
SDS-PAGE での泳動位置
His タグを導入した蛋白質は、その電荷のためか、SDS-PAGE の際、予想される分子量よりもかなり大きいバンド位置に泳動される。初めての泳動の際は組換えを間違えたのか?と驚くので注意。
N 末端導入と C 末端導入の発現可否の謎
著者のグループでは、大腸菌と pET ベクター(Novagen 社)を用いた His タグ蛋白質の発現系を愛用しているが、His タグを N 末端に導入するか、C 末端に導入するかで、未誘導時のタンパク質発現のリークが大きく異なるケースがある。目的蛋白質の種類によるのだが、タグの位置を変えた途端に、発現の仕方が大きく変わってしまうことがあり驚く。文献になっていないか調べたい、と思いつつそのままになっている。
担体の再生
著者のグループで用いている Ni-NTA 担体について、不溶性蛋白質の精製や膜蛋白質の精製と比較して、可溶性蛋白質の精製に用いた場合、使用できる回数の限界が短いように感じている。繰り返し利用すると、結合能が落ちて、目的蛋白質が徐々に素通りするようになってしまうのである。メーカーのプロトコールにある再生方法を用いて、入念に洗浄をしても、あまり顕著な結合能の回復が見られないことが多い。可溶性蛋白質の精製のプロトコールでは、カラムに持ち込む夾雑蛋白質の量が多いこと、あるいは、不溶性蛋白質の精製では変性剤、膜蛋白質の精製では界面活性剤が存在している条件下で使用していることが、カラムの「持ち」と関係しているのだろう、と考えている。
文献
- Saito, S. et al., Proteins, 72, 414–426 (2008)
- Sato, K. et al., FEBS lett., 553, 232–238 (2003)
- Kubo, M. et al., Biochemistry, 44, 12923–12931 (2005)