概要
全蛋白質の約30%が膜蛋白質でありエネルギー生産・シグナル伝達等、様々な生命活動に重要な役割を担っているが、その構造解析は可溶性タンパク質に比べてかなり立ち後れている。現在PDBに登録されている構造のうち膜蛋白質は1%にも満たない。本稿では、筆者らがX線結晶構造解析を達成した膜蛋白質SecDFの調製法を紹介する。SecDFは、蛋白質の膜透過・膜組み込み装置であるSecトランスロコン(1-3)と相互作用して、その高効率化に寄与している(4)。SecDFの精製は、大腸菌の内膜に過剰発現させた後その膜画分から界面活性剤を用いて可溶化させ行った。原著論文(5)ではふれなかった精製過程の詳細を紹介する。
装置・器具・試薬
遠心機、超遠心機(各社)
テフロンホモジナイザー(各社)、マイクロフルイダイザー(MIZUHO)、
ドデシルマルトシド(DDM)(GLYCON)、Pefabloc(MERCK)、
AKTA explorer 10S(GE Healthcare)、Ni-NTA Superflow(QIAGEN)、
HiTrap Desalting(GE Healthcare)、HiTrapSP(GE Healthcare)、
Superdex 200(GE Healthcare)、Amicon Ultra(Millipore)、
NanoDrop(Thermo)、透くん(日本ジェネティクス)
実験手順
0)前培養用培地の準備 (第0日目)
1)大腸菌の大量培養 (第1日目)
2)大腸菌膜画分の調製 (第2日目)
3)膜蛋白質の可溶化、Ni-NTAカラム(第3日目)
4)陽イオン交換カラム (第4日目)
5)ゲル濾過カラム (第5日目)
6)透析・結晶化 (第6日目)
実験の詳細
大腸菌培養液30LからのSecDF膜蛋白質(C末端に精製のためHis6タグを付加させている)の精製手順の詳細を紹介する。本プロトコルでは、約3mgの精製タンパク質が得られる。
0)前培養用培地の準備(第0日目)
滅菌済みLB培地、300mLを準備する。
1)大腸菌の大量培養(第1日目)
作製しておいたLB培地に抗生物質と別途作製した滅菌済み40%グルコースを加え、300mLのLB-Amp(アンピシリン)(50μg/mL)、Cm(クロラムフェニコール)(20μg/mL)、グルコース(0.4%)培地(*1)とする。この培地に、グリセロールスストック(*2)からSecDFを発現させる大腸菌(AD202/pSTD343/pTT206)(*3)(5)をスパチュラーでひとかき植え継ぎ、37℃で8時間以上震盪培養する。この間に30LのLB培地(*4)を準備する。十分に大腸菌が生育したら、LB-Amp(50μg/mL)、1mM IPTG培地に1/100体積量を植え継ぎ37℃で一晩震盪培養を行う。
*1 前培養はlacプロモータによる目的蛋白質の発現をおさえる為、グルコースを添加する。
*2 再現よく高発現させる為にSecDFの発現を確認している大腸菌のグリセロールストックから培養を開始する。
*3 AD202は野生株MC4100のompT欠損株である。pSTD343はlacIqのプラスミド、pTT206は目的タンパク質SecDFをlacプロモータにより発現させるpUC系のプラスミドである。
*4 我々は12個の5Lのバッフル有り三角フラスコに2.5Lずつの培地を作製している。
2)大腸菌膜画分の調製(第2日目)
次の日、朝から菌体を回収する。この後の操作はすべて4℃で行う。大腸菌を遠心(6,000g × 12min)で回収し、菌体を洗浄するため適量の10mM Tris-HCl(pH8.0)で懸濁する。再び遠心(6,000g × 20min)により菌体を回収する。ここで十分に上清を取り除いた後、容器ごと重さを量り大腸菌のwet重量を見積もる(ここでは約80gの菌体が得られたとする)(*5)。菌体を20mM Tris-HCl(pH8.0)、0.1mM Pefabloc、3mM EDTA-Na(pH8.0)、1mM DTT溶液で再懸濁し、全量を約300mLにする。続いてテフロンホモジナイザーで懸濁液を均一にする(*6)。続いてマイクロフルイダイザー(Microfluidics 15,000psi × 2)によって細胞壁を破壊する(*7)。粗抽出液から遠心(10,000g × 30min)で未破砕細胞と破砕後の細胞片を除いた後、上清を超遠心(110,000g × 1h)し膜画分を得る。膜画分は20mM Tris-HCl(pH8.0)、15% glycerol、300mM NaCl、0.1mM Pefablocで懸濁する。最終体積は60mL程度とし、テフロンホモジナイザーで均一にする。膜画分は液体窒素で凍結させ、-80℃の冷凍庫で保管する(*8)。
*5 あらかじめ容器の重量を測定しておく。菌体の量に合わせて可溶化のバッファーの体積を決定する。
*6 十分に懸濁し均一にしておかないと、マイクロフルイダイザーが詰まる原因となる。
*7 マイクロフルイダイザーの破砕の代わりに、フレンチプレス7,500psi × 2回を用いることも可能。また、高塩濃度のバッファーはステンレスにさびが生じる原因になるため、できる限り塩濃度が低い方が良い。この段階ではNaClは加えていない。膜蛋白質は膜に埋め込まれた状態で安定であることが多い。
*8 -80℃での数ヶ月の保存は結晶化に問題がないことを確認している。グリセロールは蛋白質安定化の為に加えている。本プロトコールでは全膜画分からの精製を行っているが、状況に応じて、大腸菌の内膜と外膜をスクロース密度濃度勾配法によって分離し、内膜画分を回収後、内膜画分から蛋白質を精製することも可能である。内膜画分からの蛋白質精製は純度が向上するという長所もあるが、収量が下がるという短所もある。
3)膜蛋白質の可溶化、Ni-NTAカラム(第3日目)
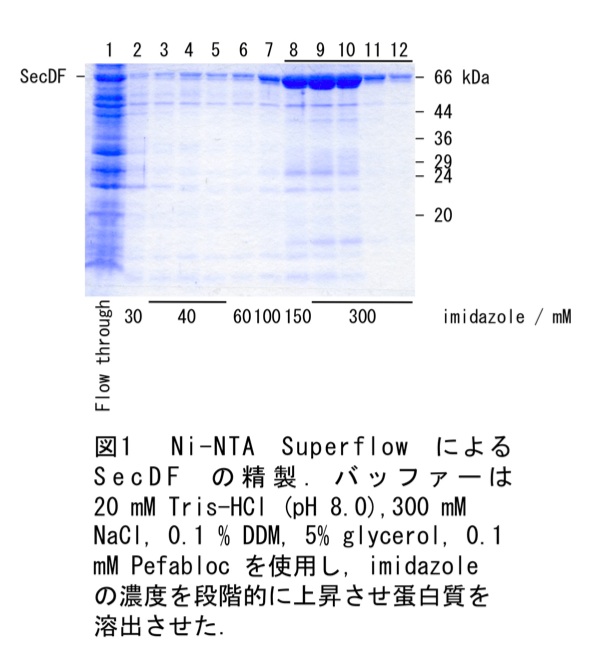
膜画分を氷上で溶解し、20mM Tris-HCl(pH8.0)、5% glycerol、300mM NaCl、0.1mM Pefabloc、300mM NaClのバッファーを用いて約200mLとする。そこに終濃度が 20mM imidazole-HCl (pH7.0)、2% ドデシルマルトシド(DDM)(*9)となるように、4M imidazole-HCl(pH7.0)溶液(*10)、および10% DDM溶液を加える。緩やかにスターラーで30minほど撹拌させることで、膜蛋白質を可溶化させる。可溶化後、超遠心(110,000g × 30min)により不溶性画分を取り除き、上清を20mM Tris-HCl(pH8.0)、300mM NaCl、0.1% DDM、5% glycerol、0.1mM Pefabloc、20mM imidazole-HCl(pH8.0)で平衡化した5mL Ni-NTA Superflow(QIAGEN)に添加し、バッチ法によりSecDFを樹脂に吸着させる。15mLの20mM Tris-HCl(pH8.0)、300mM NaCl、0.1% DDM、5% glycerol、0.1mM Pefabloc、30mM imidazole-HCl(pH7.0)でカラムを洗浄したのち、imidazole-HCl(pH7.0)の濃度を段階的に上昇させ、SecDF蛋白質を溶出させる(*11)。SDS-PAGEによって溶出蛋白質を確認する(図1)。
*9 膜蛋白質によって適切な界面活性が異なる。
*10 imidazole は塩基性が強いのであらかじめpHを調整しておく。
*11 洗浄・溶出に用いたバッファーと体積を以下に示す。
30mM imidazole溶液 : 15mL
40mM imidazole溶液 : 30mL
60mM imidazole溶液 : 5mL
100mM imidazole溶液 : 5mL
150mM imidazole溶液 : 5mL
300mM imidazole溶液 : 20mL
4)陽イオン交換カラム(第4日目)
SecDFを含む画分(図1 下線部)を回収し、超遠心(110,000g × 30min)で不溶性物質を取り除いた後(*11)、Amicon Ultra-15 30K NMWL(Millipore) を用いて、約4mLまで濃縮を行う。その後、脱塩カラム[HiTrap Desalting(GE Healthcare) 5mL ×3個]でバッファーを20mM Tris-HCl(pH7.0)、0.1% DDM、5% glycerol、0.1mM Pefablocに置換しする(*12)。超遠心(100,000g × 30min)により濃縮過程で生じた不溶性物質を取り除く。 20mM Tris-HCl(pH7.0)、0.1% DDM、5% glycerol、0.1mM Pefablocで平衡したHiTrapSP 1mL(GE Healthcare)に蛋白質を吸着させ(*13)、平衡化バッファーで10mLカラムの洗浄を行い、続いて20mLのNaClの濃度勾配(0-1M NaClの濃度勾配)で蛋白質を溶出させる。SDS-PAGEによって溶出蛋白質を確認する(図2)。
*11 Ni-NTA カラムから溶出した溶液は、不溶性となる物質が多く存在する。超遠心を行うことで不溶性画分を取り除き、続く濃縮過程をスムーズに進めることができる。
*12 Amicon Ultraで何度か濃縮希釈を繰り返してBuffer交換することも可能である。
*13 大腸菌の蛋白質は陰イオン交換カラムに結合するものが多いため、陽イオン交換カラムを用いることができれば、純度が大幅に向上する(図4)。
5)ゲル濾過カラム(第5日目)
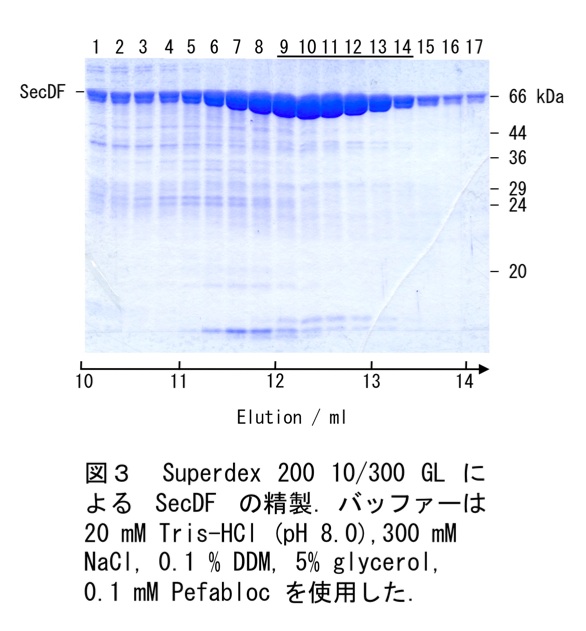
SecDFを高純度で含む画分(図2 下線部)を回収し、Amicon Ultra-15 NMWL 30K(Millipore)を用いて蛋白質を約400μLまで濃縮後、20mM Tris-HCl(pH8.0)、300mM NaCl 0.1% DDM、5% glycerol、0.1mM Pefablocで平衡化したSuperdex 200 10/300 GL(GE Healthcare)によりゲル濾過カラムを行う(図3)。サンプルは約200μLずつ2回に分けてアプライする(*14)。SDS-PAGEによって溶出蛋白質を確認する(図3)
*14 Superdex 200 10/300 カラムの推奨されているサンプル体積は250μL以下であるため、2度に分けて行う。
6)透析・結晶化(第6日目)
純度の高いSecDFの画分(図3 下線部)(*15)を回収し、濃度をNanoDrop(Thermo SCIENTIFIC)で測定する。SecDFの場合はAbs280nm=0.64を1mg/mLとして蛋白量を見積もっている。次にAmicon Ultra-4 30 K NMWL(Millipore)を用いて濃度が10mg/mL 以上になるように濃縮し、遠心(10,000g × 20min)を行う。上清をMicro Dializer透くん 分画分子量:14,000(日本ジェネティクス)(*16)を用いて50mLの0.02% DDM(*17)で透析(2時間以上 × 2回)を行う。続いて、超遠心(110,000g × 30min)を行い、その上清を最終精製産物とする。サンプルの濃度を測定し、8mg/mLになるように、透析バッファーで希釈し結晶化サンプルとする。通常この精製過程により、約3mgの結晶化サンプルが得られる(図4)。この精製SecDF溶液と結晶化バッファー(26% PEG400、0.2M 酢酸ナトリウム)を2:1で混合し、ハンギングドロップ法で結晶化を進め良好に結晶が成長した場合、図5に示した美しい8面体の結晶が形成する。結晶化方法の詳しい内容は文献(5)を参照されたい。4Å分解能を超えるX線の回折データが収集できるSecDFの結晶は100個に一つあるかないかであるが(*18)、最終的に3.5Å分解能のX線回折データの収集に成功し、SecDFの構造解析を達成した(Tsukazaki et al., 論文作製中)。
*15 ゲル濾過カラムから溶出された低純度の画分は結晶しないため、高純度の画分のみ回収する。
*16 微量透析装置はいくつか試したが、微量の透析には透くんが使いやすい。透くんはその仕様上、空気の膨張、収縮の影響をうけるため、使用前に透くんを使用する温度に十分冷やしておく必要がある。
*17 透析バッファーは0.02%DDM溶液のみで、塩やバッファーは含まれていない。SecDFは、塩やバッファー等がなくても安定な蛋白質であったので、透析において界面活性剤を除くすべての試薬を取り除くことが可能である。蛋白質溶液から結晶化実験に持ち込むバッファーの影響を最小限にするためにこのような方法をとっている。
*18 SecDF結晶の質は見かけでは判断がつかないため、比較的大きく成長した300μm以上の結晶はすべてX線回折像の測定を行う。
-

図1 -

図2 -

図3 -

図4 -

図5
工夫とコツ
膜蛋白質の発現確認
膜蛋白質を細胞内に過剰に発現させた場合、通常その膜画分に蓄積するため、細胞あたりの発現量が少なく、検出が容易ではない。筆者はN末端もしくはC末端に精製のためのHis6タグを付加させた蛋白質として発現させ、ウエスタンブロティングで確認することが多い。近年タグにGFPを用い、その蛍強度から発現量と蛋白質の安定性を評価できる簡便な方法が発明された(6)。タグの付加は時として蛋白質が機能を失い不安定化する場合があるので注意が必要である。
界面活性剤の選択と可溶化について
膜蛋白質の精製は、膜に埋め込まれている状態から界面活性剤による可溶化が必要であるが、適切な界面活性剤を選択しなければ精製過程で蛋白質が活性を失ったり、沈殿を起こしたりする。よく使用され購入できる界面活性剤だけでも、数十種類にものぼるため、目的蛋白質の精製に適した界面活性剤を選択することは容易ではない。筆者は、はじめに結晶構造解析の例の多いDDMを用いる。DDMを用いて蛋白質が上手く精製できない場合は、数十種類の界面活性剤を用いたスクリーニングを行う。界面活性剤による膜蛋白質の可溶化は文献(7)が詳しい。
脂質の欠落による膜蛋白質の過剰精製
膜蛋白質は生体内で脂質と強く相互作用し膜内に組込まれているが、界面活性剤による可溶化の際、膜蛋白質を覆っていた脂質の多くが界面活性剤に置換されて可溶化する。一部の脂質は膜蛋白質と強く相互作用しており蛋白質と共に精製される。しかしながら、その脂質が精製過程において欠落することがある。脂質の欠落は膜蛋白質の不安定化を引き起こしたり、良質の結晶が得られない原因となったりする(8,9)。
実験の安全
本精製方法は,通常の蛋白質精製と同様に進められる。
文献
- van den Berg, B., et al., Nature, 427, 36-44 (2004)
- Zimmer, J. et al., Nature, 455, 936-43
- Tsukazaki, T. et al., Nature, 455, 988-91 (2008)
- 森 博幸,塚崎 智也, 蛋白質核酸酵素, 54, 685-695 (2009)
- Tsukazaki, T. et al., Acta. Crystallograph. Sect. F. Struct. Biol. Cryst. Commun., 62, 909-12 (2006)
- Kawate, T. & Gouaux, E. Structure, 14, 673-81 (2006)
- 村上 聡, タンパク質をつくる (長谷俊治,高尾敏文,高木淳一) 107-133, 化学同人 (2008)
- Zhang, H., L. et al., Proc. Natl. Acad. Sci., 100, 5160-3 (2003)
- Guan, L., et al., Proc. Natl. Acad. Sci., 103, 1723-26 (2006)
概要
全蛋白質の約30%が膜蛋白質でありエネルギー生産・シグナル伝達等、様々な生命活動に重要な役割を担っているが、その構造解析は可溶性タンパク質に比べてかなり立ち後れている。現在PDBに登録されている構造のうち膜蛋白質は1%にも満たない。本稿では、筆者らがX線結晶構造解析を達成した膜蛋白質SecDFの調製法を紹介する。SecDFは、蛋白質の膜透過・膜組み込み装置であるSecトランスロコン(1-3)と相互作用して、その高効率化に寄与している(4)。SecDFの精製は、大腸菌の内膜に過剰発現させた後その膜画分から界面活性剤を用いて可溶化させ行った。原著論文(5)ではふれなかった精製過程の詳細を紹介する。
装置・器具・試薬
遠心機、超遠心機(各社)
テフロンホモジナイザー(各社)、マイクロフルイダイザー(MIZUHO)、
ドデシルマルトシド(DDM)(GLYCON)、Pefabloc(MERCK)、
AKTA explorer 10S(GE Healthcare)、Ni-NTA Superflow(QIAGEN)、
HiTrap Desalting(GE Healthcare)、HiTrapSP(GE Healthcare)、
Superdex 200(GE Healthcare)、Amicon Ultra(Millipore)、
NanoDrop(Thermo)、透くん(日本ジェネティクス)
実験手順
0)前培養用培地の準備 (第0日目)
1)大腸菌の大量培養 (第1日目)
2)大腸菌膜画分の調製 (第2日目)
3)膜蛋白質の可溶化、Ni-NTAカラム(第3日目)
4)陽イオン交換カラム (第4日目)
5)ゲル濾過カラム (第5日目)
6)透析・結晶化 (第6日目)
実験の詳細
大腸菌培養液30LからのSecDF膜蛋白質(C末端に精製のためHis6タグを付加させている)の精製手順の詳細を紹介する。本プロトコルでは、約3mgの精製タンパク質が得られる。
0)前培養用培地の準備(第0日目)
滅菌済みLB培地、300mLを準備する。
1)大腸菌の大量培養(第1日目)
作製しておいたLB培地に抗生物質と別途作製した滅菌済み40%グルコースを加え、300mLのLB-Amp(アンピシリン)(50μg/mL)、Cm(クロラムフェニコール)(20μg/mL)、グルコース(0.4%)培地(*1)とする。この培地に、グリセロールスストック(*2)からSecDFを発現させる大腸菌(AD202/pSTD343/pTT206)(*3)(5)をスパチュラーでひとかき植え継ぎ、37℃で8時間以上震盪培養する。この間に30LのLB培地(*4)を準備する。十分に大腸菌が生育したら、LB-Amp(50μg/mL)、1mM IPTG培地に1/100体積量を植え継ぎ37℃で一晩震盪培養を行う。
*1 前培養はlacプロモータによる目的蛋白質の発現をおさえる為、グルコースを添加する。
*2 再現よく高発現させる為にSecDFの発現を確認している大腸菌のグリセロールストックから培養を開始する。
*3 AD202は野生株MC4100のompT欠損株である。pSTD343はlacIqのプラスミド、pTT206は目的タンパク質SecDFをlacプロモータにより発現させるpUC系のプラスミドである。
*4 我々は12個の5Lのバッフル有り三角フラスコに2.5Lずつの培地を作製している。
2)大腸菌膜画分の調製(第2日目)
次の日、朝から菌体を回収する。この後の操作はすべて4℃で行う。大腸菌を遠心(6,000g × 12min)で回収し、菌体を洗浄するため適量の10mM Tris-HCl(pH8.0)で懸濁する。再び遠心(6,000g × 20min)により菌体を回収する。ここで十分に上清を取り除いた後、容器ごと重さを量り大腸菌のwet重量を見積もる(ここでは約80gの菌体が得られたとする)(*5)。菌体を20mM Tris-HCl(pH8.0)、0.1mM Pefabloc、3mM EDTA-Na(pH8.0)、1mM DTT溶液で再懸濁し、全量を約300mLにする。続いてテフロンホモジナイザーで懸濁液を均一にする(*6)。続いてマイクロフルイダイザー(Microfluidics 15,000psi × 2)によって細胞壁を破壊する(*7)。粗抽出液から遠心(10,000g × 30min)で未破砕細胞と破砕後の細胞片を除いた後、上清を超遠心(110,000g × 1h)し膜画分を得る。膜画分は20mM Tris-HCl(pH8.0)、15% glycerol、300mM NaCl、0.1mM Pefablocで懸濁する。最終体積は60mL程度とし、テフロンホモジナイザーで均一にする。膜画分は液体窒素で凍結させ、-80℃の冷凍庫で保管する(*8)。
*5 あらかじめ容器の重量を測定しておく。菌体の量に合わせて可溶化のバッファーの体積を決定する。
*6 十分に懸濁し均一にしておかないと、マイクロフルイダイザーが詰まる原因となる。
*7 マイクロフルイダイザーの破砕の代わりに、フレンチプレス7,500psi × 2回を用いることも可能。また、高塩濃度のバッファーはステンレスにさびが生じる原因になるため、できる限り塩濃度が低い方が良い。この段階ではNaClは加えていない。膜蛋白質は膜に埋め込まれた状態で安定であることが多い。
*8 -80℃での数ヶ月の保存は結晶化に問題がないことを確認している。グリセロールは蛋白質安定化の為に加えている。本プロトコールでは全膜画分からの精製を行っているが、状況に応じて、大腸菌の内膜と外膜をスクロース密度濃度勾配法によって分離し、内膜画分を回収後、内膜画分から蛋白質を精製することも可能である。内膜画分からの蛋白質精製は純度が向上するという長所もあるが、収量が下がるという短所もある。
3)膜蛋白質の可溶化、Ni-NTAカラム(第3日目)
膜画分を氷上で溶解し、20mM Tris-HCl(pH8.0)、5% glycerol、300mM NaCl、0.1mM Pefabloc、300mM NaClのバッファーを用いて約200mLとする。そこに終濃度が 20mM imidazole-HCl (pH7.0)、2% ドデシルマルトシド(DDM)(*9)となるように、4M imidazole-HCl(pH7.0)溶液(*10)、および10% DDM溶液を加える。緩やかにスターラーで30minほど撹拌させることで、膜蛋白質を可溶化させる。可溶化後、超遠心(110,000g × 30min)により不溶性画分を取り除き、上清を20mM Tris-HCl(pH8.0)、300mM NaCl、0.1% DDM、5% glycerol、0.1mM Pefabloc、20mM imidazole-HCl(pH8.0)で平衡化した5mL Ni-NTA Superflow(QIAGEN)に添加し、バッチ法によりSecDFを樹脂に吸着させる。15mLの20mM Tris-HCl(pH8.0)、300mM NaCl、0.1% DDM、5% glycerol、0.1mM Pefabloc、30mM imidazole-HCl(pH7.0)でカラムを洗浄したのち、imidazole-HCl(pH7.0)の濃度を段階的に上昇させ、SecDF蛋白質を溶出させる(*11)。SDS-PAGEによって溶出蛋白質を確認する(図1)。
*9 膜蛋白質によって適切な界面活性が異なる。
*10 imidazole は塩基性が強いのであらかじめpHを調整しておく。
*11 洗浄・溶出に用いたバッファーと体積を以下に示す。
30mM imidazole溶液 : 15mL
40mM imidazole溶液 : 30mL
60mM imidazole溶液 : 5mL
100mM imidazole溶液 : 5mL
150mM imidazole溶液 : 5mL
300mM imidazole溶液 : 20mL
4)陽イオン交換カラム(第4日目)
SecDFを含む画分(図1 下線部)を回収し、超遠心(110,000g × 30min)で不溶性物質を取り除いた後(*11)、Amicon Ultra-15 30K NMWL(Millipore) を用いて、約4mLまで濃縮を行う。その後、脱塩カラム[HiTrap Desalting(GE Healthcare) 5mL ×3個]でバッファーを20mM Tris-HCl(pH7.0)、0.1% DDM、5% glycerol、0.1mM Pefablocに置換しする(*12)。超遠心(100,000g × 30min)により濃縮過程で生じた不溶性物質を取り除く。 20mM Tris-HCl(pH7.0)、0.1% DDM、5% glycerol、0.1mM Pefablocで平衡したHiTrapSP 1mL(GE Healthcare)に蛋白質を吸着させ(*13)、平衡化バッファーで10mLカラムの洗浄を行い、続いて20mLのNaClの濃度勾配(0-1M NaClの濃度勾配)で蛋白質を溶出させる。SDS-PAGEによって溶出蛋白質を確認する(図2)。
*11 Ni-NTA カラムから溶出した溶液は、不溶性となる物質が多く存在する。超遠心を行うことで不溶性画分を取り除き、続く濃縮過程をスムーズに進めることができる。
*12 Amicon Ultraで何度か濃縮希釈を繰り返してBuffer交換することも可能である。
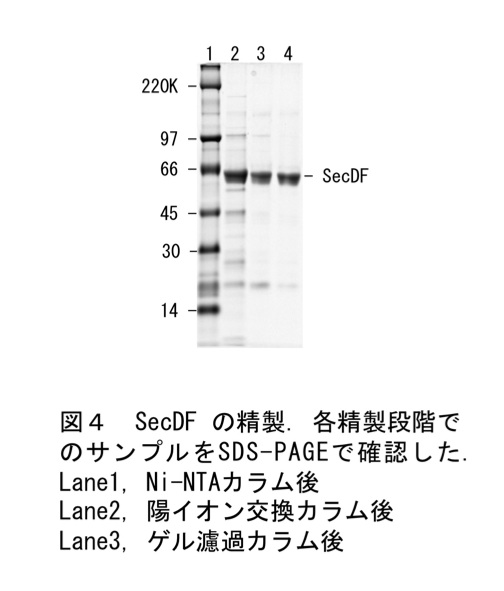
*13 大腸菌の蛋白質は陰イオン交換カラムに結合するものが多いため、陽イオン交換カラムを用いることができれば、純度が大幅に向上する(図4)。
5)ゲル濾過カラム(第5日目)
SecDFを高純度で含む画分(図2 下線部)を回収し、Amicon Ultra-15 NMWL 30K(Millipore)を用いて蛋白質を約400μLまで濃縮後、20mM Tris-HCl(pH8.0)、300mM NaCl 0.1% DDM、5% glycerol、0.1mM Pefablocで平衡化したSuperdex 200 10/300 GL(GE Healthcare)によりゲル濾過カラムを行う(図3)。サンプルは約200μLずつ2回に分けてアプライする(*14)。SDS-PAGEによって溶出蛋白質を確認する(図3)
*14 Superdex 200 10/300 カラムの推奨されているサンプル体積は250μL以下であるため、2度に分けて行う。
6)透析・結晶化(第6日目)
純度の高いSecDFの画分(図3 下線部)(*15)を回収し、濃度をNanoDrop(Thermo SCIENTIFIC)で測定する。SecDFの場合はAbs280nm=0.64を1mg/mLとして蛋白量を見積もっている。次にAmicon Ultra-4 30 K NMWL(Millipore)を用いて濃度が10mg/mL 以上になるように濃縮し、遠心(10,000g × 20min)を行う。上清をMicro Dializer透くん 分画分子量:14,000(日本ジェネティクス)(*16)を用いて50mLの0.02% DDM(*17)で透析(2時間以上 × 2回)を行う。続いて、超遠心(110,000g × 30min)を行い、その上清を最終精製産物とする。サンプルの濃度を測定し、8mg/mLになるように、透析バッファーで希釈し結晶化サンプルとする。通常この精製過程により、約3mgの結晶化サンプルが得られる(図4)。この精製SecDF溶液と結晶化バッファー(26% PEG400、0.2M 酢酸ナトリウム)を2:1で混合し、ハンギングドロップ法で結晶化を進め良好に結晶が成長した場合、図5に示した美しい8面体の結晶が形成する。結晶化方法の詳しい内容は文献(5)を参照されたい。4Å分解能を超えるX線の回折データが収集できるSecDFの結晶は100個に一つあるかないかであるが(*18)、最終的に3.5Å分解能のX線回折データの収集に成功し、SecDFの構造解析を達成した(Tsukazaki et al., 論文作製中)。
*15 ゲル濾過カラムから溶出された低純度の画分は結晶しないため、高純度の画分のみ回収する。
*16 微量透析装置はいくつか試したが、微量の透析には透くんが使いやすい。透くんはその仕様上、空気の膨張、収縮の影響をうけるため、使用前に透くんを使用する温度に十分冷やしておく必要がある。
*17 透析バッファーは0.02%DDM溶液のみで、塩やバッファーは含まれていない。SecDFは、塩やバッファー等がなくても安定な蛋白質であったので、透析において界面活性剤を除くすべての試薬を取り除くことが可能である。蛋白質溶液から結晶化実験に持ち込むバッファーの影響を最小限にするためにこのような方法をとっている。
*18 SecDF結晶の質は見かけでは判断がつかないため、比較的大きく成長した300μm以上の結晶はすべてX線回折像の測定を行う。
-

図1 -

図2 -

図3 -

図4 -

図5
工夫とコツ
膜蛋白質の発現確認
膜蛋白質を細胞内に過剰に発現させた場合、通常その膜画分に蓄積するため、細胞あたりの発現量が少なく、検出が容易ではない。筆者はN末端もしくはC末端に精製のためのHis6タグを付加させた蛋白質として発現させ、ウエスタンブロティングで確認することが多い。近年タグにGFPを用い、その蛍強度から発現量と蛋白質の安定性を評価できる簡便な方法が発明された(6)。タグの付加は時として蛋白質が機能を失い不安定化する場合があるので注意が必要である。
界面活性剤の選択と可溶化について
膜蛋白質の精製は、膜に埋め込まれている状態から界面活性剤による可溶化が必要であるが、適切な界面活性剤を選択しなければ精製過程で蛋白質が活性を失ったり、沈殿を起こしたりする。よく使用され購入できる界面活性剤だけでも、数十種類にものぼるため、目的蛋白質の精製に適した界面活性剤を選択することは容易ではない。筆者は、はじめに結晶構造解析の例の多いDDMを用いる。DDMを用いて蛋白質が上手く精製できない場合は、数十種類の界面活性剤を用いたスクリーニングを行う。界面活性剤による膜蛋白質の可溶化は文献(7)が詳しい。
脂質の欠落による膜蛋白質の過剰精製
膜蛋白質は生体内で脂質と強く相互作用し膜内に組込まれているが、界面活性剤による可溶化の際、膜蛋白質を覆っていた脂質の多くが界面活性剤に置換されて可溶化する。一部の脂質は膜蛋白質と強く相互作用しており蛋白質と共に精製される。しかしながら、その脂質が精製過程において欠落することがある。脂質の欠落は膜蛋白質の不安定化を引き起こしたり、良質の結晶が得られない原因となったりする(8,9)。
実験の安全
本精製方法は,通常の蛋白質精製と同様に進められる。
文献
- van den Berg, B., et al., Nature, 427, 36-44 (2004)
- Zimmer, J. et al., Nature, 455, 936-43
- Tsukazaki, T. et al., Nature, 455, 988-91 (2008)
- 森 博幸,塚崎 智也, 蛋白質核酸酵素, 54, 685-695 (2009)
- Tsukazaki, T. et al., Acta. Crystallograph. Sect. F. Struct. Biol. Cryst. Commun., 62, 909-12 (2006)
- Kawate, T. & Gouaux, E. Structure, 14, 673-81 (2006)
- 村上 聡, タンパク質をつくる (長谷俊治,高尾敏文,高木淳一) 107-133, 化学同人 (2008)
- Zhang, H., L. et al., Proc. Natl. Acad. Sci., 100, 5160-3 (2003)
- Guan, L., et al., Proc. Natl. Acad. Sci., 103, 1723-26 (2006)