概要
生体内では、生命活動を維持するために多くの蛋白質が機能している。その中には蛋白質が単独で機能するものも存在するが、生体内に存在するほとんどの蛋白質は多種類の蛋白質が会合して巨大複合体を形成することで必要な機能を発揮している。これまでに安定な蛋白質複合体については立体構造解析が活発に進められ、数多くの複合体の立体構造が報告されている。一方、シグナル伝達経路や転写・複製といった反応系で働く分子の多くは、それぞれの分子が担う反応のON/OFFに対応して一過性の蛋白質複合体を形成するため、生体試料から複合体を精製することが難しい。さらに、複合体が維持される条件と複合体の結晶化条件が重複するとは限らないため、精製した蛋白質複合体のサブユニットを解離させずに結晶化させるのは困難であり、これら一過性の蛋白質複合体の立体構造解析は進展していない。
本稿では、μMオーダーの解離定数を持つヒストンシャペロンCIA/ASF1-ブロモドメイン複合体について、筆者らが構造解析に成功した経験を踏まえて、それらの複合体試料をどのように調製し、構造解析に使用できるレベルの結晶を作製したのかについて紹介する。
装置・器具・試薬
- 遠心機(各社)
- 分光光度計(Beckman Coulter)
- Amicon Ultra-15 MWCO=10K(Millipore)
- 結晶化スクリーニングキット(Hampton Research, Emerald BioSystems)
- カバーガラス(Hampton Research)
- 結晶化プレート(Hampton Research)
- インキュベーター(各社)
- クライオループ(Hampton Research)
- SDSゲル電気泳動装置(各社)
実験の手順
1)複合体試料の調製
2)複合体試料の結晶化
3)結晶内のタンパク質の同定
4)結晶化条件の最適化
実験の詳細
1)複合体試料の調製
複合体試料を調整する方法として、1)生体試料から精製する系、2)複合体を構成する組換え蛋白質を一つの細胞内で同時に発現させる系(共発現系)、そして、3)複合体を構成する各蛋白質を別々に精製した組換え蛋白質を用いて複合体を再構成させる系の3つが挙げられる。細胞内での発現量が多く安定して複合体を形成する蛋白質複合体では、1)や2)の方法を用いて複合体試料を調製することが可能である。一方、特定の反応系において一過性に働く蛋白質複合体では、複合体を構成する蛋白質-蛋白質間の相互作用は弱く、解離と会合の速度が速いため、1)や2)の方法で複合体を精製することは難しい。CIA/ASF1-ブロモドメイン複合体については、筆者らによる等温滴定カロリメトリーを用いた相互作用解析から~数百μMの解離定数を持つこと(未発表)、ブロモドメインが含まれる転写基本因子TFIIDが15種類のサブユニットから構成される約1 MDaの巨大複合体であるために、複合体全体の精製は困難であることから、3)の方法で複合体試料を調製することが最適であると考えた。そこで筆者らは、CIA/ASF1とブロモドメインが相互作用する領域を組換え蛋白質として発現させ、精製したCIA/ASF1(1-172)とブロモドメイン(1342-1629)を混合することで複合体試料を調製することにした。
CIA/ASF1とブロモドメインの二種類の蛋白質について、それぞれ大腸菌内で過剰発現させ、ニッケルアフィニティーとイオン交換クロマトグラフィーを用いて純度90%以上になるように精製を行う(1)。精製したCIA/ASF1とブロモドメインを280 nmの波長を使って定量し、モル比で1:1となるように混合することで複合体溶液を調製する(図1)(*1)。
ここで、複合体溶液の調製法として、CIA/ASF1とブロモドメインを先に混ぜ合わせてから試料を濃縮して結晶化する方法と、二種類の蛋白質を別々に濃縮した後に混ぜ合わせて結晶化を行う方法の二通りが考えられる。2つの方法を比較したところ、前者の方が、結晶のサイズが大きく、再現性よく結晶を得られた。結晶化の再現性を向上させた理由としては、濃度の低い試料を混ぜ合わせて濃縮し結晶化の直前に希釈操作を行わなかったことによって両者の解離を抑えられたのではないかと推察される。(ただし後述するように、実験においてはバッファー交換の目的も兼ねて濃縮と希釈を繰り返しているので、結晶化が改善した理由が、単純に希釈操作の有無と濃縮の効果だけではないのかもしれない。)
CIA/ASF1-ブロモドメイン複合体溶液をAmicon Ultra-15 MWCO=10K(Millipore)に添加し、濃度勾配ができるように遠心速度を1500 rpm → 3000 rpm → 5000 rpmへと段階的に上げながら約1 mLまで濃縮する。段階的に遠心速度を上昇させることで、濃縮フィルターへの蛋白質の非特異的な吸着を抑えることができる。約1 mL程度まで濃縮されたところで、バッファー(20 mM Tris-HCl pH 7.5, 150 mM NaCl, 5% glycerol, 5 mM 2-mercaptoethanol)を10 mL添加して、5000 rpm, 4℃の条件で濃縮する。濃縮と希釈を3回繰り返し、バッファー交換を行う。終濃度15~20 mg/mLになるまで濃縮して、結晶化サンプルとする。
(*1)純度90%以上のCIA/ASF1とブロモドメインを1:1で混合した後、ゲル濾過カラムによって複合体と単体を分離することを試みた(2)。しかしながら、両者の相互作用は弱いことからゲル濾過カラム内で希釈されてしまい、複合体を検出することはできなかった。このような速い速度で解離と会合を繰り返しながら、弱く相互作用する蛋白質複合体について、筆者らは高い蛋白質濃度を維持しながらも測定が可能なGSTプルダウンアッセイ、超遠心分析、等温滴定カロリメトリーなどの手法を用いて相互作用解析を行っている。
2)複合体試料の結晶化
2-1)1次スクリーニング
1)により調製したCIA/ASF1-ブロモドメイン複合体溶液を用いて、結晶化の初期条件を探索する。Crystal screen(Hampton Research社)とWizard(Emerald BioSystems社)を用いて、カバーガラス上でタンパク質溶液(1μL)とリザーバー溶液(1μL)を等量混ぜ合わせ、リザーバー溶液(500μL)、ドロップレットの容量(2μL)、20℃の条件でハンギングドロップ蒸気拡散法により結晶化を行う。1次スクリーニングを行ったところ、10種類の結晶化条件において、50μm程度の微結晶の成長が認められた。具体的には、Potassium/sodium tartrate, Li2SO4を塩とする結晶化条件や硫酸アンモニウムを沈殿剤とする結晶化条件で結晶が得られた。
2-2)2次スクリーニング
2-1)で得られたすべての結晶化条件について、新たに精製した複合体試料を用いて結晶化の再現性を検証する。2次スクリーニングを行ったところ、10種類の結晶化条件において1)と同様に再現性よく50μm程度の微結晶が得られた。次に、再現性がとれた10種類の結晶化条件について、沈殿剤の濃度(0.2 M刻み)やpH(0.5-1刻み)を細かく振って、より詳細な結晶化条件の検討を行う。結晶化の行ったところ、0.9-1.1 M NH4SO4, 0.1 M MES pH 5.6-5.7の条件で最も再現性よく結晶化し、一週間ほどで回折実験に利用できる約100μm程度の結晶が得られた。さらに、高エネルギー加速器研究機構(つくば)のシンクロトロン放射光施設にて、これらの結晶にX線を照射することによってタンパク質の結晶であることを確認した。得られた結晶は、低分解能(4 Å程度)の領域に同心円状の回折点を示し、六方晶系である空間群P6122に属していた。上記の結晶化条件をもとに、バッファー系をMESからHEPES, Tris, Imidazoleなどに変更した条件やdetergent screenによる結晶化を行ったが、結晶の更なる大きさの成長は観察されなかった。また、4 ℃でも結晶化を行ったが、結晶は全く得られなかった。従って、再現性がよく短期間で結晶が得られる、硫酸アンモニウムとMESを主な結晶化条件とした。
3)結晶内のタンパク質の同定
2)で得られた結晶がCIA/ASF1もしくはブロモドメインを含む単体の結晶であるのか、CIA/ASF1とブロモドメインを含む複合体の結晶であるのか、結晶化条件だけでは判断できない。そこで、下記の方法により、結晶内にCIA/ASF1及びブロモドメインが含まれていることを確認する。通常、セレノメチオニン置換体タンパク質の結晶は多波長異常分散(MAD)法による位相決定に利用される。筆者らは、この結晶をMAD法による位相決定を試みるだけでなく、結晶内に目的タンパク質が含まれるかどうか検証する方法としても利用した。
3-1)セレノメチオニン置換体タンパク質を利用した複合体の結晶化
メチオニンをセレノメチオニンに置換したCIA/ASF1(SeMet-CIA/ASF)及びブロモドメイン(SeMet-ブロモドメイン)を1)のネイティブタンパク質と同じ方法で精製する(*2)。精製したセレノメチオニン置換体タンパク質とネイティブタンパク質を組み合わせて、1)の方法によりSeMet-CIA/ASF1-ブロモドメイン複合体、CIA/ASF1-SeMet-ブロモドメイン複合体の溶液を調製する。2)の方法により結晶化を行うと、一週間ほどで2種類のセレノメチオニン置換体タンパク質の結晶が得られる。SeMet-CIA/ASF1-ブロモドメイン複合体では、ネイティブの結晶と同等の約50μmの微結晶が得られる。一方、CIA/ASF1-SeMet-ブロモドメイン複合体では、ネイティブの結晶に比べて大きく厚みが増した約150μmの六角柱の結晶が得られる。一般的に、セレノメチオニン置換体タンパク質はネイティブタンパク質に比べて疎水性が高く溶解度が低いため、ネイティブタンパク質と同じ結晶化条件では、沈殿を生じやすい傾向にあるが、CIA/ASF1-SeMet-ブロモドメイン複合体の結晶ではセレノメチオニンを導入したことにより大きな結晶を得ることができた。以下、CIA/ASF1-SeMet-ブロモドメイン複合体の結晶化条件の最適化を進めることにした。
(*2)セレノメチオニンは毒物に指定されており、取り扱いおよび保管には注意を要する。
3-2)XAFS(X-ray Absorption Fine Structure)測定
3-1)で得られた2種類の結晶中にSeMet-CIA/ASF1もしくはSeMet-ブロモドメインが含まれているのか検証するため、高エネルギー加速器研究機構(つくば)のシンクロトロン放射光施設にてXAFS測定を行う。セレン原子からの異常分散をMCA(Multi channel analyzer)を用いて分析すると、散乱X線、セレン原子からの蛍光X線の2つのピークが得られる。X線の波長を変化させながら再度XAFS測定を行うと、2種類の結晶共に蛍光X線が消失することから、結晶内にSeMet-CIA/ASF1とSeMet-ブロモドメインが含まれていることを確認した。
3-3)SDSゲル電気泳動
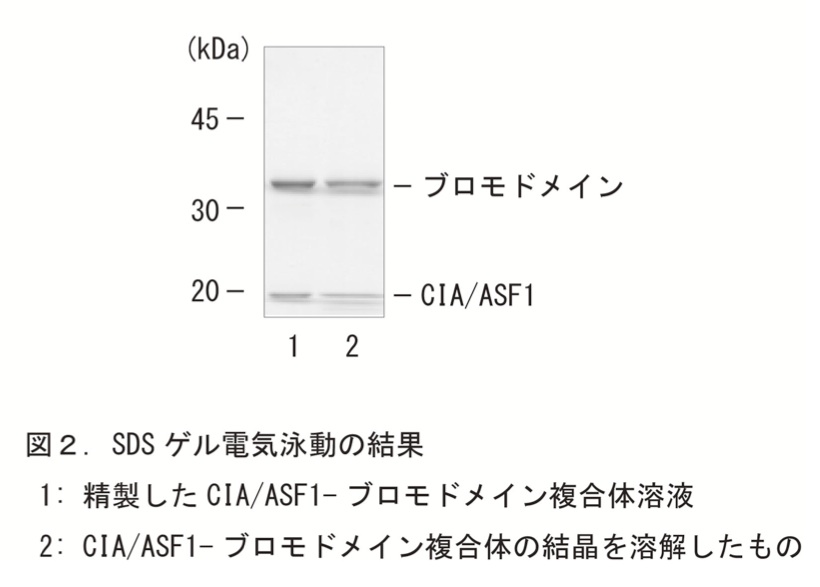
クライオループ(0.1-0.2 mm)を使って結晶の得られたドロップレットから150μm程度の結晶を拾い上げ、あらかじめ用意しておいたリザーバー溶液(5μL)(2.0 M NH4SO4, 0.1 M MES pH 5.6-5.7)に入れる(*3)。クライオループで結晶に付着している沈殿物を慎重に取り除き、沈殿物が除けたならば、結晶を新しいリザーバー溶液(5μL)に移す。1つの結晶に対して、上記の洗浄作業を3回繰り返し、合計6つの結晶を集める。これらの結晶を電気泳動用の2 xサンプルバッファー(5μL)に溶かして、SDSゲル電気泳動を行う。CBB染色により結晶中に含まれるCIA/ASF1とブロモドメインを確認した(図2)。
(*3)結晶の溶解を防ぐため、沈殿剤は結晶化条件よりも高い濃度で調製しておく。また、得られる結晶が少ない場合は、XAFS測定に使用した結晶を液体窒素で凍結してドライシッパーで研究室に持ち帰り、3ー3)の実験に利用するとよい。
4)結晶化条件の最適化
前述の通り、セレノメチオニン置換体のブロモドメインを利用することで150μm程度の結晶を得ることができた。低分解能の回折を示す50μm程度の微結晶は再現性よく得られるものの、より高分解能の回折を示す150μmを超える結晶は、1つのプレートに3~4ドロップの確率でしか得られていなかった。複合体の立体構造決定には、より高分解能の回折を示す結晶が大量に必要である。高分解能の回折を示す結晶を効率よく得るために、結晶化に用いる蛋白質のアミノ酸配列の検討と結晶化条件の最適化を行う。
4-1)結晶化に用いる蛋白質のアミノ酸配列の検討
前述の通り、ブロモドメインは転写基本因子TFIIDのダブルブロモドメインを含む領域(1342-1629)を使用しており、アミノ酸配列の検討は行わなかった。CIA/ASF1については、これまでに決定されているCIA/ASF1の立体構造(3,4,5)を参考にして、保存性の高い領域を含まないフレキシブルなC末端の領域を少しずつ短くし、5種類のコンストラクト(1-155, 1-156, 1-158, 1-160, 1-164)を作製する。ネイティブタンパク質と同じ手順で精製し、1)と2)の方法により複合体溶液の調製及び結晶化を行う。結晶化を行ったところ、ヒストンH3-H4との相互作用に重要とされる領域を含みかつ保存性の高いCIA/ASF1(1-155)を利用することによって、400μm程度の結晶が得られるようになった。
CIA/ASF1のC末端の領域を除いたことによって、結晶が大きく成長したことに加えてさらにmerohedral twin 結晶が解消された。Merohedral twinが解消された理由として、2回軸対称に位置するCIA/ASF1の一方の分子が結晶中からはがれ落ちてしまったのではないかと推察される。Merohedral twin 結晶とは、a軸とb軸が等しい結晶系(hexagonal, trigonal, tetragonal, cubic)において、結晶中のある部分が上下逆向きに成長して上向きと下向きに配置した単位を持つ結晶のことである。Merohedral twin結晶の場合、回折点も上向き(h,k,l)と下向き(h,k,-l)の回折点が存在することになり、実際の構造解析には上向きと下向きの反射点を分離して解析を行う必要がある。Merohedral twin 結晶の兆候については、CCP4のTwinに関する記述を参照されたい(6)。merohedral twin結晶であるか否かについては、結晶の観察や回折像から判断できない場合が多く、得られた反射強度分布を調べることが必要である。筆者は、Uppsala Software FactoryのDataman package中のlocal intensityを用いて、merohedral twin結晶の判定を行った(7)。
4ー2)塩の添加
更なる結晶化条件の最適化を進めるため、添加する塩の種類や濃度条件の検討を行う。2)の1次スクリーニングでPotassium/sodium tartrate, Li2SO4を塩とする結晶化条件においてCIA/ASF1-ブロモドメイン複合体の結晶が得られていたことから、0.9-1.1 M NH4SO4(0.5刻み), 0.1M MES pH 5.6-5.7(0.05刻み)の結晶化条件に0.2-0.25 M のPottasium/Sodium tartrate, Li2SO4を添加したリザーバー溶液を作製し、1)と2)の方法で結晶化を行う。結晶化を行ったところ、0.2-0.25 M Li2SO4を含む結晶化条件で1プレートに5~6ドロップの確率で400μm程度の結晶が得られるようになった。以上の方法により、0.9-1.1 M NH4SO4(0.5刻み), 0.1M MES pH 5.6-5.7(0.05刻み), 0.2-0.25 M Li2SO4の結晶化条件で効率よくCIA/ASF1-ブロモドメイン複合体の結晶を得られるようになった(図3)。高エネルギー加速器研究機構(つくば)のシンクロトロン放射光施設にて、これらの結晶にX線を照射する、最大で2.7 Å分解能の回折点が観測された。回折点は異方性を生じていたが、3.0 Å分解能のX線回折データを収集することに成功し、分子置換法を用いてCIA/ASF1-ブロモドメイン複合体の構造解析を達成した(1)。最終的に、結晶化から立体構造を決定するまでに約2年半を要した。
工夫とコツ
結晶化条件のスクリーニング
タンパク質の結晶化において、1次スクリーニングでは結晶が得られない場合が多々ある。その場合、当研究室では、蛋白質溶液とリザーバー溶液を混合した直後にドロップレットを観察し、すぐに沈殿が生じ、その後、沈殿が溶けていく傾向がある条件が、結晶を生じる条件に近いと考え、丹念に探索している。
結晶化条件の最適化
結晶が大きく成長しない場合には、エタノールやジオキサンなどを終濃度2~3%となるように結晶化ドロップに加えて結晶化するとよい。エタノールやジオキサンなどの添加剤を加えることで、ドロップレットにできる結晶の数や大きさを調節することができる。
結晶内のタンパク質の同定
前述の通り、大きな結晶が数多く得られている場合では、結晶を回収してSDSゲル電気泳動することで結晶内のタンパク質を同定できる。微小結晶の場合では、蛍光色素(Cy3など)を結合させた目的タンパク質を結晶化し、その蛍光強度を検出することによって目的タンパク質を含む結晶であるかどうか評価するという報告もある(8)。
無酸素条件下での結晶化
CIA/ASF1-ブロモドメイン複合体の結晶は、結晶化ドロップ表面にできる薄い膜に対して垂直に結晶が成長する傾向があり、酸化還元状態をコントロールすることで高品質の結晶が得られると考えられた。そこで、当研究室が保有する無酸素チャンバー(Anaerobox ’HARD’, 平沢製作所)内で結晶化を試みた。しかしながら、無酸素チャンバー内で結晶化したドロップ表面には薄い膜は形成されず、結晶の成長も認められなかった。酸化還元状態を制御してCIA/ASF1-ブロモドメイン複合体の結晶の質を向上させることはできなかったが、無酸素条件下において蛋白質複合体の結晶化に成功された例もあるので、興味のある方は文献(9,10)を参照されたい。
文献
- Akai, Y. et al., Proc Natl Acad Sci U S A., 107, 8153-8 (2010)
- 高久誉大, 胡桃坂仁志, 蛋白質科学会アーカイブ, 1, e003 (2008)
- Daganzo, S. M., et al., Curr Biol., 13, 2148-58 (2003)
- Mousson, F., et al., Proc Natl Acad Sci U S A., 102, 5975-80 (2005)
- Padmanabhan, B., et al., J Biochem., 138, 821-9 (2005)
- http://www.ccp4.ac.uk/html/twinning.html#warning
- http://xray.bmc.uu.se/usf/dataman_man.html
- Kettenberger, H. & Cramer, P., Acta Crystallogr D Biol Crystallogr., 62, 146-50 (2006)
- Fu, J., et al., Cell, 98, 799-810 (1999)
- Senda, M., et al., J Mol Biol. 373, 382-400 (2007)
概要
生体内では、生命活動を維持するために多くの蛋白質が機能している。その中には蛋白質が単独で機能するものも存在するが、生体内に存在するほとんどの蛋白質は多種類の蛋白質が会合して巨大複合体を形成することで必要な機能を発揮している。これまでに安定な蛋白質複合体については立体構造解析が活発に進められ、数多くの複合体の立体構造が報告されている。一方、シグナル伝達経路や転写・複製といった反応系で働く分子の多くは、それぞれの分子が担う反応のON/OFFに対応して一過性の蛋白質複合体を形成するため、生体試料から複合体を精製することが難しい。さらに、複合体が維持される条件と複合体の結晶化条件が重複するとは限らないため、精製した蛋白質複合体のサブユニットを解離させずに結晶化させるのは困難であり、これら一過性の蛋白質複合体の立体構造解析は進展していない。
本稿では、μMオーダーの解離定数を持つヒストンシャペロンCIA/ASF1-ブロモドメイン複合体について、筆者らが構造解析に成功した経験を踏まえて、それらの複合体試料をどのように調製し、構造解析に使用できるレベルの結晶を作製したのかについて紹介する。
装置・器具・試薬
- 遠心機(各社)
- 分光光度計(Beckman Coulter)
- Amicon Ultra-15 MWCO=10K(Millipore)
- 結晶化スクリーニングキット(Hampton Research, Emerald BioSystems)
- カバーガラス(Hampton Research)
- 結晶化プレート(Hampton Research)
- インキュベーター(各社)
- クライオループ(Hampton Research)
- SDSゲル電気泳動装置(各社)
実験の手順
1)複合体試料の調製
2)複合体試料の結晶化
3)結晶内のタンパク質の同定
4)結晶化条件の最適化
実験の詳細
1)複合体試料の調製
複合体試料を調整する方法として、1)生体試料から精製する系、2)複合体を構成する組換え蛋白質を一つの細胞内で同時に発現させる系(共発現系)、そして、3)複合体を構成する各蛋白質を別々に精製した組換え蛋白質を用いて複合体を再構成させる系の3つが挙げられる。細胞内での発現量が多く安定して複合体を形成する蛋白質複合体では、1)や2)の方法を用いて複合体試料を調製することが可能である。一方、特定の反応系において一過性に働く蛋白質複合体では、複合体を構成する蛋白質-蛋白質間の相互作用は弱く、解離と会合の速度が速いため、1)や2)の方法で複合体を精製することは難しい。CIA/ASF1-ブロモドメイン複合体については、筆者らによる等温滴定カロリメトリーを用いた相互作用解析から~数百μMの解離定数を持つこと(未発表)、ブロモドメインが含まれる転写基本因子TFIIDが15種類のサブユニットから構成される約1 MDaの巨大複合体であるために、複合体全体の精製は困難であることから、3)の方法で複合体試料を調製することが最適であると考えた。そこで筆者らは、CIA/ASF1とブロモドメインが相互作用する領域を組換え蛋白質として発現させ、精製したCIA/ASF1(1-172)とブロモドメイン(1342-1629)を混合することで複合体試料を調製することにした。
CIA/ASF1とブロモドメインの二種類の蛋白質について、それぞれ大腸菌内で過剰発現させ、ニッケルアフィニティーとイオン交換クロマトグラフィーを用いて純度90%以上になるように精製を行う(1)。精製したCIA/ASF1とブロモドメインを280 nmの波長を使って定量し、モル比で1:1となるように混合することで複合体溶液を調製する(図1)(*1)。
ここで、複合体溶液の調製法として、CIA/ASF1とブロモドメインを先に混ぜ合わせてから試料を濃縮して結晶化する方法と、二種類の蛋白質を別々に濃縮した後に混ぜ合わせて結晶化を行う方法の二通りが考えられる。2つの方法を比較したところ、前者の方が、結晶のサイズが大きく、再現性よく結晶を得られた。結晶化の再現性を向上させた理由としては、濃度の低い試料を混ぜ合わせて濃縮し結晶化の直前に希釈操作を行わなかったことによって両者の解離を抑えられたのではないかと推察される。(ただし後述するように、実験においてはバッファー交換の目的も兼ねて濃縮と希釈を繰り返しているので、結晶化が改善した理由が、単純に希釈操作の有無と濃縮の効果だけではないのかもしれない。)
CIA/ASF1-ブロモドメイン複合体溶液をAmicon Ultra-15 MWCO=10K(Millipore)に添加し、濃度勾配ができるように遠心速度を1500 rpm → 3000 rpm → 5000 rpmへと段階的に上げながら約1 mLまで濃縮する。段階的に遠心速度を上昇させることで、濃縮フィルターへの蛋白質の非特異的な吸着を抑えることができる。約1 mL程度まで濃縮されたところで、バッファー(20 mM Tris-HCl pH 7.5, 150 mM NaCl, 5% glycerol, 5 mM 2-mercaptoethanol)を10 mL添加して、5000 rpm, 4℃の条件で濃縮する。濃縮と希釈を3回繰り返し、バッファー交換を行う。終濃度15~20 mg/mLになるまで濃縮して、結晶化サンプルとする。
(*1)純度90%以上のCIA/ASF1とブロモドメインを1:1で混合した後、ゲル濾過カラムによって複合体と単体を分離することを試みた(2)。しかしながら、両者の相互作用は弱いことからゲル濾過カラム内で希釈されてしまい、複合体を検出することはできなかった。このような速い速度で解離と会合を繰り返しながら、弱く相互作用する蛋白質複合体について、筆者らは高い蛋白質濃度を維持しながらも測定が可能なGSTプルダウンアッセイ、超遠心分析、等温滴定カロリメトリーなどの手法を用いて相互作用解析を行っている。
2)複合体試料の結晶化
2-1)1次スクリーニング
1)により調製したCIA/ASF1-ブロモドメイン複合体溶液を用いて、結晶化の初期条件を探索する。Crystal screen(Hampton Research社)とWizard(Emerald BioSystems社)を用いて、カバーガラス上でタンパク質溶液(1μL)とリザーバー溶液(1μL)を等量混ぜ合わせ、リザーバー溶液(500μL)、ドロップレットの容量(2μL)、20℃の条件でハンギングドロップ蒸気拡散法により結晶化を行う。1次スクリーニングを行ったところ、10種類の結晶化条件において、50μm程度の微結晶の成長が認められた。具体的には、Potassium/sodium tartrate, Li2SO4を塩とする結晶化条件や硫酸アンモニウムを沈殿剤とする結晶化条件で結晶が得られた。
2-2)2次スクリーニング
2-1)で得られたすべての結晶化条件について、新たに精製した複合体試料を用いて結晶化の再現性を検証する。2次スクリーニングを行ったところ、10種類の結晶化条件において1)と同様に再現性よく50μm程度の微結晶が得られた。次に、再現性がとれた10種類の結晶化条件について、沈殿剤の濃度(0.2 M刻み)やpH(0.5-1刻み)を細かく振って、より詳細な結晶化条件の検討を行う。結晶化の行ったところ、0.9-1.1 M NH4SO4, 0.1 M MES pH 5.6-5.7の条件で最も再現性よく結晶化し、一週間ほどで回折実験に利用できる約100μm程度の結晶が得られた。さらに、高エネルギー加速器研究機構(つくば)のシンクロトロン放射光施設にて、これらの結晶にX線を照射することによってタンパク質の結晶であることを確認した。得られた結晶は、低分解能(4 Å程度)の領域に同心円状の回折点を示し、六方晶系である空間群P6122に属していた。上記の結晶化条件をもとに、バッファー系をMESからHEPES, Tris, Imidazoleなどに変更した条件やdetergent screenによる結晶化を行ったが、結晶の更なる大きさの成長は観察されなかった。また、4 ℃でも結晶化を行ったが、結晶は全く得られなかった。従って、再現性がよく短期間で結晶が得られる、硫酸アンモニウムとMESを主な結晶化条件とした。
3)結晶内のタンパク質の同定
2)で得られた結晶がCIA/ASF1もしくはブロモドメインを含む単体の結晶であるのか、CIA/ASF1とブロモドメインを含む複合体の結晶であるのか、結晶化条件だけでは判断できない。そこで、下記の方法により、結晶内にCIA/ASF1及びブロモドメインが含まれていることを確認する。通常、セレノメチオニン置換体タンパク質の結晶は多波長異常分散(MAD)法による位相決定に利用される。筆者らは、この結晶をMAD法による位相決定を試みるだけでなく、結晶内に目的タンパク質が含まれるかどうか検証する方法としても利用した。
3-1)セレノメチオニン置換体タンパク質を利用した複合体の結晶化
メチオニンをセレノメチオニンに置換したCIA/ASF1(SeMet-CIA/ASF)及びブロモドメイン(SeMet-ブロモドメイン)を1)のネイティブタンパク質と同じ方法で精製する(*2)。精製したセレノメチオニン置換体タンパク質とネイティブタンパク質を組み合わせて、1)の方法によりSeMet-CIA/ASF1-ブロモドメイン複合体、CIA/ASF1-SeMet-ブロモドメイン複合体の溶液を調製する。2)の方法により結晶化を行うと、一週間ほどで2種類のセレノメチオニン置換体タンパク質の結晶が得られる。SeMet-CIA/ASF1-ブロモドメイン複合体では、ネイティブの結晶と同等の約50μmの微結晶が得られる。一方、CIA/ASF1-SeMet-ブロモドメイン複合体では、ネイティブの結晶に比べて大きく厚みが増した約150μmの六角柱の結晶が得られる。一般的に、セレノメチオニン置換体タンパク質はネイティブタンパク質に比べて疎水性が高く溶解度が低いため、ネイティブタンパク質と同じ結晶化条件では、沈殿を生じやすい傾向にあるが、CIA/ASF1-SeMet-ブロモドメイン複合体の結晶ではセレノメチオニンを導入したことにより大きな結晶を得ることができた。以下、CIA/ASF1-SeMet-ブロモドメイン複合体の結晶化条件の最適化を進めることにした。
(*2)セレノメチオニンは毒物に指定されており、取り扱いおよび保管には注意を要する。
3-2)XAFS(X-ray Absorption Fine Structure)測定
3-1)で得られた2種類の結晶中にSeMet-CIA/ASF1もしくはSeMet-ブロモドメインが含まれているのか検証するため、高エネルギー加速器研究機構(つくば)のシンクロトロン放射光施設にてXAFS測定を行う。セレン原子からの異常分散をMCA(Multi channel analyzer)を用いて分析すると、散乱X線、セレン原子からの蛍光X線の2つのピークが得られる。X線の波長を変化させながら再度XAFS測定を行うと、2種類の結晶共に蛍光X線が消失することから、結晶内にSeMet-CIA/ASF1とSeMet-ブロモドメインが含まれていることを確認した。
3-3)SDSゲル電気泳動
クライオループ(0.1-0.2 mm)を使って結晶の得られたドロップレットから150μm程度の結晶を拾い上げ、あらかじめ用意しておいたリザーバー溶液(5μL)(2.0 M NH4SO4, 0.1 M MES pH 5.6-5.7)に入れる(*3)。クライオループで結晶に付着している沈殿物を慎重に取り除き、沈殿物が除けたならば、結晶を新しいリザーバー溶液(5μL)に移す。1つの結晶に対して、上記の洗浄作業を3回繰り返し、合計6つの結晶を集める。これらの結晶を電気泳動用の2 xサンプルバッファー(5μL)に溶かして、SDSゲル電気泳動を行う。CBB染色により結晶中に含まれるCIA/ASF1とブロモドメインを確認した(図2)。
(*3)結晶の溶解を防ぐため、沈殿剤は結晶化条件よりも高い濃度で調製しておく。また、得られる結晶が少ない場合は、XAFS測定に使用した結晶を液体窒素で凍結してドライシッパーで研究室に持ち帰り、3ー3)の実験に利用するとよい。
4)結晶化条件の最適化
前述の通り、セレノメチオニン置換体のブロモドメインを利用することで150μm程度の結晶を得ることができた。低分解能の回折を示す50μm程度の微結晶は再現性よく得られるものの、より高分解能の回折を示す150μmを超える結晶は、1つのプレートに3~4ドロップの確率でしか得られていなかった。複合体の立体構造決定には、より高分解能の回折を示す結晶が大量に必要である。高分解能の回折を示す結晶を効率よく得るために、結晶化に用いる蛋白質のアミノ酸配列の検討と結晶化条件の最適化を行う。
4-1)結晶化に用いる蛋白質のアミノ酸配列の検討
前述の通り、ブロモドメインは転写基本因子TFIIDのダブルブロモドメインを含む領域(1342-1629)を使用しており、アミノ酸配列の検討は行わなかった。CIA/ASF1については、これまでに決定されているCIA/ASF1の立体構造(3,4,5)を参考にして、保存性の高い領域を含まないフレキシブルなC末端の領域を少しずつ短くし、5種類のコンストラクト(1-155, 1-156, 1-158, 1-160, 1-164)を作製する。ネイティブタンパク質と同じ手順で精製し、1)と2)の方法により複合体溶液の調製及び結晶化を行う。結晶化を行ったところ、ヒストンH3-H4との相互作用に重要とされる領域を含みかつ保存性の高いCIA/ASF1(1-155)を利用することによって、400μm程度の結晶が得られるようになった。
CIA/ASF1のC末端の領域を除いたことによって、結晶が大きく成長したことに加えてさらにmerohedral twin 結晶が解消された。Merohedral twinが解消された理由として、2回軸対称に位置するCIA/ASF1の一方の分子が結晶中からはがれ落ちてしまったのではないかと推察される。Merohedral twin 結晶とは、a軸とb軸が等しい結晶系(hexagonal, trigonal, tetragonal, cubic)において、結晶中のある部分が上下逆向きに成長して上向きと下向きに配置した単位を持つ結晶のことである。Merohedral twin結晶の場合、回折点も上向き(h,k,l)と下向き(h,k,-l)の回折点が存在することになり、実際の構造解析には上向きと下向きの反射点を分離して解析を行う必要がある。Merohedral twin 結晶の兆候については、CCP4のTwinに関する記述を参照されたい(6)。merohedral twin結晶であるか否かについては、結晶の観察や回折像から判断できない場合が多く、得られた反射強度分布を調べることが必要である。筆者は、Uppsala Software FactoryのDataman package中のlocal intensityを用いて、merohedral twin結晶の判定を行った(7)。
4ー2)塩の添加
更なる結晶化条件の最適化を進めるため、添加する塩の種類や濃度条件の検討を行う。2)の1次スクリーニングでPotassium/sodium tartrate, Li2SO4を塩とする結晶化条件においてCIA/ASF1-ブロモドメイン複合体の結晶が得られていたことから、0.9-1.1 M NH4SO4(0.5刻み), 0.1M MES pH 5.6-5.7(0.05刻み)の結晶化条件に0.2-0.25 M のPottasium/Sodium tartrate, Li2SO4を添加したリザーバー溶液を作製し、1)と2)の方法で結晶化を行う。結晶化を行ったところ、0.2-0.25 M Li2SO4を含む結晶化条件で1プレートに5~6ドロップの確率で400μm程度の結晶が得られるようになった。以上の方法により、0.9-1.1 M NH4SO4(0.5刻み), 0.1M MES pH 5.6-5.7(0.05刻み), 0.2-0.25 M Li2SO4の結晶化条件で効率よくCIA/ASF1-ブロモドメイン複合体の結晶を得られるようになった(図3)。高エネルギー加速器研究機構(つくば)のシンクロトロン放射光施設にて、これらの結晶にX線を照射する、最大で2.7 Å分解能の回折点が観測された。回折点は異方性を生じていたが、3.0 Å分解能のX線回折データを収集することに成功し、分子置換法を用いてCIA/ASF1-ブロモドメイン複合体の構造解析を達成した(1)。最終的に、結晶化から立体構造を決定するまでに約2年半を要した。
工夫とコツ
結晶化条件のスクリーニング
タンパク質の結晶化において、1次スクリーニングでは結晶が得られない場合が多々ある。その場合、当研究室では、蛋白質溶液とリザーバー溶液を混合した直後にドロップレットを観察し、すぐに沈殿が生じ、その後、沈殿が溶けていく傾向がある条件が、結晶を生じる条件に近いと考え、丹念に探索している。
結晶化条件の最適化
結晶が大きく成長しない場合には、エタノールやジオキサンなどを終濃度2~3%となるように結晶化ドロップに加えて結晶化するとよい。エタノールやジオキサンなどの添加剤を加えることで、ドロップレットにできる結晶の数や大きさを調節することができる。
結晶内のタンパク質の同定
前述の通り、大きな結晶が数多く得られている場合では、結晶を回収してSDSゲル電気泳動することで結晶内のタンパク質を同定できる。微小結晶の場合では、蛍光色素(Cy3など)を結合させた目的タンパク質を結晶化し、その蛍光強度を検出することによって目的タンパク質を含む結晶であるかどうか評価するという報告もある(8)。
無酸素条件下での結晶化
CIA/ASF1-ブロモドメイン複合体の結晶は、結晶化ドロップ表面にできる薄い膜に対して垂直に結晶が成長する傾向があり、酸化還元状態をコントロールすることで高品質の結晶が得られると考えられた。そこで、当研究室が保有する無酸素チャンバー(Anaerobox ’HARD’, 平沢製作所)内で結晶化を試みた。しかしながら、無酸素チャンバー内で結晶化したドロップ表面には薄い膜は形成されず、結晶の成長も認められなかった。酸化還元状態を制御してCIA/ASF1-ブロモドメイン複合体の結晶の質を向上させることはできなかったが、無酸素条件下において蛋白質複合体の結晶化に成功された例もあるので、興味のある方は文献(9,10)を参照されたい。
文献
- Akai, Y. et al., Proc Natl Acad Sci U S A., 107, 8153-8 (2010)
- 高久誉大, 胡桃坂仁志, 蛋白質科学会アーカイブ, 1, e003 (2008)
- Daganzo, S. M., et al., Curr Biol., 13, 2148-58 (2003)
- Mousson, F., et al., Proc Natl Acad Sci U S A., 102, 5975-80 (2005)
- Padmanabhan, B., et al., J Biochem., 138, 821-9 (2005)
- http://www.ccp4.ac.uk/html/twinning.html#warning
- http://xray.bmc.uu.se/usf/dataman_man.html
- Kettenberger, H. & Cramer, P., Acta Crystallogr D Biol Crystallogr., 62, 146-50 (2006)
- Fu, J., et al., Cell, 98, 799-810 (1999)
- Senda, M., et al., J Mol Biol. 373, 382-400 (2007)