概要
蛋白質の結晶化が困難とされている理由の一つに結晶化時の蛋白質凝集が挙げられる。蛋白質が凝集することによって結晶が析出しにくくなるだけでなく、凝集した蛋白質は、結晶成長時における格子欠陥などを引き起こし、結晶のサイズや品質に悪影響を及ぼすと考えられる。近年、アルギニンなどのアミノ酸やアミノ酸エステル体などのアミノ酸誘導体が、蛋白質のリフォールディング反応時における蛋白質凝集や、熱による蛋白質凝集を抑制することが報告されている。そこで、結晶化時の過飽和溶液における蛋白質凝集や、結晶化に向けた蛋白質調製時における凝集を抑制するために、これらの添加剤の効果を検討してみた結果、非常に有効であることが分かってきた。結晶化サンプル(蛋白質溶液)に塩化ナトリウムやグリセロールを添加し蛋白質間の非特異的な凝集抑制などを軽減する方法が一般に広く利用されているが、筆者はアミノ酸やアミノ酸誘導体を添加剤として結晶化サンプルに加える新しい方法を紹介する。
装置・器具・試薬
装置
- 遠心機
- pHメーター
- 分光光度計
- 光学顕微鏡
- インキュベーター
器具
- 濃縮機
- 結晶化プレート
試薬
- 緩衝溶液(リン酸緩衝溶液など)
- アミノ酸(アルギニン、リジン、アスパラギン酸、グルタミン酸、プロリンなど)
- アミノ酸誘導体 [グリシンエチルエステル(25 g 2,800円 和光純薬(株))、グリシンアミド(25 g 10,500円 和光純薬(株))、プロリンアミド(1 g 10,000円 和光純薬(株))など]
- 初期スクリーニング(Crystal Screen 1など Hampton Research Corp.)
実験手順
第1日
1)濃縮時における効果の検討
蛋白質の結晶化には、通常高濃度(2~50 mg/mL程度)の蛋白質溶液を用いる。精製標品を濃縮する際に、非特異的な凝集、また蛋白質自身の溶解度が低いことにより蛋白質濃度が上がらない場合が多々見られる。このような際、アミノ酸やアミノ酸誘導体を添加することによって、その凝集を著しく軽減できる場合がある。筆者の経験で最も向上した例として、添加剤を加えてないものと比較して数倍、残存濃度を向上するといった例がある。
2)スパースマトリックス法を用いた蛋白質結晶化初期条件の検討(初期スクリーニング)
初期スクリーニングにおける問題として、成功率が低く効率の良いものとなっていないことが挙げられる。
蛋白質結晶を析出させるためには、過飽和度を極めて高くする必要がある。このような高過飽和溶液において、しばしば蛋白質の非特異的な凝集が引き起こり、望むような成果(結晶)を得ることができない。凝集を抑えるために、塩化ナトリウムのような無機塩、グリセロール、ポリエチレングリコールのようなポリマーを用いているが、必ずしも良い結果を得ていないのが現状である。しかし、アミノ酸やアミノ酸誘導体を添加することによりこのような凝集の生成を抑え、初期スクリーニングの成功率を向上させる可能性がある。
第2日以降
3)結晶化プレートの観察
実験の詳細
第1日
1)濃縮時における効果の検討
①アミノ酸、アミノ酸誘導体を添加した蛋白質溶液を調整する。 20 mM緩衝溶液に1 Mアミノ酸、アミノ酸誘導体を含む添加剤溶液を調整した後、添加剤の最終濃度が200 mMから500 mM位になるように蛋白質溶液と混ぜ濃縮を行う。
②セントリコンやアミコンなどを用いて濃縮する。
貴重なサンプルの浪費を避けるためにエッペンサイズの濃縮機:ミリポア社のウルトラフリーを用いて濃縮を行い、沈殿物やごみを取り除くために、濃縮したサンプルをマイクロチューブに入れ、15,000 x g、10 minの遠心で得られた上清、または0.22μmの遠心濾過フィルター(フィルターに蛋白質が吸着するおそれがあるので注意する)で濾過したサンプルの濃度を分光光度計(ナノドロップテクノロジー社のND-1000)で測定する。濃縮前と濃縮後のサンプルの相対値を算出することにより、残存濃度の高い条件を濃縮時に適した添加剤として決定する。筆者の経験上では、アルギニンとグリシンエチルエステルが濃縮時の蛋白質の凝集を抑制することが多かった。更なる凝集体の有無確認として、Native-PAGE、動的光散乱などが挙げられる。蛋白質の結晶化成功率を向上するためには、これらの手法を併用して考慮することも必要である。
2)1次スクリーニング
1)より得た蛋白質溶液を用いて、結晶化初期条件の検索を行う。結晶化溶液(リザーバー溶液)には、市販のスクリーニングキット溶液を用いる。当研究室では、結晶化溶液と1)より得た蛋白質溶液を等量混ぜ合わせ、ハンギングドロップ、シッティングドロップ蒸気拡散法により結晶化条件の検討を行っている。こちらの方も、アルギニンやグリシンエチルエステルを添加すると結晶化率が高まった。
3)2次スクリーニング
2)より得た結果を基に結晶化条件の精密化を行う必要がある。この際の問題点として、一度決定した条件において蛋白質結晶が再現性よく析出しない、と言ったことが挙げられる。このような際にも、アミノ酸やアミノ酸誘導体を加えた方が結晶化の再現性を上げることが多かった。
工夫とコツ
添加剤溶液の調製
溶液を調整する際には、pH調整を注意してもらいたい。例えば、グリシンエチルエステルなどは塩酸塩として市販されているので、緩衝溶液に加えるだけで、pHが酸性にシフトする。
アスパラギン酸やグルタミン酸は溶解度が低いのでナトリウム塩で購入することを勧める。
添加剤の選択
学会等で、どのアミノ酸やアミノ酸誘導体が効果的なのか質問を受ける。リゾチームにおいては、プロリンアミドやリシンエチルエステルを添加すると成功率が上がることが分かっているが、試薬が高いという欠点がある。また、個人的には、すべてのアミノ酸を試していただきたいのであるが、限定すると、酸性アミノ酸:アスパラギン酸、グルタンミン酸、塩基性アミノ酸:リジン、アルギニン、アミノ酸誘導体:グリシンエチルエステル、グリシンアミドの6種類をお勧めする。
添加剤の濃度
添加剤の濃度であるが、細胞内蛋白質、細胞外蛋白質、核内蛋白質、膜蛋白質をモデルに調べたところ、蛋白質溶液に0.2 Mから0.5 M添加を添加すると結晶化の可能性が高まった。
その他の戦略
最近の研究結果より、アミノ酸と数パーセント(0.5から2%)のポリエチレングリコールを混ぜた蛋白質溶液を用いた際、アミノ酸やアミノ酸誘導体を単独で用いるより、初期スクリーニングの成功率を著しく向上させた。特に、ポリエチレングリコールでも重合の高いもの(平均分子量2,000以上のもの)が良いようである。また、数種類のアミノ酸同士やアミノ酸誘導体との混合も結晶化の効率を高めることが分かっている(筆者はショットガンメソッドと呼んでいる)。
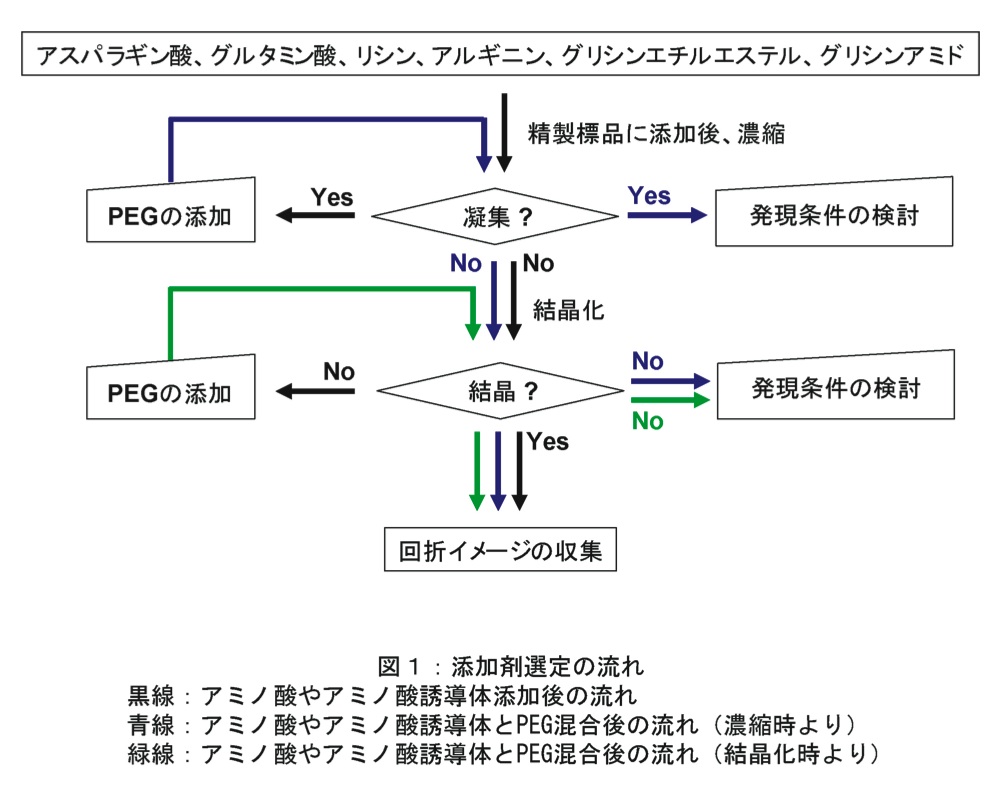
添加剤選定までの流れ
実験のフローチャートを図1に示した。筆者は初めて精製した試料を結晶化する場合、まず6種類のアミノ酸やアミノ酸誘導体を精製標品に添加後、濃縮を行う。濃度測定、Native-PAGE、動的光散乱の結果から最も適した添加剤を決定する。良い結果を得られない場合は、0.5%から2%のポリエチレングリコール(筆者は、まず平均分子量8,000を用いる)を添加し再検討を行い、最も適した添加剤を決定する。良い条件が見つからない際は、蛋白質の性質が悪いと考えられるので、蛋白質の発現条件などを検討する。
結晶化条件の検索では、まず濃縮時に検討したサンプルを用いて結晶化条件の検索を行う。必要であればポリエチレングリコールを添加し、結晶化条件の再検索を行う。この際、最も適した添加剤の決定は、結晶の有無で判断する。良好な結果を得られない際は、蛋白質の発現条件、必要であればコンストラクトの検討を行う。
文献
- Ito, L. et al., J. Synchrotron Rad., 15, 316-318 (2008)
- 白木 賢太郎, 伊藤 廉, 山口 宏, Bioindustry, 5, 38-45, シーエムシー出版 (2008)
- Ito, L. et al., Acta Cryst., F64, 531-532 (2008)
概要
蛋白質の結晶化が困難とされている理由の一つに結晶化時の蛋白質凝集が挙げられる。蛋白質が凝集することによって結晶が析出しにくくなるだけでなく、凝集した蛋白質は、結晶成長時における格子欠陥などを引き起こし、結晶のサイズや品質に悪影響を及ぼすと考えられる。近年、アルギニンなどのアミノ酸やアミノ酸エステル体などのアミノ酸誘導体が、蛋白質のリフォールディング反応時における蛋白質凝集や、熱による蛋白質凝集を抑制することが報告されている。そこで、結晶化時の過飽和溶液における蛋白質凝集や、結晶化に向けた蛋白質調製時における凝集を抑制するために、これらの添加剤の効果を検討してみた結果、非常に有効であることが分かってきた。結晶化サンプル(蛋白質溶液)に塩化ナトリウムやグリセロールを添加し蛋白質間の非特異的な凝集抑制などを軽減する方法が一般に広く利用されているが、筆者はアミノ酸やアミノ酸誘導体を添加剤として結晶化サンプルに加える新しい方法を紹介する。
装置・器具・試薬
装置
- 遠心機
- pHメーター
- 分光光度計
- 光学顕微鏡
- インキュベーター
器具
- 濃縮機
- 結晶化プレート
試薬
- 緩衝溶液(リン酸緩衝溶液など)
- アミノ酸(アルギニン、リジン、アスパラギン酸、グルタミン酸、プロリンなど)
- アミノ酸誘導体 [グリシンエチルエステル(25 g 2,800円 和光純薬(株))、グリシンアミド(25 g 10,500円 和光純薬(株))、プロリンアミド(1 g 10,000円 和光純薬(株))など]
- 初期スクリーニング(Crystal Screen 1など Hampton Research Corp.)
実験手順
第1日
1)濃縮時における効果の検討
蛋白質の結晶化には、通常高濃度(2~50 mg/mL程度)の蛋白質溶液を用いる。精製標品を濃縮する際に、非特異的な凝集、また蛋白質自身の溶解度が低いことにより蛋白質濃度が上がらない場合が多々見られる。このような際、アミノ酸やアミノ酸誘導体を添加することによって、その凝集を著しく軽減できる場合がある。筆者の経験で最も向上した例として、添加剤を加えてないものと比較して数倍、残存濃度を向上するといった例がある。
2)スパースマトリックス法を用いた蛋白質結晶化初期条件の検討(初期スクリーニング)
初期スクリーニングにおける問題として、成功率が低く効率の良いものとなっていないことが挙げられる。
蛋白質結晶を析出させるためには、過飽和度を極めて高くする必要がある。このような高過飽和溶液において、しばしば蛋白質の非特異的な凝集が引き起こり、望むような成果(結晶)を得ることができない。凝集を抑えるために、塩化ナトリウムのような無機塩、グリセロール、ポリエチレングリコールのようなポリマーを用いているが、必ずしも良い結果を得ていないのが現状である。しかし、アミノ酸やアミノ酸誘導体を添加することによりこのような凝集の生成を抑え、初期スクリーニングの成功率を向上させる可能性がある。
第2日以降
3)結晶化プレートの観察
実験の詳細
第1日
1)濃縮時における効果の検討
①アミノ酸、アミノ酸誘導体を添加した蛋白質溶液を調整する。 20 mM緩衝溶液に1 Mアミノ酸、アミノ酸誘導体を含む添加剤溶液を調整した後、添加剤の最終濃度が200 mMから500 mM位になるように蛋白質溶液と混ぜ濃縮を行う。
②セントリコンやアミコンなどを用いて濃縮する。
貴重なサンプルの浪費を避けるためにエッペンサイズの濃縮機:ミリポア社のウルトラフリーを用いて濃縮を行い、沈殿物やごみを取り除くために、濃縮したサンプルをマイクロチューブに入れ、15,000 x g、10 minの遠心で得られた上清、または0.22μmの遠心濾過フィルター(フィルターに蛋白質が吸着するおそれがあるので注意する)で濾過したサンプルの濃度を分光光度計(ナノドロップテクノロジー社のND-1000)で測定する。濃縮前と濃縮後のサンプルの相対値を算出することにより、残存濃度の高い条件を濃縮時に適した添加剤として決定する。筆者の経験上では、アルギニンとグリシンエチルエステルが濃縮時の蛋白質の凝集を抑制することが多かった。更なる凝集体の有無確認として、Native-PAGE、動的光散乱などが挙げられる。蛋白質の結晶化成功率を向上するためには、これらの手法を併用して考慮することも必要である。
2)1次スクリーニング
1)より得た蛋白質溶液を用いて、結晶化初期条件の検索を行う。結晶化溶液(リザーバー溶液)には、市販のスクリーニングキット溶液を用いる。当研究室では、結晶化溶液と1)より得た蛋白質溶液を等量混ぜ合わせ、ハンギングドロップ、シッティングドロップ蒸気拡散法により結晶化条件の検討を行っている。こちらの方も、アルギニンやグリシンエチルエステルを添加すると結晶化率が高まった。
3)2次スクリーニング
2)より得た結果を基に結晶化条件の精密化を行う必要がある。この際の問題点として、一度決定した条件において蛋白質結晶が再現性よく析出しない、と言ったことが挙げられる。このような際にも、アミノ酸やアミノ酸誘導体を加えた方が結晶化の再現性を上げることが多かった。
工夫とコツ
添加剤溶液の調製
溶液を調整する際には、pH調整を注意してもらいたい。例えば、グリシンエチルエステルなどは塩酸塩として市販されているので、緩衝溶液に加えるだけで、pHが酸性にシフトする。
アスパラギン酸やグルタミン酸は溶解度が低いのでナトリウム塩で購入することを勧める。
添加剤の選択
学会等で、どのアミノ酸やアミノ酸誘導体が効果的なのか質問を受ける。リゾチームにおいては、プロリンアミドやリシンエチルエステルを添加すると成功率が上がることが分かっているが、試薬が高いという欠点がある。また、個人的には、すべてのアミノ酸を試していただきたいのであるが、限定すると、酸性アミノ酸:アスパラギン酸、グルタンミン酸、塩基性アミノ酸:リジン、アルギニン、アミノ酸誘導体:グリシンエチルエステル、グリシンアミドの6種類をお勧めする。
添加剤の濃度
添加剤の濃度であるが、細胞内蛋白質、細胞外蛋白質、核内蛋白質、膜蛋白質をモデルに調べたところ、蛋白質溶液に0.2 Mから0.5 M添加を添加すると結晶化の可能性が高まった。
その他の戦略
最近の研究結果より、アミノ酸と数パーセント(0.5から2%)のポリエチレングリコールを混ぜた蛋白質溶液を用いた際、アミノ酸やアミノ酸誘導体を単独で用いるより、初期スクリーニングの成功率を著しく向上させた。特に、ポリエチレングリコールでも重合の高いもの(平均分子量2,000以上のもの)が良いようである。また、数種類のアミノ酸同士やアミノ酸誘導体との混合も結晶化の効率を高めることが分かっている(筆者はショットガンメソッドと呼んでいる)。
添加剤選定までの流れ
実験のフローチャートを図1に示した。筆者は初めて精製した試料を結晶化する場合、まず6種類のアミノ酸やアミノ酸誘導体を精製標品に添加後、濃縮を行う。濃度測定、Native-PAGE、動的光散乱の結果から最も適した添加剤を決定する。良い結果を得られない場合は、0.5%から2%のポリエチレングリコール(筆者は、まず平均分子量8,000を用いる)を添加し再検討を行い、最も適した添加剤を決定する。良い条件が見つからない際は、蛋白質の性質が悪いと考えられるので、蛋白質の発現条件などを検討する。
結晶化条件の検索では、まず濃縮時に検討したサンプルを用いて結晶化条件の検索を行う。必要であればポリエチレングリコールを添加し、結晶化条件の再検索を行う。この際、最も適した添加剤の決定は、結晶の有無で判断する。良好な結果を得られない際は、蛋白質の発現条件、必要であればコンストラクトの検討を行う。
文献
- Ito, L. et al., J. Synchrotron Rad., 15, 316-318 (2008)
- 白木 賢太郎, 伊藤 廉, 山口 宏, Bioindustry, 5, 38-45, シーエムシー出版 (2008)
- Ito, L. et al., Acta Cryst., F64, 531-532 (2008)