概要
放射光 X 線の高輝度化により、タンパク質結晶の X 線回折データを収集する際の結晶の冷却は必須である。実際、PDB 登録された結晶構造の90%以上が低温条件下で測定されている (1)。現在は 100 K の窒素ガスを用いて結晶を冷却する方法が主流であるが、液体ヘリウムを利用して結晶を冷却する方法も開発されている (2)。
タンパク質結晶をそのまま 100 K の窒素気流の中に置くと、結晶の周りの水あるいは結晶中に含まれる水が凍結し氷ができてしまう。脆弱なタンパク質結晶の周りや内部で氷が生成、成長すれば、タンパク質結晶が破壊される可能性がある。また、氷を含むタンパク質結晶に X 線を当てると、タンパク質の結晶に由来する回折像と氷の結晶に由来する回折像が重なり、X 線回折データを処理することが困難な場合が多い。そのため、抗凍結剤を含む溶液に結晶を浸してから瞬間冷却を行うことが多い。
このプロトコルでは、一般的な 100 K の窒素ガス気流下で X 線回折データを収集するための、タンパク質結晶のクライオ条件の検討について解説する。クライオ条件の検討は、研究者が色々工夫している点が多い。それら全てを紹介することはできないため、当研究室でこれまでに行ってきたプロトコルについて紹介したい。
装置・器具・試薬
装置
X 線発生装置、検出器、吹きつけ低温装置(無い場合は放射光ビームラインを使用)実体顕微鏡(結晶観察用。50倍程度の倍率があると良い)
器具
当研究室では、Crystal Positioning Systems 社、Molecular Dimensions 社、Hampton Research 社などのクライオ器具を使用している(図1)。近年の放射光ビームラインでは、結晶交換ロボットを使用したデータ収集が主流となっているため、使用するビームラインに合わせた器具を準備し、結晶を凍結・保存する必要がある。本稿では、低温窒素ガスまたは液体窒素を用いた結晶の凍結と、凍結した結晶を Uni-Puck に回収し、液体窒素中で保管する方法について紹介する。
- サンプルピン
(キャップ(台座)部分とループ部分で構成される。台座にループを装着したものをここではサンプルピンと呼ぶことにする。接着剤でループを固定して使用する台座もあるが、接着剤不要でループを固定することができる再利用可能な台座の方が使い勝手が良い。台座とループは単品で購入可能だが、アセンブリされたものも販売されている(Hampton Research 社、MiTeGen 社)。Photon Factory(PF, 茨城県つくば市)では、台座部分は MiTeGen 社の Goniometer Bases、Hampton Research 社の CrystalCap、またはその互換品が推奨され、ループの根元までの高さが 22 mm のサンプルピンを使用する。SPring-8(兵庫県佐用郡)では、金属製キャップと、Hampton Research 社で 18 mm として販売されているループを組み合わせたサンプルピンを使用する)。 - ワンド(Hampton Research 社:HR4-729)
- トング
- 発泡スチロール(本稿では純正品を使用しているが、専用のものでなくても可)
- Uni-Puck
- シッピングケーン
- Uni-Puck 用ワンド
- クライオトング
(発泡スチロール、Uni-Puck、シッピングケーン、Uni-Puck 用ワンド、クライオトング は、Crystal Positioning Systems 社のUniversal Puck Kit #1(CP-111-021K-1)に 含まれる)
- ドライシッパー(結晶運搬用)
- デュワー瓶
- ピンセット
- スライドガラス
- マイクロピペット、チップ
- 冷気を遮断するためのカード
(名刺サイズのカード、アルミ箔などで自作しても良い。図3を参照)
試薬
- グリセロール、エチレングリコール、低分子量PEG、アルコール類、糖類などの抗凍結剤
(Hampton Research 社から抗凍結剤のキットCryoPro™ が販売されているので、それを利用しても良い) - 結晶化に用いた試薬
- 液体窒素
実験手順
- 抗凍結剤の選択
- 結晶の抗凍結処理
- 結晶の凍結
- 回折像の確認
実験の詳細
1. 抗凍結剤の選択
低温吹き付け装置があれば、結晶化に用いた溶液(リザーバー溶液)をループですくい、100 K の窒素ガス気流の中ですばやく冷却し、透明に凍るか白く凍るかを確認する。透明に凍るとは、溶媒が非晶質(アモルファス)状で、透明なガラス状氷の中に結晶が見える状態である。もし結晶化溶液が透明に凍るのであれば、結晶を抗凍結処理する必要は無いことが多い。白く凍る場合は水の結晶が生成しているため、抗凍結処理を行う必要がある。
当研究室ではグリセロールやエチレングリコールを主に使用している。まず、20–30%のグリセロールまたはエチレングリコールを含む結晶化溶液を調製し、結晶をループですくい窒素ガスまたは液体窒素で冷却する。窒素ガスで冷却する場合、可能であれば、その時点で透明に凍ることを確認する(液体窒素で冷却した場合はその場での確認が困難である)。白く凍る場合は、エチレングリコールまたはグリセロールの濃度を上げるか、他の抗凍結剤を試す。沈殿剤に PEG、MPD、塩を使用している場合は、沈殿剤濃度を上げると沈殿剤が抗凍結剤となる場合がある。鉱物油も抗凍結剤として利用されている(補足1)。
2. 結晶の抗凍結処理
抗凍結剤を加えた結晶化溶液が透明に凍ることを確認することができたら、結晶をその溶液に浸し、抗凍結処理を行う。このプロトコルでは、この溶液をプロテクタント溶液と呼ぶことにする。
スライドガラスに1–2 マイクロリットルのプロテクタント溶液のドロップを作り、サンプルピンを用いて、結晶化溶液からプロテクタント溶液に結晶を移す(図2)。顕微鏡下で結晶を移すため、スライドガラスに作るドロップの体積を結晶化ドロップと同量程度にすると、顕微鏡のピントを変える煩雑な操作の必要が無くなる。結晶化ドロップからプロテクタント溶液に結晶を移したときに、結晶が割れる、あるいは結晶が溶けるようであれば、プロテクタント溶液の組成やソーキング条件を検討する必要があるかもしれない(補足2、補足3)。プロテクタントに浸した結晶を数秒間観察し、結晶の状態に変化が無いようであれば、結晶の凍結に進む。
3. 結晶の凍結
結晶の凍結には、主に、X 線装置に取り付けられている吹き付け低温装置を用いて凍結させる方法と、液体窒素中で凍結させる方法がある。どちらの方法で凍結させるとしても、結晶の大きさに応じて適切な大きさのループを使用する必要がある。ナイロン製であれば、結晶より少し大きいループを使用するのが良い。一方、ポリイミド製(MiTeGen 社:LithoLoops)であれば、結晶よりやや小さいループの使用が推奨されている。これは、ループに持ち込むプロテクタント溶液が少なく、結晶を素早く凍結させることができ、氷の生成を抑えられるためである。
3-1. 吹き付け低温装置を用いて凍結させる方法(図3)
100 K の窒素ガスを用いることが多い。抗凍結処理した結晶をループですくい、吹き付け低温装置のノズルをカードでふさぎ冷気を遮断する。サンプルピンをマウント後、カードを素早くノズルから離し、結晶を瞬間的に凍結させる。ここで結晶あるいはループ中の溶媒が白くなってしまう場合は、抗凍結処理の時間を長めにする、抗凍結剤の濃度を上げる、抗凍結剤の種類を変更するなどの検討が必要になる。
ループ内が凍結時に多少白くなっても、データ収集には大きな問題にならない場合もあるため、X 線回折像を1–2枚撮影し、凍結の良否を判断するのが良い。凍結がうまくできた結晶は、そのままデータ収集するか、放射光実験に向けて回収する(図4、図5)。
3-2. 液体窒素で凍結させる方法
当研究室では、放射光ビームラインの結晶交換ロボットを使用した測定に備え、凍結させた結晶を Uni-Puck に格納し、ドライシッパーで保存している。ここでは、液体窒素で凍結させた結晶を Uni-Puck で保管する方法を紹介したい(図5)。
まず、発泡スチロールに Uni-Puck を入れ、液体窒素で十分に冷却しておく。次に、抗凍結処理した結晶をサンプルピンですくい、ワンドを取り付けて液体窒素中に素早く入れる。この時、急激に気化した窒素ガスによる大量の泡が、結晶にダメージを与える可能性があるが、結晶を液体窒素に入れるだけの簡便な操作で凍結することができる。一旦液体窒素に入れた結晶は、空気中には絶対に出さないように注意する(表面に霜ができてしまうため)。液体窒素の中で結晶を移動させ、Uni-Puck のポートに順番に入れる。Uni-Puck には、1番ポートから16番ポートまであり、結晶を最大16個収納することができる。使用する放射光ビームラインによっては、Uni-Puck 識別のためのバーコードピンを所定の位置に入れる必要がある。
結晶の回収が完了したら、Uni-Puck 用ワンドを使用して液体窒素中で Uni-Puck に蓋をする。蓋をした Uni-Puck は、クライオトングを用いてシッピングケーンに移し、液体窒素を入れたドライシッパーで保存する。すぐに測定しない場合は、1週間に1回程度、液体窒素を補充しておく。
4. 回折像の確認
抗凍結処理がうまくできているかどうかは、X 線回折像で確認することができる(図6)。アイスリングと呼ばれる同心円状の回折が現れた場合、基本的にはクライオ条件の検討が必要であるが、アニーリング操作で改善することがある(補足4)。図6A のように、回折点の形状が悪くぼんやりしている場合は、プロテクタント溶液の組成やソーキング時間を検討する必要がある(補足5、補足6)。回折像に問題がないようであれば、そのままデータ収集を行う。最近は、放射光ビームラインの技術革新により、データ収集にかかる時間が極めて短く、データ収集をするかどうかを考える時間が律速段階になりうる。そのため、抗凍結剤の種類や濃度を変えた結晶を数多く用意し、X 線回折像で結晶の良し悪しを確認することなく、データ収集を行うこともある。
もし、低エネルギー X 線を利用したデータ収集を行うのであれば、特別なループを使用することが必要になる(補足7)。
工夫とコツ
補足1
グリセロールやエチレングリコールの他に、結晶化の沈殿剤として用いられている MPD や PEG、高濃度の塩、スクロースやトレハロースなどの糖もクライオプロテクタントとして用いられる。
例えば、分子量5,000以下の PEG や MPD を沈殿剤として使用している結晶化条件であれば、PEG や MPD の濃度を上げることでクライオプロテクタントになりうる。濃度を上げてもクライオプロテクタントとして使用できない場合、または分子量5,000以上の PEG を含む結晶化条件であれば、PEG400 などの低分子量 PEG を加えることで、クライオプロテクタントとして使用できる場合がある。
一方、結晶を鉱物油で覆うことで、結晶表面の氷の生成を抑えることができる。Hampton Research 社の Parabar 10312(Paratone)や、MiTeGen 社の LV CryoOil などの汎用クライオプロテクタントも販売されている。
補足2
プロテクタント溶液へのソーキングによって結晶が壊れてしまう場合、ソーキング時間を短くすることで改善されることがある。もし結晶が割れてしまっても結晶の破片が十分きれいであれば、それを使ってデータ収集することも可能である。
結晶が激しく壊れてしまう場合は、抗凍結剤の濃度を段階的に上げていく方法もある。抗凍結条件の検討は結晶構造解析の重要なステップであり、市販のキットの条件を一通り試してみるのが良いだろう。
補足3
結晶を得た母液とプロテクタント溶液の条件が異なることは、結晶が溶解したり劣化したりする原因となりうる。結晶の溶解や劣化を回避するため、プロテクタント溶液の pH 等は、可能な限り結晶の母液に合わせておくのが良い (3)。
補足4
アニーリングには,ゴニオメーターヘッド上で窒素ガスの気流を遮り融解させ、再度窒素ガスで凍結させる方法と、凍結した結晶をプロテクタント溶液に戻して再度ループですくい窒素ガスで凍結させる方法があり、良好な回折像が得られる場合がある。放射光ビームラインによっては、前者の方法をボタン一つで試すことができる。アニーリングは全ての結晶に適用できるわけではないが、X 線回折像を1–2枚撮影し、結晶の回折能やスポットの形状が悪い場合は,結晶を破棄する前に試してみても良いだろう。
補足5
結晶がガラス状に凍結されているが、回折しない、あるいはきれいな回折点が得られないことがよくある。このような場合、結晶がそもそも悪いか、クライオ条件が悪いか、どちらかである。実験室系での実験であれば、室温での回折像を撮影することで結晶自体の良否を判断することができる。
補足6
結晶自体に問題がある場合でも、抗凍結処理によって改善される場合がある。例えば,抗凍結処理した結晶を、さらに別の抗凍結剤を用いて抗凍結処理することにより分解能が向上した例が報告されている (3)。結晶化条件の改良に難航したとしても、結晶の数が十分にあるようであれば、このようなマルチステップの抗凍結処理を試してみるのも良いかもしれない。
一般的なクライオ条件の検討のフローチャートを図7に示す。
補足7
低エネルギー X 線(長波長 X 線)を用いて測定する場合はループや溶媒からの散乱を無視できない。1.8 Å よりも長い波長の X 線を用いるのであれば、ナイロン製のループではなく、ポリイミドのような散乱の少ない材質でできたループ(LithoLoop)を使用するのが良い。ポリイミドはナイロンと比べて疎水性が低いため、結晶周囲の溶媒量が少なくなり、溶媒からのバックグラウンドも低減することができる。
MiTeGen 社は、ループからの散乱が少なく、余分な溶媒を容易に取り除くことができる MicroMount™ を販売している。例えば、Dual Thickness MicroLoop(MiTeGen 社)は、結晶マウント部分の近くに排出溝があり、余分な溶媒を容易に取り除くことができる。さらに、網状の MicroMesh Loop(MiTeGen 社)を用いて、抗凍結処理をしていない結晶の周囲の溶媒を完全に除去してデータ収集した例も報告されている (4)。
文献
- Hass, DJ., IUCrJ., 7, 148–157 (2020)
- Nakasako, M. et al., Rev. Sci. Instrum., 73, 1318–1320 (2002)
- Senda, M.et al., Crystal Growth & Design, 16, 1565–1571 (2016)
- Pellegrini, E. et al., Acta Crystallogr. D Biol. Crystallogr., 67, 902–906 (2011)
[クライオ実験全般についての文献]
- タンパク質の結晶化、京都大学学術出版会 (2005)
- Macromolecular Crystallography Protocols: vol. 2, Humana Press (2007)
- Pflugrath, JW., Acta Crystallogr. F Struct. Biol. Commun., 71, 622–642 (2015)
謝辞
当プロトコルの作成に際し、当研究室の学生である岡﨑菫氏の協力を得た。
-

図1:(A)ループ(左)と台座(右)。(B)サンプルピン(台座とループを組み立てたもの)。台座の一番下からループの付け根(矢印で表示した部分)まで 22 mm のものを使用している。(C)ワンド。先端(写真の上側)がマグネットになっており、ループの台座部分を取り付けて使用する。(D)Uni-Puck 本体(左)と蓋(右)。内側に5個(1番~5番)。外側に11個(6番~16番)の計16個のポートがあり、反時計回りにナンバリングしてある。(E)蓋をした状態の Uni-Puck(F)シッピングケーン。蓋をした Uni-Puck を最大7個収納することができる。(G)Uni-Puck 用ワンド(左)とクライオトング(右)。Uni-Puck 用ワンドは、液体窒素中で Uni-Puck に蓋をする時に使用する。 -

図2:ループで結晶をすくう -

図3:結晶のマウント -

図4:低温吹き付け装置からの結晶の回収(A)液体窒素で十分に冷やしたトングで結晶をゴニオメーターヘッドから回収する。(B)回収した結晶をトングごと液体窒素に入れ、Uni-Puck の入っている発泡スチロールに移す。液体窒素中でワンドを使ってサンプルピンをトングから外す(図5C に続く) -

図5:結晶の凍結と保管(A)発泡スチロールに Uni-Puck を入れ、液体窒素で十分に冷却する(B)結晶をすくったサンプルピンをワンドに取り付ける(C)サンプルピンを液体窒素に素早く入れて結晶を凍結させる(D)1番ポートから順番にサンプルピンを入れる(E)1番ポートと2番ポート(内側の2箇所)にサンプルピンを入れた状態(F)Uni-Puck の蓋を Uni-Puck 用ワンドに取り付けてから液体窒素中で冷却し、Uni-Puck に蓋をする(G)クライオトングで蓋をした Uni-Puck をつかむ(H)シッピングケーンに Uni-Puck を格納し、液体窒素の中で保存する -
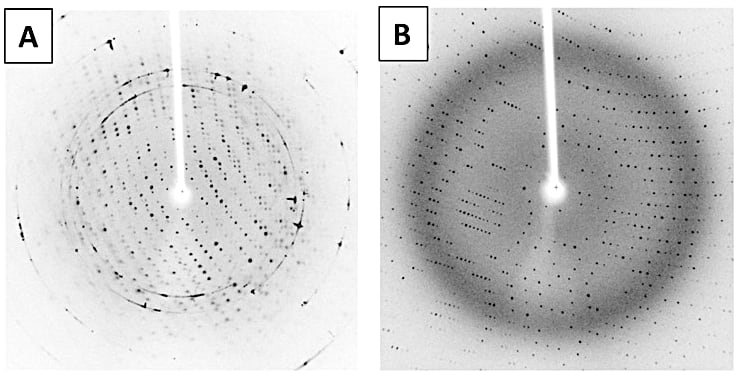
図6:回折像の確認(A)クライオ条件が適切でないため、アイスリングが現れている。また、回折点もぼんやりとしている。クライオ条件の検討が必要である。(B)クライオ条件が適切で、アイスリングは現れていない。ぼんやりとした円が見えるが、これは溶媒からの散乱であり、正常である。また、回折点がはっきりしており、良好なデータが得られると期待できる。 -
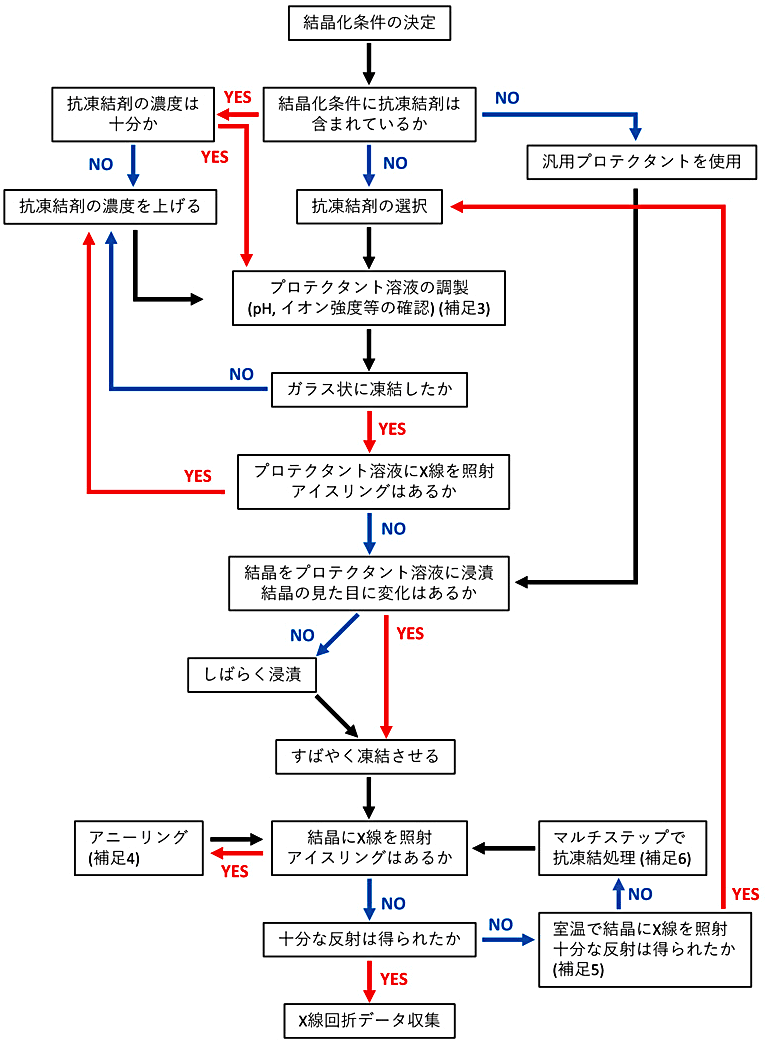
図7:結晶凍結のフローチャート
概要
放射光 X 線の高輝度化により、タンパク質結晶の X 線回折データを収集する際の結晶の冷却は必須である。実際、PDB 登録された結晶構造の90%以上が低温条件下で測定されている (1)。現在は 100 K の窒素ガスを用いて結晶を冷却する方法が主流であるが、液体ヘリウムを利用して結晶を冷却する方法も開発されている (2)。
タンパク質結晶をそのまま 100 K の窒素気流の中に置くと、結晶の周りの水あるいは結晶中に含まれる水が凍結し氷ができてしまう。脆弱なタンパク質結晶の周りや内部で氷が生成、成長すれば、タンパク質結晶が破壊される可能性がある。また、氷を含むタンパク質結晶に X 線を当てると、タンパク質の結晶に由来する回折像と氷の結晶に由来する回折像が重なり、X 線回折データを処理することが困難な場合が多い。そのため、抗凍結剤を含む溶液に結晶を浸してから瞬間冷却を行うことが多い。
このプロトコルでは、一般的な 100 K の窒素ガス気流下で X 線回折データを収集するための、タンパク質結晶のクライオ条件の検討について解説する。クライオ条件の検討は、研究者が色々工夫している点が多い。それら全てを紹介することはできないため、当研究室でこれまでに行ってきたプロトコルについて紹介したい。
装置・器具・試薬
装置
X 線発生装置、検出器、吹きつけ低温装置(無い場合は放射光ビームラインを使用)実体顕微鏡(結晶観察用。50倍程度の倍率があると良い)
器具
当研究室では、Crystal Positioning Systems 社、Molecular Dimensions 社、Hampton Research 社などのクライオ器具を使用している(図1)。近年の放射光ビームラインでは、結晶交換ロボットを使用したデータ収集が主流となっているため、使用するビームラインに合わせた器具を準備し、結晶を凍結・保存する必要がある。本稿では、低温窒素ガスまたは液体窒素を用いた結晶の凍結と、凍結した結晶を Uni-Puck に回収し、液体窒素中で保管する方法について紹介する。
- サンプルピン
(キャップ(台座)部分とループ部分で構成される。台座にループを装着したものをここではサンプルピンと呼ぶことにする。接着剤でループを固定して使用する台座もあるが、接着剤不要でループを固定することができる再利用可能な台座の方が使い勝手が良い。台座とループは単品で購入可能だが、アセンブリされたものも販売されている(Hampton Research 社、MiTeGen 社)。Photon Factory(PF, 茨城県つくば市)では、台座部分は MiTeGen 社の Goniometer Bases、Hampton Research 社の CrystalCap、またはその互換品が推奨され、ループの根元までの高さが 22 mm のサンプルピンを使用する。SPring-8(兵庫県佐用郡)では、金属製キャップと、Hampton Research 社で 18 mm として販売されているループを組み合わせたサンプルピンを使用する)。 - ワンド(Hampton Research 社:HR4-729)
- トング
- 発泡スチロール(本稿では純正品を使用しているが、専用のものでなくても可)
- Uni-Puck
- シッピングケーン
- Uni-Puck 用ワンド
- クライオトング
(発泡スチロール、Uni-Puck、シッピングケーン、Uni-Puck 用ワンド、クライオトング は、Crystal Positioning Systems 社のUniversal Puck Kit #1(CP-111-021K-1)に 含まれる)
- ドライシッパー(結晶運搬用)
- デュワー瓶
- ピンセット
- スライドガラス
- マイクロピペット、チップ
- 冷気を遮断するためのカード
(名刺サイズのカード、アルミ箔などで自作しても良い。図3を参照)
試薬
- グリセロール、エチレングリコール、低分子量PEG、アルコール類、糖類などの抗凍結剤
(Hampton Research 社から抗凍結剤のキットCryoPro™ が販売されているので、それを利用しても良い) - 結晶化に用いた試薬
- 液体窒素
実験手順
- 抗凍結剤の選択
- 結晶の抗凍結処理
- 結晶の凍結
- 回折像の確認
実験の詳細
1. 抗凍結剤の選択
低温吹き付け装置があれば、結晶化に用いた溶液(リザーバー溶液)をループですくい、100 K の窒素ガス気流の中ですばやく冷却し、透明に凍るか白く凍るかを確認する。透明に凍るとは、溶媒が非晶質(アモルファス)状で、透明なガラス状氷の中に結晶が見える状態である。もし結晶化溶液が透明に凍るのであれば、結晶を抗凍結処理する必要は無いことが多い。白く凍る場合は水の結晶が生成しているため、抗凍結処理を行う必要がある。
当研究室ではグリセロールやエチレングリコールを主に使用している。まず、20–30%のグリセロールまたはエチレングリコールを含む結晶化溶液を調製し、結晶をループですくい窒素ガスまたは液体窒素で冷却する。窒素ガスで冷却する場合、可能であれば、その時点で透明に凍ることを確認する(液体窒素で冷却した場合はその場での確認が困難である)。白く凍る場合は、エチレングリコールまたはグリセロールの濃度を上げるか、他の抗凍結剤を試す。沈殿剤に PEG、MPD、塩を使用している場合は、沈殿剤濃度を上げると沈殿剤が抗凍結剤となる場合がある。鉱物油も抗凍結剤として利用されている(補足1)。
2. 結晶の抗凍結処理
抗凍結剤を加えた結晶化溶液が透明に凍ることを確認することができたら、結晶をその溶液に浸し、抗凍結処理を行う。このプロトコルでは、この溶液をプロテクタント溶液と呼ぶことにする。
スライドガラスに1–2 マイクロリットルのプロテクタント溶液のドロップを作り、サンプルピンを用いて、結晶化溶液からプロテクタント溶液に結晶を移す(図2)。顕微鏡下で結晶を移すため、スライドガラスに作るドロップの体積を結晶化ドロップと同量程度にすると、顕微鏡のピントを変える煩雑な操作の必要が無くなる。結晶化ドロップからプロテクタント溶液に結晶を移したときに、結晶が割れる、あるいは結晶が溶けるようであれば、プロテクタント溶液の組成やソーキング条件を検討する必要があるかもしれない(補足2、補足3)。プロテクタントに浸した結晶を数秒間観察し、結晶の状態に変化が無いようであれば、結晶の凍結に進む。
3. 結晶の凍結
結晶の凍結には、主に、X 線装置に取り付けられている吹き付け低温装置を用いて凍結させる方法と、液体窒素中で凍結させる方法がある。どちらの方法で凍結させるとしても、結晶の大きさに応じて適切な大きさのループを使用する必要がある。ナイロン製であれば、結晶より少し大きいループを使用するのが良い。一方、ポリイミド製(MiTeGen 社:LithoLoops)であれば、結晶よりやや小さいループの使用が推奨されている。これは、ループに持ち込むプロテクタント溶液が少なく、結晶を素早く凍結させることができ、氷の生成を抑えられるためである。
3-1. 吹き付け低温装置を用いて凍結させる方法(図3)
100 K の窒素ガスを用いることが多い。抗凍結処理した結晶をループですくい、吹き付け低温装置のノズルをカードでふさぎ冷気を遮断する。サンプルピンをマウント後、カードを素早くノズルから離し、結晶を瞬間的に凍結させる。ここで結晶あるいはループ中の溶媒が白くなってしまう場合は、抗凍結処理の時間を長めにする、抗凍結剤の濃度を上げる、抗凍結剤の種類を変更するなどの検討が必要になる。
ループ内が凍結時に多少白くなっても、データ収集には大きな問題にならない場合もあるため、X 線回折像を1–2枚撮影し、凍結の良否を判断するのが良い。凍結がうまくできた結晶は、そのままデータ収集するか、放射光実験に向けて回収する(図4、図5)。
3-2. 液体窒素で凍結させる方法
当研究室では、放射光ビームラインの結晶交換ロボットを使用した測定に備え、凍結させた結晶を Uni-Puck に格納し、ドライシッパーで保存している。ここでは、液体窒素で凍結させた結晶を Uni-Puck で保管する方法を紹介したい(図5)。
まず、発泡スチロールに Uni-Puck を入れ、液体窒素で十分に冷却しておく。次に、抗凍結処理した結晶をサンプルピンですくい、ワンドを取り付けて液体窒素中に素早く入れる。この時、急激に気化した窒素ガスによる大量の泡が、結晶にダメージを与える可能性があるが、結晶を液体窒素に入れるだけの簡便な操作で凍結することができる。一旦液体窒素に入れた結晶は、空気中には絶対に出さないように注意する(表面に霜ができてしまうため)。液体窒素の中で結晶を移動させ、Uni-Puck のポートに順番に入れる。Uni-Puck には、1番ポートから16番ポートまであり、結晶を最大16個収納することができる。使用する放射光ビームラインによっては、Uni-Puck 識別のためのバーコードピンを所定の位置に入れる必要がある。
結晶の回収が完了したら、Uni-Puck 用ワンドを使用して液体窒素中で Uni-Puck に蓋をする。蓋をした Uni-Puck は、クライオトングを用いてシッピングケーンに移し、液体窒素を入れたドライシッパーで保存する。すぐに測定しない場合は、1週間に1回程度、液体窒素を補充しておく。
4. 回折像の確認
抗凍結処理がうまくできているかどうかは、X 線回折像で確認することができる(図6)。アイスリングと呼ばれる同心円状の回折が現れた場合、基本的にはクライオ条件の検討が必要であるが、アニーリング操作で改善することがある(補足4)。図6A のように、回折点の形状が悪くぼんやりしている場合は、プロテクタント溶液の組成やソーキング時間を検討する必要がある(補足5、補足6)。回折像に問題がないようであれば、そのままデータ収集を行う。最近は、放射光ビームラインの技術革新により、データ収集にかかる時間が極めて短く、データ収集をするかどうかを考える時間が律速段階になりうる。そのため、抗凍結剤の種類や濃度を変えた結晶を数多く用意し、X 線回折像で結晶の良し悪しを確認することなく、データ収集を行うこともある。
もし、低エネルギー X 線を利用したデータ収集を行うのであれば、特別なループを使用することが必要になる(補足7)。
工夫とコツ
補足1
グリセロールやエチレングリコールの他に、結晶化の沈殿剤として用いられている MPD や PEG、高濃度の塩、スクロースやトレハロースなどの糖もクライオプロテクタントとして用いられる。
例えば、分子量5,000以下の PEG や MPD を沈殿剤として使用している結晶化条件であれば、PEG や MPD の濃度を上げることでクライオプロテクタントになりうる。濃度を上げてもクライオプロテクタントとして使用できない場合、または分子量5,000以上の PEG を含む結晶化条件であれば、PEG400 などの低分子量 PEG を加えることで、クライオプロテクタントとして使用できる場合がある。
一方、結晶を鉱物油で覆うことで、結晶表面の氷の生成を抑えることができる。Hampton Research 社の Parabar 10312(Paratone)や、MiTeGen 社の LV CryoOil などの汎用クライオプロテクタントも販売されている。
補足2
プロテクタント溶液へのソーキングによって結晶が壊れてしまう場合、ソーキング時間を短くすることで改善されることがある。もし結晶が割れてしまっても結晶の破片が十分きれいであれば、それを使ってデータ収集することも可能である。
結晶が激しく壊れてしまう場合は、抗凍結剤の濃度を段階的に上げていく方法もある。抗凍結条件の検討は結晶構造解析の重要なステップであり、市販のキットの条件を一通り試してみるのが良いだろう。
補足3
結晶を得た母液とプロテクタント溶液の条件が異なることは、結晶が溶解したり劣化したりする原因となりうる。結晶の溶解や劣化を回避するため、プロテクタント溶液の pH 等は、可能な限り結晶の母液に合わせておくのが良い (3)。
補足4
アニーリングには,ゴニオメーターヘッド上で窒素ガスの気流を遮り融解させ、再度窒素ガスで凍結させる方法と、凍結した結晶をプロテクタント溶液に戻して再度ループですくい窒素ガスで凍結させる方法があり、良好な回折像が得られる場合がある。放射光ビームラインによっては、前者の方法をボタン一つで試すことができる。アニーリングは全ての結晶に適用できるわけではないが、X 線回折像を1–2枚撮影し、結晶の回折能やスポットの形状が悪い場合は,結晶を破棄する前に試してみても良いだろう。
補足5
結晶がガラス状に凍結されているが、回折しない、あるいはきれいな回折点が得られないことがよくある。このような場合、結晶がそもそも悪いか、クライオ条件が悪いか、どちらかである。実験室系での実験であれば、室温での回折像を撮影することで結晶自体の良否を判断することができる。
補足6
結晶自体に問題がある場合でも、抗凍結処理によって改善される場合がある。例えば,抗凍結処理した結晶を、さらに別の抗凍結剤を用いて抗凍結処理することにより分解能が向上した例が報告されている (3)。結晶化条件の改良に難航したとしても、結晶の数が十分にあるようであれば、このようなマルチステップの抗凍結処理を試してみるのも良いかもしれない。
一般的なクライオ条件の検討のフローチャートを図7に示す。
補足7
低エネルギー X 線(長波長 X 線)を用いて測定する場合はループや溶媒からの散乱を無視できない。1.8 Å よりも長い波長の X 線を用いるのであれば、ナイロン製のループではなく、ポリイミドのような散乱の少ない材質でできたループ(LithoLoop)を使用するのが良い。ポリイミドはナイロンと比べて疎水性が低いため、結晶周囲の溶媒量が少なくなり、溶媒からのバックグラウンドも低減することができる。
MiTeGen 社は、ループからの散乱が少なく、余分な溶媒を容易に取り除くことができる MicroMount™ を販売している。例えば、Dual Thickness MicroLoop(MiTeGen 社)は、結晶マウント部分の近くに排出溝があり、余分な溶媒を容易に取り除くことができる。さらに、網状の MicroMesh Loop(MiTeGen 社)を用いて、抗凍結処理をしていない結晶の周囲の溶媒を完全に除去してデータ収集した例も報告されている (4)。
文献
- Hass, DJ., IUCrJ., 7, 148–157 (2020)
- Nakasako, M. et al., Rev. Sci. Instrum., 73, 1318–1320 (2002)
- Senda, M.et al., Crystal Growth & Design, 16, 1565–1571 (2016)
- Pellegrini, E. et al., Acta Crystallogr. D Biol. Crystallogr., 67, 902–906 (2011)
[クライオ実験全般についての文献]
- タンパク質の結晶化、京都大学学術出版会 (2005)
- Macromolecular Crystallography Protocols: vol. 2, Humana Press (2007)
- Pflugrath, JW., Acta Crystallogr. F Struct. Biol. Commun., 71, 622–642 (2015)
謝辞
当プロトコルの作成に際し、当研究室の学生である岡﨑菫氏の協力を得た。


