概要
シリアルフェムト秒結晶構造解析では、微結晶を連続的に送りながら、X線自由電子レーザーを照射し、多数の結晶によるX線回折像を用いて蛋白質構造解析を行う。本稿ではリゾチームを例に、バッチ法による微結晶作成方法を紹介し、現在我々がよく用いている高粘度媒体による結晶送液方法についても解説を行う。
イントロダクション
X 線自由電子レーザー(XFEL)は、超高輝度、極短パルス、高空間コヒーレンスといった特徴を有する新世代の放射光である。XFEL の非常に強力な X 線パルスによって、照射後に試料は崩壊するが、放射線損傷によって化学結合が切断されるより短い時間(<10 fs)でデータを測定することで、損傷のない構造を得ることが可能である。最近、インジェクターを使って多数の微結晶を連続して送り込み、放射線損傷を受ける前の X 線回折像を測定し、蛋白質構造解析を行うシリアルフェムト秒結晶解析法(Serial Femtosecond Crystallography: SFX)が開発された(1)。インジェクターとは、微結晶を含む溶液を連続的に結晶が供給されるように一定の早さで細いノズルより流す装置であり、SFX は基本的に非凍結状態での測定である。そのため、SFX で得られた構造は、クライオ条件下の構造とは異なり、より生理条件に近く放射線損傷がない形で得られると期待されている。ここ数年の間に、XFEL パルスを用いた SFX による構造解析が報告されるようになり、膜蛋白質の解析例も報告されるようになった。SFX では、微結晶(1~20 μm程度)を使用するため、ヒトを含む動物由来の蛋白質など大きな単結晶の作成が難しいとされる高難度蛋白質の構造解析に有利である。また、微結晶を含む溶液を流しながら測定するため、従来行ってきた結晶化ドロップから手作業によって結晶をループ等で掬い上げてマウントする必要がなく、迅速な構造解析が期待できる。
SACLA(SPring-8 Angstrom Compact free electron LAser)は、米国のLCLS(Linac Coherent Light Source)に次いで世界で二番目に設立された XFEL 施設である。我々は SACLA において、SFX に適した回折チャンバー、インジェクター等の装置開発に携わってきた。当初は測定に数100 mg もの蛋白質を必要としていたが、インジェクターや試料の送液方法の開発を進め、現在では、1 mg 以下といった少量でのSFX実験が可能となり、様々な蛋白質結晶の回折データ収集や構造決定が達成されつつある。
このように SFX は新たな構造生物学の分野として成長が著しいが、いざ実験に取り掛かろうとすると、最初の段階である微結晶化にまずは戸惑うかもしれない。従来の蛋白質結晶化においては、結晶サイズを大きくする手法は様々に開発されてきたが、均一な微結晶作成方法はあまり知られていない。SFX 実験には少なくとも107個/mL 程度の結晶密度の溶液を50~100 μL 程度用意する必要がある。微結晶は、蒸気拡散法でも得られるが、多数の微結晶を均一に得るには、バッチ法で作成する方が容易である。その他に、自由界面拡散法による結晶化が目的の微結晶を得るのに適していたという例も報告されている(2)。
微結晶が得られたら、いよいよ SFX 実験である。インジェクターを使って結晶を送る、と言っても、なかなか想像がつきにくいかもしれない。現在までに様々なインジェクターが開発されており、大きく分けると低粘度の溶液と結晶を共に流すリキッドジェット方式と、高粘度溶液を媒体として使用する方式が知られている。結晶を連続的に送るには、ノズル径にもよるがリキッドジェット方式の方が流速を速くする必要があり、一般的にサンプル消費量が多い。一方、高粘度溶液は、低流速(~0.5 μL/min)で流しても試料が途切れずに、連続して結晶を送ることができることから、最近ではこの方法を用いて実験を行っている。具体的には、膜蛋白質のLCP結晶化法で使われる脂質を媒体とする方法や、我々が開発したグリースを使った方法(3)があり、試料に応じて媒体を使い分けている。
本稿では、SFX 実験の標準試料としてよく用いられるリゾチームの微結晶作成方法について紹介し、続いてグリース法による結晶送液方法について解説する。初めて SFX 実験を行う際、リゾチームの微結晶化を行うことにより、微結晶化方法や結晶密度について理解を深めるのにとても参考になる。グリースを媒体とした結晶送液方法も、単結晶の扱いとは全く異なった手法なので、測定の前までにリゾチームなどの微結晶で一度は予備実験することをお勧めしたい。また、工夫とコツでは、他の蛋白質における微結晶化スクリーニング方法についても紹介する。
装置・器具・試薬
装置
・微結晶化
- Thermomixer C(Eppendorf)
- Eppendorf SmartBlock™ 50 mL(Eppendorf)
- pH メーター
- 顕微鏡 デジタルマイクロスコープ(Hirox 等)が望ましい
- 冷却遠心分離機
・高粘度媒体による結晶送液
卓上小型遠心機
器具
・微結晶化
30 μm CellTrics フィルター(Partec)、スライドガラス、カバーガラス、細胞計数盤 Onecell counter(バイオメディカルサイエンス)、数取器
・高粘度媒体による結晶送液
スライドガラス、スパチュラ、パラフィルム、ピペッター用チップ(200 μL)、シリンジ(1 mL、テルモ 型番SS-01T)、マイクロシリンジ (100 μL、 Hamilton 型番1710RN)、シリンジ用ニードル(内径 110 μm、 Hamilton 型番7803-04、 長さ10 mm、point 3)
試薬
- リゾチーム(卵白由来)生化学用(和光純薬、120-02674)
- 酢酸(和光純薬、017-00256)
- 酢酸ナトリウム・三水和物(和光純薬、198-01055)
- 塩化ナトリウム(和光純薬、191-01665)
- 50% (w/v) PEG6000(Hampton research、HR2-533)
- SuperLube グリース (アズワン、1-5584-01)
実験手順
I. リゾチーム微結晶化方法
1)各種溶液調製
2)結晶化及び結晶の回収
3)結晶密度の測定
II. 高粘度媒体(グリース)による結晶送液方法
4)グリースと結晶の懸濁方法
5)インジェクターへの試料導入
実験の詳細
I. リゾチーム微結晶作成方法
この結晶化方法は、Falknerらの方法(4)を基に目的の大きさの結晶が得られるように最適化した方法である。本方法では、沈殿剤とリゾチーム溶液を混合すると瞬時に結晶が生成する。温度を変えることで結晶サイズの制御も可能であるが、ここでは温度を17℃で固定して5 μmサイズのリゾチーム微結晶を作製する方法について解説する。(他のサイズの作成方法については工夫とコツを参照のこと)
1)各種溶液調製
- 緩衝液(1 M 酢酸ナトリウム緩衝液 pH 3.0)
1 M 酢酸に1 M 酢酸ナトリウムを少量加えて(1 M 酢酸が100 mLの時、2.5 mL程度)、pH 3.0に調整する。 - 結晶化溶液(28% 塩化ナトリウム、8% PEG6000、0.1 M 酢酸ナトリウム緩衝液 pH 3.0)
ビーカーに1 M酢酸ナトリウム緩衝液を最終体積の1/10量加え、次いで塩化ナトリウムとPEG6000を添加する。塩化ナトリウムの濃度が高く溶解しにくいので、最終体積間際まで超純水を加え、数時間~一晩スターラーで撹拌する。塩化ナトリウムが溶解した後メスアップし、0.22 μmフィルターでフィルター濾過する。塩が析出するので室温で保存する。また、pHが変化してしまうので長期保存(一週間以上)はしない。 - 結晶用ハーベスト溶液(10% 塩化ナトリウム、1 M 酢酸ナトリウム緩衝液 pH 3.0)
終濃度がそれぞれ10%、1 Mになるように塩化ナトリウムと酢酸を添加し、1 M 酢酸ナトリウムでpH 3.0に調整する。メスアップ後、0.22 μmフィルターでフィルター濾過する。 - リゾチーム溶液
1 M 酢酸ナトリウム緩衝液 pH 3.0を超純水で10倍に希釈して0.1 M 酢酸ナトリウム緩衝液10 mLを調製する。この溶液に最終濃度20 mg/mLになるようリゾチームを加えて溶解し、0.22 μmフィルターでフィルター濾過する。リゾチーム溶液は一日以上置くと結晶サイズが変わることがあるので、用時調製する。
2)結晶化及び結晶の回収
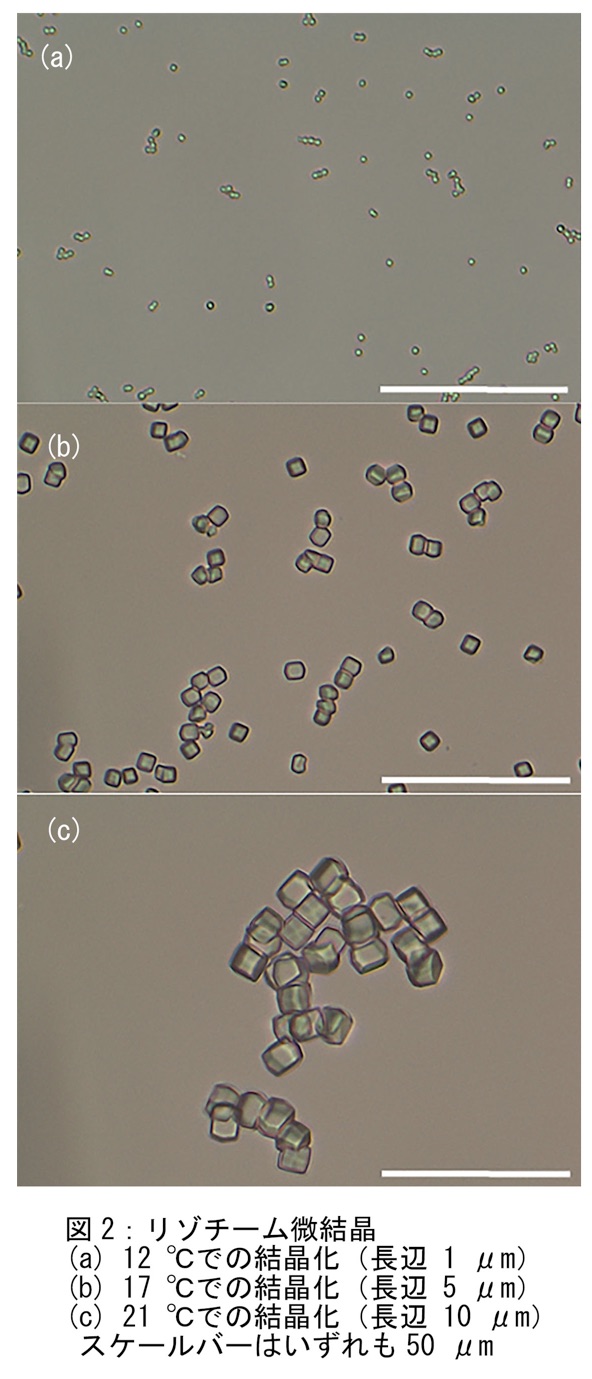
10 mLのリゾチーム溶液と10 mL の結晶化溶液を異なる50 mLファルコンチューブに入れ、17℃に設定したThermomixer Cに入れ、30分間、500 rpmで撹拌を行う。(Thermomixer C は温度制御をしながら、水平方向に回転して振とうすることが可能である。)30分後、結晶化溶液を手で温めない様に注意しながらThermomixer Cより取り出し、Thermomixer Cで撹拌させているリゾチーム溶液に一気に添加して10分間撹拌する。結晶化溶液添加と同時にリゾチーム溶液が白濁し(図1)、長辺が5 μm程度の均一な微結晶が生成する(図2b)。
顕微鏡で微結晶を確認した後、微結晶溶液を3000×g、5分、4℃で遠心分離する。上清をデカンテーションにより除き、10 mLの結晶用ハーベスト溶液を添加して転倒混和により懸濁する。SFX実験の際には、インジェクターノズルが詰まるのを防ぐために、結晶溶液を30 μm CellTricsフィルターでろ過するのが望ましい。
3)結晶密度の測定
微結晶懸濁液をハーベスト溶液で100倍希釈・懸濁し、10 μLを細胞計数盤(Onecell counter)に注入する。数取器などを使って結晶を計測し、結晶密度を求める。この結晶化条件では、およそ1.6×108個/mLの微結晶が得られる。
II. 高粘度媒体(グリース)による結晶送液方法
グリースを蛋白質結晶のキャリア媒体とする本法は、多くの結晶に対し損傷を与えにくく、かつ簡単に試料調製できることから、SACLAにおいてよく用いられている。ここでは、グリースと結晶の混合方法、及びインジェクターへの試料導入方法について解説する。我々がSFX実験を始めた当初、高粘度媒体用のインジェクターを有していなかったため、ハミルトン製シリンジをインジェクターとして使用していた。実験時には、試料を装填したシリンジのプランジャーをステッピングモーターによりゆっくり押し出し、吐出した一連の固体試料の流れ(ストリーム)にX線レーザーを照射する。図3にSACLAで使用している装置の外観を示す(5)。シリンジによるインジェクターは単純な仕組みではあるが、手早くかつ容易にSFX実験を行うことができる利点がある。
4)グリースと結晶の懸濁方法
結晶はグリースと混合するため、混合前よりも結晶密度が低くなる。SFX実験では結晶密度が重要であり、適切な濃度で測定を行う必要がある。(詳細は工夫とコツにて後述)そこで、結晶密度を10倍に濃縮するために、結晶密度107個/mL程度に調製した微結晶懸濁液100 μLを卓上小型遠心機で約10秒間遠心し、その上澄み液90 μLを取り除く。もし、濃縮前の結晶密度が106個/mL以下の場合は、遠心等で適宜濃縮し濃度調整を行う。この遠心操作及び懸濁操作は室温で行っている。
次に、マイクロシリンジに充填した72 μL のグリースをスライドガラスに分注し、上記濃縮した8 μLの結晶溶液をピペットマンで加える(図4a)。ここで、サンプルはグリースにより10倍希釈されるため、サンプル調製時の結晶化密度となる。スパチュラを用いて約3分間手早く結晶を良く混ぜ込む(図4b)。懸濁したグリース試料はスパチュラで集め取り、ピペッター用チップ(200 μL用)の径が太い方に詰め込む(図4c)。この際、前もってチップの太い方を1 cm程度ハサミで切っておく。(下記で使用するテルモシリンジへの装着のため)
5)インジェクターへの試料導入
遠心操作によるチップからのサンプル流出を防止するため、チップ先端をパラフィルムで覆う。チップは卓上小型遠心機で2~3秒間遠心し(図4d)、サンプルをチップ先端側に集める(図4e)。そのチップを1.0 mLの使い捨てテルモシリンジに装着し(図4f)、プランジャーを外したマイクロシリンジ(グリース分注時に使用したものとは別に用意する)の吐出口反対側からサンプルを注入する。ここまでの作業で、通常40~50 μLの試料が回収できる。これらサンプル操作手順は
http://www.nature.com/nmeth/journal/v12/n1/fig_tab/nmeth.3172_SV1.html
にてムービーを公開している(3)。続いてシリンジホルダー、および温度制御用ジャケットを取り付ける。
SFX実験で使用するサンプル量は、結晶密度107個/mlで100 μL以上を準備するのが望ましい。大体の目安としては、100 μLの結晶懸濁液の結晶を沈殿させた時に、その結晶沈殿部が10 μL程度必要である。最後に、グリースに使用したシリンジはエタノール又はヘキサンで洗浄を行う。
工夫とコツ
結晶化
リゾチームの場合、結晶化の温度を変えることで生成する結晶のサイズを変えることができる(図2)。上記の実験で温度設定を12℃にすると長辺1 μm程度になり、21℃に設定すると長辺が約10 μmの結晶が得られる。
結晶化に関連して、他の蛋白質の微結晶化スクリーニングを行う際には、下記のように実験を進めている。まだ検討途中の段階であるが参考のため紹介する(図5)。
- 微結晶が出やすい条件を探すため、nLスケールなど微量での蒸気拡散法によるスクリーニングを行う。1-30 μm程度の結晶が数多く出ている条件があれば、その条件のpHや沈殿剤の濃度を変えてバッチ法によるスクリーニングを行う。その際、我々は、Sitting drop用プレートを使って、少量のバッチ法(1 μLずつなど)を検討している。結晶化温度は20℃及び4℃で行うことが多い。蛋白質と結晶化溶液を混合してから、直後に結晶が出る場合と数日かかることもあるので、経時変化を観察する。
- 結晶が出来にくい場合は、Hamptonのseed beadなど使用して細かくすり潰した種結晶を加えるのも効果的である。結晶サイズが大きい時は、温度を下げると小さくなることが多い。
- 少量のバッチ法からスケールアップする時には、結晶成長の様子が変わることもあるので、検討が必要である。特に混合直後に結晶が生成する場合は、わずかな温度変化で結晶の大きさが変わるので、温度を一定に保つようにするのが重要である。
- 結晶化に使用する体積が増えると混合しにくくなるので、旋回式振とう機を使うのも良い。特に結晶化に時間がかかる時は、振とう機を使う方が良い結果が得られることが多い。
結晶の回収
高粘度媒体用インジェクターを使用する場合は、30~50 μm以上の沈殿物や結晶などが含まれていると、110 μm内径のニードルが詰まりやすいため、フィルターで濾過を行う。一方、30 μm以下の結晶のみである場合は、却ってフィルターによる濾過で結晶を多少失うため、濾過をしない方が良い。
結晶密度の測定
SFX実験において、結晶密度は非常に重要である。濃度が106個/mLより薄い場合は、結晶にX線パルスが当たる確率が低く、測定時間が長くなってしまう。また108個/mLより高い結晶密度の場合は、複数の結晶由来の反射が一枚のイメージに記録され、現段階では指数付けが困難である(http://www.desy.de/~twhite/crystfel/hitrate.html を参考のこと)。事前に結晶密度を測定して、濃度を調整しておくことが望ましい。
グリースと結晶の懸濁方法
本手法は、結晶キャリア媒体としてグリースを用いるため、使用するグリースが結晶に損傷を与えるかどうかを事前に確認する必要がある。シリンジ型インジェクターを使用したSFX実験において、グリースへの結晶の混合から測定の終了まで要する時間は約2~3時間である。従って、予備実験として事前に結晶をグリースに混合し、4時間以上経過しても結晶にひび割れ、溶解等が生じないことを顕微鏡で確認する。また、回折装置を利用できる場合、グリース混合前後の回折能等を確認することを勧めたい。
サンプル濃縮は実験直前に行う。結晶密度107個/mL に調整したサンプルを遠心、上澄み液を取り除き、1日放置しておくと、しばしば結晶同士が凝集し、ニードルでの結晶詰まりの原因となる。
72 μL のグリースをスライドガラスに分注するには、あらかじめ200 μL用ピペッターチップを装着した5 mlディスポーザルシリンジに充填したグリースを、マイクロシリンジ後部から80~90 μL程度流し込み、最終的に72 μLのグリースを準備する。一方、濃縮した結晶懸濁液8 μLはピペットマンでの分注が可能である。
グリースに結晶を混ぜる際、その試料の結晶密度が低すぎると多量の結晶化バッファーがグリースに混入することになる。グリースへの多量の溶液混入は、安定したグリースストリームの妨げになる(粘性が低下することで、グリースストリームが切れやすくなる)。多量の溶液の混入を避けるために、遠心によって使用する結晶密度を調整する。
グリースへの結晶の混合は、スパチュラの平たい面を使用して混ぜ込む。その際、サンプルをスパチュラで押さえつけすぎない様に、グリース表面を触れるだけの感覚で混合作業を行う。この作業において、通常の回折実験で用いている100 μm程度の蛋白質結晶とは異なり、10 μm程度の蛋白質結晶は多くの場合物理的損傷を受けにくいようである。スパチュラを使用した混合作業により、結晶にひび割れ等の損傷を与えないことを幾つかの例では顕微鏡下で確認できている。
プレート上での結晶とグリースとの混合作業時、高濃度塩を含む試料では塩結晶が析出しやすく、ニードル内での詰まりなどの問題を引き起こす。塩結晶の析出を抑えるため、混合の際、結晶化溶液は手早くグリースに混ぜ込むと良い。調製後、残ったサンプルを用いて顕微鏡で塩結晶析出の有無を確認する。
4℃で結晶化を行ったサンプルに関して、現在サンプルホルダーを4℃に保つことが可能であるため、SFX実験直前までサンプルは4℃に保持できる。その際、シリンジへのサンプル充填作業は4℃に保たれた実験室で行う。
文献
- Chapman, HN. et al., Nature, 470, 73-7 (2011)
- Kupitz, C. et al., Philos. Trans. R. Soc. London B Biol. Sci. 369, 20130316 (2014)
- Sugahara, M. et al., Nat. Methods, 12, 61-3 (2015)
- Falkner, JC. et al., Chem. Mater., 13, 2679-86 (2005)
- Tono, K. et al., J. Synchrotron Rad. 22, 532-7 (2015)
概要
シリアルフェムト秒結晶構造解析では、微結晶を連続的に送りながら、X線自由電子レーザーを照射し、多数の結晶によるX線回折像を用いて蛋白質構造解析を行う。本稿ではリゾチームを例に、バッチ法による微結晶作成方法を紹介し、現在我々がよく用いている高粘度媒体による結晶送液方法についても解説を行う。
イントロダクション
X 線自由電子レーザー(XFEL)は、超高輝度、極短パルス、高空間コヒーレンスといった特徴を有する新世代の放射光である。XFEL の非常に強力な X 線パルスによって、照射後に試料は崩壊するが、放射線損傷によって化学結合が切断されるより短い時間(<10 fs)でデータを測定することで、損傷のない構造を得ることが可能である。最近、インジェクターを使って多数の微結晶を連続して送り込み、放射線損傷を受ける前の X 線回折像を測定し、蛋白質構造解析を行うシリアルフェムト秒結晶解析法(Serial Femtosecond Crystallography: SFX)が開発された(1)。インジェクターとは、微結晶を含む溶液を連続的に結晶が供給されるように一定の早さで細いノズルより流す装置であり、SFX は基本的に非凍結状態での測定である。そのため、SFX で得られた構造は、クライオ条件下の構造とは異なり、より生理条件に近く放射線損傷がない形で得られると期待されている。ここ数年の間に、XFEL パルスを用いた SFX による構造解析が報告されるようになり、膜蛋白質の解析例も報告されるようになった。SFX では、微結晶(1~20 μm程度)を使用するため、ヒトを含む動物由来の蛋白質など大きな単結晶の作成が難しいとされる高難度蛋白質の構造解析に有利である。また、微結晶を含む溶液を流しながら測定するため、従来行ってきた結晶化ドロップから手作業によって結晶をループ等で掬い上げてマウントする必要がなく、迅速な構造解析が期待できる。
SACLA(SPring-8 Angstrom Compact free electron LAser)は、米国のLCLS(Linac Coherent Light Source)に次いで世界で二番目に設立された XFEL 施設である。我々は SACLA において、SFX に適した回折チャンバー、インジェクター等の装置開発に携わってきた。当初は測定に数100 mg もの蛋白質を必要としていたが、インジェクターや試料の送液方法の開発を進め、現在では、1 mg 以下といった少量でのSFX実験が可能となり、様々な蛋白質結晶の回折データ収集や構造決定が達成されつつある。
このように SFX は新たな構造生物学の分野として成長が著しいが、いざ実験に取り掛かろうとすると、最初の段階である微結晶化にまずは戸惑うかもしれない。従来の蛋白質結晶化においては、結晶サイズを大きくする手法は様々に開発されてきたが、均一な微結晶作成方法はあまり知られていない。SFX 実験には少なくとも107個/mL 程度の結晶密度の溶液を50~100 μL 程度用意する必要がある。微結晶は、蒸気拡散法でも得られるが、多数の微結晶を均一に得るには、バッチ法で作成する方が容易である。その他に、自由界面拡散法による結晶化が目的の微結晶を得るのに適していたという例も報告されている(2)。
微結晶が得られたら、いよいよ SFX 実験である。インジェクターを使って結晶を送る、と言っても、なかなか想像がつきにくいかもしれない。現在までに様々なインジェクターが開発されており、大きく分けると低粘度の溶液と結晶を共に流すリキッドジェット方式と、高粘度溶液を媒体として使用する方式が知られている。結晶を連続的に送るには、ノズル径にもよるがリキッドジェット方式の方が流速を速くする必要があり、一般的にサンプル消費量が多い。一方、高粘度溶液は、低流速(~0.5 μL/min)で流しても試料が途切れずに、連続して結晶を送ることができることから、最近ではこの方法を用いて実験を行っている。具体的には、膜蛋白質のLCP結晶化法で使われる脂質を媒体とする方法や、我々が開発したグリースを使った方法(3)があり、試料に応じて媒体を使い分けている。
本稿では、SFX 実験の標準試料としてよく用いられるリゾチームの微結晶作成方法について紹介し、続いてグリース法による結晶送液方法について解説する。初めて SFX 実験を行う際、リゾチームの微結晶化を行うことにより、微結晶化方法や結晶密度について理解を深めるのにとても参考になる。グリースを媒体とした結晶送液方法も、単結晶の扱いとは全く異なった手法なので、測定の前までにリゾチームなどの微結晶で一度は予備実験することをお勧めしたい。また、工夫とコツでは、他の蛋白質における微結晶化スクリーニング方法についても紹介する。
装置・器具・試薬
装置
・微結晶化
- Thermomixer C(Eppendorf)
- Eppendorf SmartBlock™ 50 mL(Eppendorf)
- pH メーター
- 顕微鏡 デジタルマイクロスコープ(Hirox 等)が望ましい
- 冷却遠心分離機
・高粘度媒体による結晶送液
卓上小型遠心機
器具
・微結晶化
30 μm CellTrics フィルター(Partec)、スライドガラス、カバーガラス、細胞計数盤 Onecell counter(バイオメディカルサイエンス)、数取器
・高粘度媒体による結晶送液
スライドガラス、スパチュラ、パラフィルム、ピペッター用チップ(200 μL)、シリンジ(1 mL、テルモ 型番SS-01T)、マイクロシリンジ (100 μL、 Hamilton 型番1710RN)、シリンジ用ニードル(内径 110 μm、 Hamilton 型番7803-04、 長さ10 mm、point 3)
試薬
- リゾチーム(卵白由来)生化学用(和光純薬、120-02674)
- 酢酸(和光純薬、017-00256)
- 酢酸ナトリウム・三水和物(和光純薬、198-01055)
- 塩化ナトリウム(和光純薬、191-01665)
- 50% (w/v) PEG6000(Hampton research、HR2-533)
- SuperLube グリース (アズワン、1-5584-01)
実験手順
I. リゾチーム微結晶化方法
1)各種溶液調製
2)結晶化及び結晶の回収
3)結晶密度の測定
II. 高粘度媒体(グリース)による結晶送液方法
4)グリースと結晶の懸濁方法
5)インジェクターへの試料導入
実験の詳細
I. リゾチーム微結晶作成方法
この結晶化方法は、Falknerらの方法(4)を基に目的の大きさの結晶が得られるように最適化した方法である。本方法では、沈殿剤とリゾチーム溶液を混合すると瞬時に結晶が生成する。温度を変えることで結晶サイズの制御も可能であるが、ここでは温度を17℃で固定して5 μmサイズのリゾチーム微結晶を作製する方法について解説する。(他のサイズの作成方法については工夫とコツを参照のこと)
1)各種溶液調製
- 緩衝液(1 M 酢酸ナトリウム緩衝液 pH 3.0)
1 M 酢酸に1 M 酢酸ナトリウムを少量加えて(1 M 酢酸が100 mLの時、2.5 mL程度)、pH 3.0に調整する。 - 結晶化溶液(28% 塩化ナトリウム、8% PEG6000、0.1 M 酢酸ナトリウム緩衝液 pH 3.0)
ビーカーに1 M酢酸ナトリウム緩衝液を最終体積の1/10量加え、次いで塩化ナトリウムとPEG6000を添加する。塩化ナトリウムの濃度が高く溶解しにくいので、最終体積間際まで超純水を加え、数時間~一晩スターラーで撹拌する。塩化ナトリウムが溶解した後メスアップし、0.22 μmフィルターでフィルター濾過する。塩が析出するので室温で保存する。また、pHが変化してしまうので長期保存(一週間以上)はしない。 - 結晶用ハーベスト溶液(10% 塩化ナトリウム、1 M 酢酸ナトリウム緩衝液 pH 3.0)
終濃度がそれぞれ10%、1 Mになるように塩化ナトリウムと酢酸を添加し、1 M 酢酸ナトリウムでpH 3.0に調整する。メスアップ後、0.22 μmフィルターでフィルター濾過する。 - リゾチーム溶液
1 M 酢酸ナトリウム緩衝液 pH 3.0を超純水で10倍に希釈して0.1 M 酢酸ナトリウム緩衝液10 mLを調製する。この溶液に最終濃度20 mg/mLになるようリゾチームを加えて溶解し、0.22 μmフィルターでフィルター濾過する。リゾチーム溶液は一日以上置くと結晶サイズが変わることがあるので、用時調製する。
2)結晶化及び結晶の回収
10 mLのリゾチーム溶液と10 mL の結晶化溶液を異なる50 mLファルコンチューブに入れ、17℃に設定したThermomixer Cに入れ、30分間、500 rpmで撹拌を行う。(Thermomixer C は温度制御をしながら、水平方向に回転して振とうすることが可能である。)30分後、結晶化溶液を手で温めない様に注意しながらThermomixer Cより取り出し、Thermomixer Cで撹拌させているリゾチーム溶液に一気に添加して10分間撹拌する。結晶化溶液添加と同時にリゾチーム溶液が白濁し(図1)、長辺が5 μm程度の均一な微結晶が生成する(図2b)。
顕微鏡で微結晶を確認した後、微結晶溶液を3000×g、5分、4℃で遠心分離する。上清をデカンテーションにより除き、10 mLの結晶用ハーベスト溶液を添加して転倒混和により懸濁する。SFX実験の際には、インジェクターノズルが詰まるのを防ぐために、結晶溶液を30 μm CellTricsフィルターでろ過するのが望ましい。
3)結晶密度の測定
微結晶懸濁液をハーベスト溶液で100倍希釈・懸濁し、10 μLを細胞計数盤(Onecell counter)に注入する。数取器などを使って結晶を計測し、結晶密度を求める。この結晶化条件では、およそ1.6×108個/mLの微結晶が得られる。
II. 高粘度媒体(グリース)による結晶送液方法
グリースを蛋白質結晶のキャリア媒体とする本法は、多くの結晶に対し損傷を与えにくく、かつ簡単に試料調製できることから、SACLAにおいてよく用いられている。ここでは、グリースと結晶の混合方法、及びインジェクターへの試料導入方法について解説する。我々がSFX実験を始めた当初、高粘度媒体用のインジェクターを有していなかったため、ハミルトン製シリンジをインジェクターとして使用していた。実験時には、試料を装填したシリンジのプランジャーをステッピングモーターによりゆっくり押し出し、吐出した一連の固体試料の流れ(ストリーム)にX線レーザーを照射する。図3にSACLAで使用している装置の外観を示す(5)。シリンジによるインジェクターは単純な仕組みではあるが、手早くかつ容易にSFX実験を行うことができる利点がある。
4)グリースと結晶の懸濁方法
結晶はグリースと混合するため、混合前よりも結晶密度が低くなる。SFX実験では結晶密度が重要であり、適切な濃度で測定を行う必要がある。(詳細は工夫とコツにて後述)そこで、結晶密度を10倍に濃縮するために、結晶密度107個/mL程度に調製した微結晶懸濁液100 μLを卓上小型遠心機で約10秒間遠心し、その上澄み液90 μLを取り除く。もし、濃縮前の結晶密度が106個/mL以下の場合は、遠心等で適宜濃縮し濃度調整を行う。この遠心操作及び懸濁操作は室温で行っている。
次に、マイクロシリンジに充填した72 μL のグリースをスライドガラスに分注し、上記濃縮した8 μLの結晶溶液をピペットマンで加える(図4a)。ここで、サンプルはグリースにより10倍希釈されるため、サンプル調製時の結晶化密度となる。スパチュラを用いて約3分間手早く結晶を良く混ぜ込む(図4b)。懸濁したグリース試料はスパチュラで集め取り、ピペッター用チップ(200 μL用)の径が太い方に詰め込む(図4c)。この際、前もってチップの太い方を1 cm程度ハサミで切っておく。(下記で使用するテルモシリンジへの装着のため)
5)インジェクターへの試料導入
遠心操作によるチップからのサンプル流出を防止するため、チップ先端をパラフィルムで覆う。チップは卓上小型遠心機で2~3秒間遠心し(図4d)、サンプルをチップ先端側に集める(図4e)。そのチップを1.0 mLの使い捨てテルモシリンジに装着し(図4f)、プランジャーを外したマイクロシリンジ(グリース分注時に使用したものとは別に用意する)の吐出口反対側からサンプルを注入する。ここまでの作業で、通常40~50 μLの試料が回収できる。これらサンプル操作手順は
http://www.nature.com/nmeth/journal/v12/n1/fig_tab/nmeth.3172_SV1.html
にてムービーを公開している(3)。続いてシリンジホルダー、および温度制御用ジャケットを取り付ける。
SFX実験で使用するサンプル量は、結晶密度107個/mlで100 μL以上を準備するのが望ましい。大体の目安としては、100 μLの結晶懸濁液の結晶を沈殿させた時に、その結晶沈殿部が10 μL程度必要である。最後に、グリースに使用したシリンジはエタノール又はヘキサンで洗浄を行う。
工夫とコツ
結晶化
リゾチームの場合、結晶化の温度を変えることで生成する結晶のサイズを変えることができる(図2)。上記の実験で温度設定を12℃にすると長辺1 μm程度になり、21℃に設定すると長辺が約10 μmの結晶が得られる。
結晶化に関連して、他の蛋白質の微結晶化スクリーニングを行う際には、下記のように実験を進めている。まだ検討途中の段階であるが参考のため紹介する(図5)。
- 微結晶が出やすい条件を探すため、nLスケールなど微量での蒸気拡散法によるスクリーニングを行う。1-30 μm程度の結晶が数多く出ている条件があれば、その条件のpHや沈殿剤の濃度を変えてバッチ法によるスクリーニングを行う。その際、我々は、Sitting drop用プレートを使って、少量のバッチ法(1 μLずつなど)を検討している。結晶化温度は20℃及び4℃で行うことが多い。蛋白質と結晶化溶液を混合してから、直後に結晶が出る場合と数日かかることもあるので、経時変化を観察する。
- 結晶が出来にくい場合は、Hamptonのseed beadなど使用して細かくすり潰した種結晶を加えるのも効果的である。結晶サイズが大きい時は、温度を下げると小さくなることが多い。
- 少量のバッチ法からスケールアップする時には、結晶成長の様子が変わることもあるので、検討が必要である。特に混合直後に結晶が生成する場合は、わずかな温度変化で結晶の大きさが変わるので、温度を一定に保つようにするのが重要である。
- 結晶化に使用する体積が増えると混合しにくくなるので、旋回式振とう機を使うのも良い。特に結晶化に時間がかかる時は、振とう機を使う方が良い結果が得られることが多い。
結晶の回収
高粘度媒体用インジェクターを使用する場合は、30~50 μm以上の沈殿物や結晶などが含まれていると、110 μm内径のニードルが詰まりやすいため、フィルターで濾過を行う。一方、30 μm以下の結晶のみである場合は、却ってフィルターによる濾過で結晶を多少失うため、濾過をしない方が良い。
結晶密度の測定
SFX実験において、結晶密度は非常に重要である。濃度が106個/mLより薄い場合は、結晶にX線パルスが当たる確率が低く、測定時間が長くなってしまう。また108個/mLより高い結晶密度の場合は、複数の結晶由来の反射が一枚のイメージに記録され、現段階では指数付けが困難である(http://www.desy.de/~twhite/crystfel/hitrate.html を参考のこと)。事前に結晶密度を測定して、濃度を調整しておくことが望ましい。
グリースと結晶の懸濁方法
本手法は、結晶キャリア媒体としてグリースを用いるため、使用するグリースが結晶に損傷を与えるかどうかを事前に確認する必要がある。シリンジ型インジェクターを使用したSFX実験において、グリースへの結晶の混合から測定の終了まで要する時間は約2~3時間である。従って、予備実験として事前に結晶をグリースに混合し、4時間以上経過しても結晶にひび割れ、溶解等が生じないことを顕微鏡で確認する。また、回折装置を利用できる場合、グリース混合前後の回折能等を確認することを勧めたい。
サンプル濃縮は実験直前に行う。結晶密度107個/mL に調整したサンプルを遠心、上澄み液を取り除き、1日放置しておくと、しばしば結晶同士が凝集し、ニードルでの結晶詰まりの原因となる。
72 μL のグリースをスライドガラスに分注するには、あらかじめ200 μL用ピペッターチップを装着した5 mlディスポーザルシリンジに充填したグリースを、マイクロシリンジ後部から80~90 μL程度流し込み、最終的に72 μLのグリースを準備する。一方、濃縮した結晶懸濁液8 μLはピペットマンでの分注が可能である。
グリースに結晶を混ぜる際、その試料の結晶密度が低すぎると多量の結晶化バッファーがグリースに混入することになる。グリースへの多量の溶液混入は、安定したグリースストリームの妨げになる(粘性が低下することで、グリースストリームが切れやすくなる)。多量の溶液の混入を避けるために、遠心によって使用する結晶密度を調整する。
グリースへの結晶の混合は、スパチュラの平たい面を使用して混ぜ込む。その際、サンプルをスパチュラで押さえつけすぎない様に、グリース表面を触れるだけの感覚で混合作業を行う。この作業において、通常の回折実験で用いている100 μm程度の蛋白質結晶とは異なり、10 μm程度の蛋白質結晶は多くの場合物理的損傷を受けにくいようである。スパチュラを使用した混合作業により、結晶にひび割れ等の損傷を与えないことを幾つかの例では顕微鏡下で確認できている。
プレート上での結晶とグリースとの混合作業時、高濃度塩を含む試料では塩結晶が析出しやすく、ニードル内での詰まりなどの問題を引き起こす。塩結晶の析出を抑えるため、混合の際、結晶化溶液は手早くグリースに混ぜ込むと良い。調製後、残ったサンプルを用いて顕微鏡で塩結晶析出の有無を確認する。
4℃で結晶化を行ったサンプルに関して、現在サンプルホルダーを4℃に保つことが可能であるため、SFX実験直前までサンプルは4℃に保持できる。その際、シリンジへのサンプル充填作業は4℃に保たれた実験室で行う。
文献
- Chapman, HN. et al., Nature, 470, 73-7 (2011)
- Kupitz, C. et al., Philos. Trans. R. Soc. London B Biol. Sci. 369, 20130316 (2014)
- Sugahara, M. et al., Nat. Methods, 12, 61-3 (2015)
- Falkner, JC. et al., Chem. Mater., 13, 2679-86 (2005)
- Tono, K. et al., J. Synchrotron Rad. 22, 532-7 (2015)