概要
X線結晶構造解析研究において、微結晶や多結晶のように良好な単結晶が得られないためにX線回折強度イメージの収集に進めない場合が多数ある。結晶が得られた条件の周辺をさらに細かく検索しても良好な単結晶が得られない、あるいは核形成がうまくいかないために結晶成長が進まない、再現性良く結晶が得られない場合にはシーディング法を用いることが有効である。シーディング法とは、あらかじめ得られた結晶を、結晶の種として新しい結晶化ドロップに植え接ぐことによって結晶を成長させる方法である。このシーディング法には二つの代表的な方法がある。一つは結晶をそのまま種にするマクロシーディング法、二つは結晶を細かく砕いたものを種結晶にするミクロシーディング法である。前者は、得られた結晶を新たな溶液にそのまま浸漬することにより結晶を大きく育成させる方法である。しかし、単に結晶を大きくするだけでなく、結晶析出の再現性や、結晶サイズのコントロールや、モザイク角の小さい良質な結晶を必要とする場合もある。この際に役立つ方法が、ミクロシーディング法である。ここで本稿では、標準的なミクロシーディング法を写真と共に紹介し、結晶を扱ったことのない学部生、研究者にもすぐに実践可能なプロトコールを詳細に紹介する。今回はモデル蛋白質としてリゾチームを用いて、ミクロシーディング法の実例と、それによる結晶サイズの制御を紹介する。
装置・器具・試薬
装置
- 遠心機(卓上遠心機:チビタンなど)
- 光学顕微鏡
- インキュベーター
器具
- 結晶化プレート(図1A)
- カバーガラス
- ピペット(図1F)
- マイクロ遠心管((株)ビーエム:1.5 mL エッペンドルフ型チューブ, BM-15)(図1C)
- 攪拌棒((株) 家田貿易:ディスポ攪拌ペッスル, 9993)(図1D)
- ストリークシーディングプローブ(Hampton Research:Seeding tool, HR8-133)
試薬
- 緩衝溶液(本稿では酢酸ナトリウム)
- 蛋白質(本稿ではリゾチーム(ニワトリ卵白由来))
- 沈殿剤(本稿では塩化ナトリウム)
実験手順
第1日
1) 蛋白質溶液の調製(リゾチーム)
2) シードの調製
3) 結晶化
3-1) 直接法
3-2) プローブ法
実験の詳細
1) 蛋白質溶液の調製(リゾチーム)
リゾチーム (35 mg: 乾燥重量)を1 mL 50 mM sodium acetate (pH 4.5)により溶かす。遠心(卓上遠心機:チビタンなどで約3 min)後、上清を回収する。
2) シードの調製
2-1)リザーバー溶液を20μL取りマクロチューブの側壁に置く(図2-3)。
2-2)事前に作製したドロップ内の結晶を溶液へ移す(図2-5)。
2-3)卓上遠心機により結晶を底に落とした後、攪拌棒を用いて結晶をすりつぶす(図2-6)。
2-4)1.6 M sodium chloride、50 mM sodium acetate (pH 4.5)でシード。溶液を適当な倍率で希釈。
3) 結晶化
3-1)直接法
3-2-1)シード溶液と等量の蛋白質溶液を混合し、カバーガラスに混合溶液を置き、ハンギングドロップ蒸気拡散法により結晶化。リザーバー溶液は1.0 M sodium chloride、50 mM sodium acetate (pH 4.5)を用いた。
3-1-2)図3のようにシード溶液の希釈度により、結晶化ドロップ内の結晶数と結晶サイズ(10μm(A)-0.5 mm(F))をコントロールすることができる。
3-2)プローブ法
3-2-1)蛋白質溶液とリザーバー溶液を等量混ぜ、結晶化ドロップを作製(図4-2)。
3-2-2)シード溶液にプローブを浸し(図4-3)、プローブを結晶化ドロップに潜らせる(図4-4)。
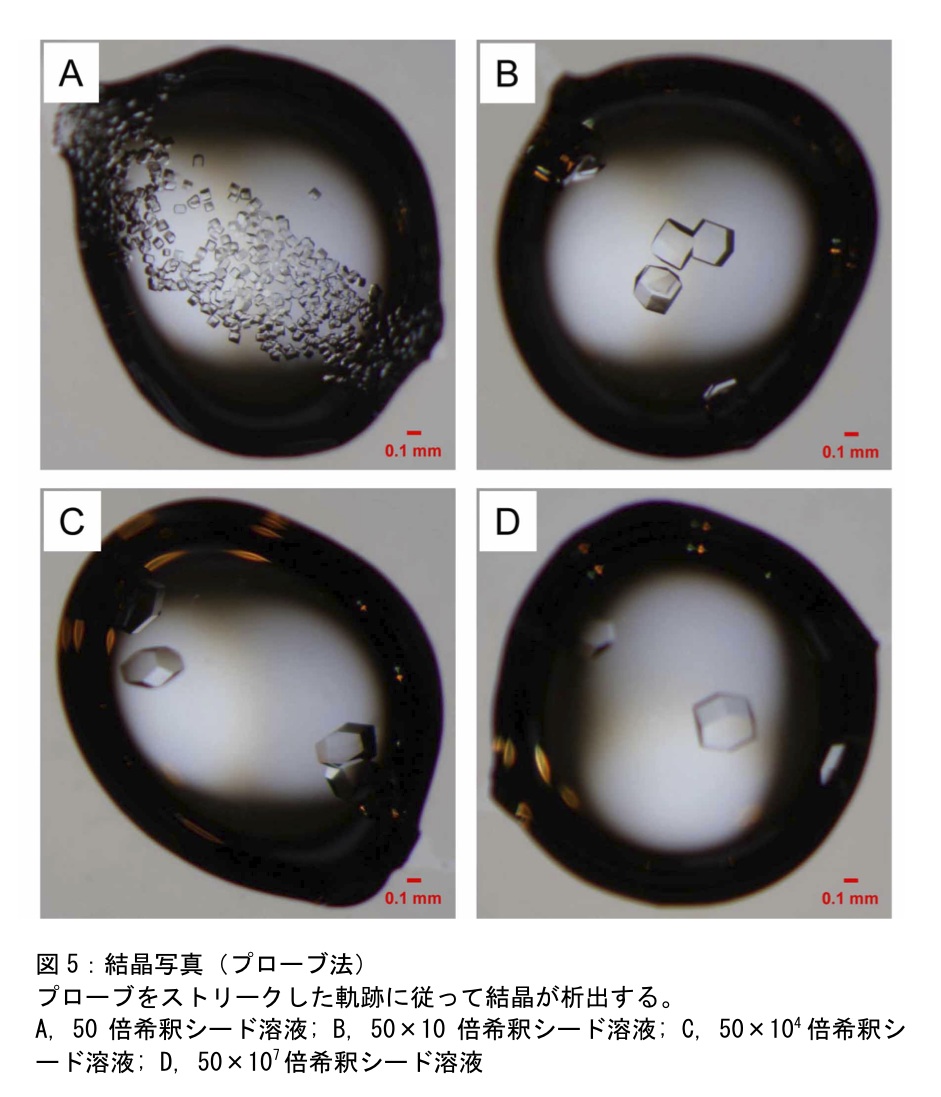
3-2-3)図5のようにプローブをストリークした軌跡に従って結晶が析出する。
工夫とコツ
道具について
本項では、ビーエム社のマクロチューブと家田貿易の攪拌ペッスルを用いたシード作製を紹介した。他社のマクロチューブを用いるとペッスルの先端部がマクロチューブの底まで届かなかったり、マクロチューブの内壁とかみ合わなかったりして、結晶をきちんとつぶすことができないので、この組み合わせをお勧めする。
ペッスルを用いたシード作製以外にHampton Research社からSeed Bead kitというシード作製キットも販売されているので参考にされたい。
シードの作製
シードは溶液中で容易に溶解してしまうので、シード溶液を作製したらすぐに使用する。
結晶母液より低濃度の溶液では、せっかく作製したシードは容易に溶解する。よって、シード溶液作製には、結晶化母液もしくは、結晶化母液より数割高い沈殿剤濃度の溶液でシード溶液を希釈したい。
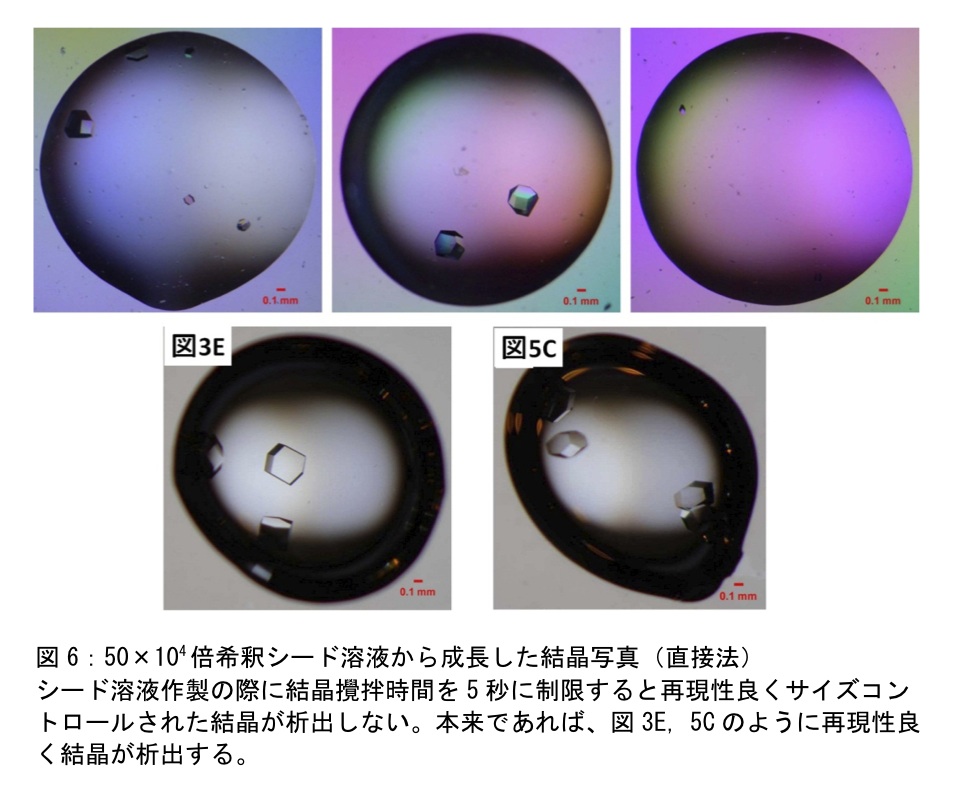
結晶を攪拌棒でつぶす目安であるが、5秒攪拌(図6)、1分攪拌(図3E, 5C)を示した。図のように攪拌時間が短いと結晶核にばらつきが生じ、ドロップ内の結晶成長(結晶サイズ)をうまくコントロールできない。
シーディング
シード溶液からストリークする以外にも、すでに得られている結晶に触れプローブにシードを付着させる方法もある。その他のシーディング法の文献を紹介する(1,2)。
文献
- 坂部知平監修、相原茂夫編集, タンパク質の結晶化, 京都大学学術出版会 (2005)
- Carter, C.W., Acta Cryst., D50, 572-90 (1994)
概要
X線結晶構造解析研究において、微結晶や多結晶のように良好な単結晶が得られないためにX線回折強度イメージの収集に進めない場合が多数ある。結晶が得られた条件の周辺をさらに細かく検索しても良好な単結晶が得られない、あるいは核形成がうまくいかないために結晶成長が進まない、再現性良く結晶が得られない場合にはシーディング法を用いることが有効である。シーディング法とは、あらかじめ得られた結晶を、結晶の種として新しい結晶化ドロップに植え接ぐことによって結晶を成長させる方法である。このシーディング法には二つの代表的な方法がある。一つは結晶をそのまま種にするマクロシーディング法、二つは結晶を細かく砕いたものを種結晶にするミクロシーディング法である。前者は、得られた結晶を新たな溶液にそのまま浸漬することにより結晶を大きく育成させる方法である。しかし、単に結晶を大きくするだけでなく、結晶析出の再現性や、結晶サイズのコントロールや、モザイク角の小さい良質な結晶を必要とする場合もある。この際に役立つ方法が、ミクロシーディング法である。ここで本稿では、標準的なミクロシーディング法を写真と共に紹介し、結晶を扱ったことのない学部生、研究者にもすぐに実践可能なプロトコールを詳細に紹介する。今回はモデル蛋白質としてリゾチームを用いて、ミクロシーディング法の実例と、それによる結晶サイズの制御を紹介する。
装置・器具・試薬
装置
- 遠心機(卓上遠心機:チビタンなど)
- 光学顕微鏡
- インキュベーター
器具
- 結晶化プレート(図1A)
- カバーガラス
- ピペット(図1F)
- マイクロ遠心管((株)ビーエム:1.5 mL エッペンドルフ型チューブ, BM-15)(図1C)
- 攪拌棒((株) 家田貿易:ディスポ攪拌ペッスル, 9993)(図1D)
- ストリークシーディングプローブ(Hampton Research:Seeding tool, HR8-133)
試薬
- 緩衝溶液(本稿では酢酸ナトリウム)
- 蛋白質(本稿ではリゾチーム(ニワトリ卵白由来))
- 沈殿剤(本稿では塩化ナトリウム)
実験手順
第1日
1) 蛋白質溶液の調製(リゾチーム)
2) シードの調製
3) 結晶化
3-1) 直接法
3-2) プローブ法
実験の詳細
1) 蛋白質溶液の調製(リゾチーム)
リゾチーム (35 mg: 乾燥重量)を1 mL 50 mM sodium acetate (pH 4.5)により溶かす。遠心(卓上遠心機:チビタンなどで約3 min)後、上清を回収する。
2) シードの調製
2-1)リザーバー溶液を20μL取りマクロチューブの側壁に置く(図2-3)。
2-2)事前に作製したドロップ内の結晶を溶液へ移す(図2-5)。
2-3)卓上遠心機により結晶を底に落とした後、攪拌棒を用いて結晶をすりつぶす(図2-6)。
2-4)1.6 M sodium chloride、50 mM sodium acetate (pH 4.5)でシード。溶液を適当な倍率で希釈。
3) 結晶化
3-1)直接法
3-2-1)シード溶液と等量の蛋白質溶液を混合し、カバーガラスに混合溶液を置き、ハンギングドロップ蒸気拡散法により結晶化。リザーバー溶液は1.0 M sodium chloride、50 mM sodium acetate (pH 4.5)を用いた。
3-1-2)図3のようにシード溶液の希釈度により、結晶化ドロップ内の結晶数と結晶サイズ(10μm(A)-0.5 mm(F))をコントロールすることができる。
3-2)プローブ法
3-2-1)蛋白質溶液とリザーバー溶液を等量混ぜ、結晶化ドロップを作製(図4-2)。
3-2-2)シード溶液にプローブを浸し(図4-3)、プローブを結晶化ドロップに潜らせる(図4-4)。
3-2-3)図5のようにプローブをストリークした軌跡に従って結晶が析出する。
工夫とコツ
道具について
本項では、ビーエム社のマクロチューブと家田貿易の攪拌ペッスルを用いたシード作製を紹介した。他社のマクロチューブを用いるとペッスルの先端部がマクロチューブの底まで届かなかったり、マクロチューブの内壁とかみ合わなかったりして、結晶をきちんとつぶすことができないので、この組み合わせをお勧めする。
ペッスルを用いたシード作製以外にHampton Research社からSeed Bead kitというシード作製キットも販売されているので参考にされたい。
シードの作製
シードは溶液中で容易に溶解してしまうので、シード溶液を作製したらすぐに使用する。
結晶母液より低濃度の溶液では、せっかく作製したシードは容易に溶解する。よって、シード溶液作製には、結晶化母液もしくは、結晶化母液より数割高い沈殿剤濃度の溶液でシード溶液を希釈したい。
結晶を攪拌棒でつぶす目安であるが、5秒攪拌(図6)、1分攪拌(図3E, 5C)を示した。図のように攪拌時間が短いと結晶核にばらつきが生じ、ドロップ内の結晶成長(結晶サイズ)をうまくコントロールできない。
シーディング
シード溶液からストリークする以外にも、すでに得られている結晶に触れプローブにシードを付着させる方法もある。その他のシーディング法の文献を紹介する(1,2)。
文献
- 坂部知平監修、相原茂夫編集, タンパク質の結晶化, 京都大学学術出版会 (2005)
- Carter, C.W., Acta Cryst., D50, 572-90 (1994)