概要
X 線結晶構造解析において、目的タンパク質の結晶化スクリーニングを効率的に行うことが必要である。かつては塩のみを沈殿剤として用いる結晶化条件が多用されたが、温度、塩濃度に非常に敏感でありスクリーニングの段階では使いにくい。一方、高分子量ポリエチレングリコール(PEG)は塩とは異なり、広い濃度範囲で結晶化が可能なことからスクリーニングに不可欠な沈殿剤である。近年、高分子量ポリエチレングリコール(PEG)と塩を組み合わせた結晶化が多用されるようになっている。その場合に最適な pH、最適な塩濃度があることが知られているが、高分子量 PEG と pH、塩濃度を適切に組み合わせたスクリーニングキットが存在しなかった。本プロトコルでは、筆者が開発した塩濃度の最適化を利用した PEG ベースの新しい結晶化スクリーニングキットの組成、調製方法、使用例について紹介する。さらに、他のスクリーニングキットにも応用可能な、小容量、手動での結晶化スクリーニング方法を記す。
イントロダクション
構造生物学は、生命科学の発展に欠くことのできない分野となった。筆者は、これまで一貫してX線結晶構造解析を手法とするタンパク質の構造と機能の研究に取り組んできた。特に、鉄を結合輸送するタンパク質であるトランスフェリンのX線結晶構造解析を中心として行い、鉄結合に伴うドメインの大きな動きのしくみ、鉄放出のしくみの詳細などを解明した(1)。このような構造生物学的研究において、目的タンパク質の結晶化スクリーニングを効率的に行う必要から、筆者は新しい結晶化スクリーニングキットを開発し、トランスフェリンの結晶化などに用いてきた。また、メダカのα-アミラーゼ、巻貝のセルラーゼなどの結晶化、X線結晶構造解析にも成功し、本スクリーニングキットがタンパク質の結晶化に広く応用可能であることを示した(2, 3)。
一般的に結晶化スクリーニングには、A: 様々な条件を含むスパースマトリックス法(これまでの結晶化に成功した条件を抽出して設計されていることが多く、pH、沈殿化剤濃度を系統的に変化させてはおらず条件がまばら“sparse”になっている)、B: 条件を系統的に変化させる方法、C: ポリエチレングリコールと様々な塩(固定濃度)の組み合わせ、の概ね3タイプのキットが用いられる。A では、Hampton Research 社の Crystal Screen や Crystal Screen 2、Molecular Dimensions 社の JCSG+、Jena Bioscience 社の Wizard 1 や Wizard 2 が古くから使われている。B では Hampton Research 社の各種 Grid Screen、Molecular Dimensions 社の PACT premier が知られ、C では Hampton Research 社の PEG/Ion Screen、PEG/Ion 2 Screen などがある。
筆者も様々な結晶化スクリーニングキットを用いてきたが、前述のトランスフェリンの結晶化において様々な困難があった。アポ型(鉄非結合型)トランスフェリンの結晶化においては(主にA、B のタイプの)スクリーニングキットに含まれる金属等が障害になり、逆にホロ型(鉄結合型)の結晶化では鉄を放出する pH5 以下の条件等が障害になった(1)。また、(A のタイプの条件に多く含まれ、かつて多用された)塩のみを沈殿剤として用いる結晶化は、温度や塩濃度の変化に非常に敏感であり特にスクリーニング段階では使いにくい。一方、高分子量ポリエチレングリコール(PEG)は塩とは異なり、広い濃度範囲で結晶化が可能なことからスクリーニングに不可欠な沈殿剤である。塩はタンパク質の電荷を抑え分子間の反発を抑制し、PEG との併用でも沈殿剤として相乗効果があると考えられている(4)。近年では、高分子量PEGと塩を組み合わせた結晶化条件が広く使われ、市販の結晶化スクリーニングキットでも前述の様に高分子量 PEG と様々な塩(固定濃度)の組み合わせによるものがある。そのタイプの Hampton Research 社の PEG/Ion Screen は緩衝液が含まれないキットであるため、サンプル側の pH を変化させる必要があり、スクリーニングの操作が比較的煩雑となりがちである。そのため、pH を変えた緩衝液、PEG、塩を組み合わせたスクリーニングキットを新たに作製することにした。一方、(宇宙実験で使われるカウンターディフュージョン法によるタンパク質結晶生成キットなどで知られる)コンフォーカルサイエンス社の山中らが、pH、PEG4000、塩の組み合わせでの結晶化で塩濃度を変化させ最適化することで結晶化を効率的に行えるという論文を発表した(4)。そこで筆者はpH、PEG(主に PEG4000)、塩の組み合わせで塩の濃度を数種類変化させる結晶化スクリーニングキットを作製した(既に販売されている Hampton Research 社の PEG/Ion 400 が PEG 濃度を固定し、塩濃度が2種類になっているが、このキットの場合は PEG が低分子量で液体の PEG400 であり有機溶媒としての性質が強く一般的な高分子量 PEG とは性質が異なる)。
PDB に登録されたデータに記載された結晶化条件(5, 6)、これまで報告されているトランスフェリンの結晶化条件、市販の結晶化スクリーニングキットPACT premier、MemGold などの組成(7)、予備実験(データ非公開)により、緩衝液、PEG、塩の種類を決定した。2005年の PDB データから抽出した結晶化条件の論文(5)によると、緩衝液として Tris、HEPES、MES が最も多用されていた(塩としても使われる酢酸、クエン酸を除く)。また、PEG として PEG4000、PEG8000、PEG3350 の順で多用されていた。2015年の統計(6)では PEG3350、PEG4000、PEG8000 の順になっているが、これは市販のスクリーニングキットで PEG3350 が多用され、Hampton Research 社から PEG3350 が販売されているためではないかと思われる。ただ、市販のPEG4000(ナカライテスクや和光純薬)の平均分子量は3500程度までであり、経験上どちらでも同様に結晶化が進むことが多いため厳密に使い分ける必要はないと思われる。前述の2005年の論文では、塩として多用されたもの16種類(HEPES など明らかに緩衝液の成分であるものを除く)が挙げられており、この中から9種類の塩(酢酸ナトリウム、硫酸リチウム、ギ酸ナトリウム、クエン酸ナトリウム、塩化カリウム、硫酸アンモニウム、塩化ナトリウム、塩化カルシウム、塩化マグネシウム)を選択した。2015年の論文では、塩として多用されたものが4種類挙げられており全て採用したものに含まれる。さらに市販のスクリーニングキットを参考に、硝酸ナトリウム、硫酸亜鉛を追加した。スクリーニングキット MemGold でも同様に、緩衝液として Tris、HEPES、MES の順で、高分子量 PEG として PEG3350、PEG4000 の順で多用され、塩の種類も選択したものと概ね重なる。MemGold ではバリウム塩、カドミウム塩なども含まれるが、廃液処理が煩雑になること、トランスフェリンなど金属結合タンパク質の構造を変える可能性があることから採用しなかった。
最終的に、表1のように緩衝液に MES-Na pH6.5、HEPES-Na pH7.5、Tris-HCl pH8.8、PEG に PEG4000(またはPEG3350)、塩として 0.2 M、0.4 M、0.6 M の酢酸ナトリウム、硝酸ナトリウム、硫酸リチウム、ギ酸ナトリウム、クエン酸ナトリウム、塩化カリウム、0.1 M の塩化カルシウム、塩化マグネシウム、0.01 M の硫酸亜鉛を採用した。低分子量の PEG400 でトランスフェリンの結晶が出る事例も見られること(8)、前述の2005年の統計で使用例が多いこと、MemGold などのスクリーニングキットで多用されていることから採用し、同じ緩衝液、PEG400、0.2 M、0.4 M、0.6 M の硫酸アンモニウム、塩化ナトリウム、0.1 M の塩化カルシウム、塩化マグネシウム、0.01 M の硫酸亜鉛を組み合わせた溶液も用意した。低濃度で沈殿を生成させる塩化カルシウム、塩化マグネシウム、硫酸亜鉛は、固定濃度にした。さらに PEG4000、PEG400 について塩を含まない溶液も加えて、表1の96種類の溶液を用意した。2011年7月に開発が終了しトランスフェリン用の5番目の結晶化スクリーニングキットということで screening-tf5 と 名づけられたが(3)、本発表に伴い塩濃度最適化(salt concentration optimization)が分かりやすいように SCO-PEG screen 5 と名称を変更する。
本プロトコルでは、この結晶化スクリーニングキットの組成、調製方法、使用例について詳細に紹介する。さらに、他のスクリーニングキットにも応用可能な、小容量、手動での結晶化スクリーニング方法を書置きとして記す。
装置・機器・試薬
装置
- 冷凍機付インキュベーター(PHC 社の MIR-154-PJ 等)
- 実体顕微鏡(オリンパス社の SZX7、SZ61 等)
- 緩衝液、沈殿剤溶液の作製に必要な天秤、pH メーター等
器具
- 1 mL、200 μL、10 μL のマイクロピペット(ニチリョー社のニチペット EX II 等)
- 200 μL、10 μL の8連ピペット(ニチリョー社のニチペット EX II MULTI 等)
- 用意できれば、10 μL の電動マイクロピペット(分注操作ができるもの)
- 用意できれば、1000 μL の電動マイクロピペット
- マイクロピペット用の各チップ(各社、10 μL 用は短いものにすること)
- 用意できれば、連続分注機とチップ(ギルソン社の DISTRIMAN と DistriTip 12.5 mL 等)
- 96穴 2 mL のディープウエルプレートとカバー(MATRIX ScreenMates MT4221 と MT4421 等)または96穴 1.2 mL クラスターチューブとキャップ(Corning 社の4412と4418等)
- 50-200 mL のポリエチレンまたはポリプロピレン容器(Nalgene ボトル等)
- 15 mL の遠心チューブ(Greiner 社の188261や188271等)
- 96穴結晶化プレート(Hampton Research 社の Intelli-Plate 96-2 Original 等)
- 結晶化サンプルを調製する場合、限外ろ過ユニット(ザルトリウス社の各種 Vivaspin 等)
- 透明な結晶化プレート用シール(カジックス社のタイタースティック HC 等)
- シーリングパッド(Hampton Research 社の 3M Sealing Paddle Gold 等)
- 緩衝液、沈殿剤溶液の作製に必要なビーカー、メスシリンダー、秤量皿、薬さじ等
試薬
- 各種のポリエチレングリコール
PEG4000(和光純薬等)または PEG3350(Hampton Research 等)、PEG400(ナカライテスク等) - 各種の塩
硫酸亜鉛・七水和物、塩化カルシウム・二水和物、塩化マグネシウム・六水和物、酢酸ナトリウム・三水和物、硝酸ナトリウム、硫酸リチウム、ギ酸ナトリウム、クエン酸ナトリウム・二ナトリウム1.5水和物、塩化カリウム、硫酸アンモニウム、塩化ナトリウム(各社) - 緩衝液用の試薬
MES、HEPES、HEPES-Na、Tris、水酸化ナトリウム、塩酸(各社) - 防腐剤(必須ではない)
アジ化ナトリウム(各社)
実験手順
- 下記に示す各種の原液(2種類の PEG 溶液、11種類の塩の溶液、3種類の緩衝剤溶液)を作製する。
- これらを混ぜ合わせて96種類の沈殿剤溶液を作製する。
- 別途結晶化サンプル溶液を準備し、通常の結晶化スクリーニングの操作を行う。全てを1日で行うことが可能であるが、それぞれ別の日に行っても構わない。
実験の詳細
1) 原液の調製
1-1) 60%(v/v) PEG400、50%(w/v) PEG4000(またはPEG3350)の各溶液を調製する。
- 30 mL の PEG400 を 50 mL のメスシリンダーではかり取り、純水で 50 mLにメスアップし転倒混和する。
- 30 g の PEG4000 または PEG3350 を天秤ではかり取り、50 mL のメスシリンダーに移し純水を 50 mL の線付近まで入れる。メスシリンダーごと緩やかに揺り動かすことで溶解し 50 mL にメスアップし転倒混和する。かなり溶けにくいため(PEG を 25 g にして)50%濃度の原液を作製し、スクリーニングキットでの最終濃度22.5%にしてもよい。
- 通常の容器ではフタが傷みやすいため、Nalgene の高密度ポリエチレン(HDPE)ボトルに保存するのが好ましい。最終濃度0.02%になるようにアジ化ナトリウムを入れると腐敗しない(20%アジ化ナトリウム溶液なら 50 μL 加える)。
1-2) 1 M 硫酸亜鉛、塩化カルシウム、塩化マグネシウムの各溶液を調製する。
- 下記の重さの各試薬を天秤ではかり取り、純水で溶解し 10 mL にメスアップし転倒混和する。15 mL の遠心管に保存すると沈殿剤溶液の調製時に並べて置きやすい。
- 2.88 g の硫酸亜鉛・七水和物(分子量287.56)
- 1.47 g の塩化カルシウム・二水和物(147.02)
- 2.03 g の塩化マグネシウム・六水和物(203.30)
1-3) 各 2 M の酢酸ナトリウム、硝酸ナトリウム、硫酸リチウム、ギ酸ナトリウム、クエン酸ナトリウム(2Na)、塩化カリウム、硫酸アンモニウム、塩化ナトリウムの各溶液を調製する。
- 下記の重さの各試薬を天秤ではかり取り、純水で溶解し10 mLにメスアップし転倒混和する。15 mLの遠心管に保存すると沈殿剤溶液の調製時に並べて置きやすい。
- 2.72 g の酢酸ナトリウム・三水和物(分子量136.08)
- 1.70 g の硝酸ナトリウム(84.99)
- 2.56 g の硫酸リチウム(127.95)
- 1.36 g のギ酸ナトリウム(68.01)
- 5.26 g のクエン酸ナトリウム・二ナトリウム1.5水和物(263.11)
- 1.49 g の塩化カリウム(74.55)
- 2.64 g の硫酸アンモニウム(132.14)
- 1.4 の塩化ナトリウム(58.44)
1-4) 各 1 M の MES-Na(pH6.5)、HEPES(pH7.5)、Tris-HCl(pH8.8)の各緩衝液を調製する。
- 10.6 g の MES を天秤ではかり取り、2.0 M の水酸化ナトリウム水溶液で pH を6.5に調整しながら純水で溶解し、50 mL にメスアップし転倒混和する。
- 11.9 g の HEPES を天秤ではかり取り、2.0 M の水酸化ナトリウム水溶液で pH を7.5に調整しながら純水で溶解し、50 mL にメスアップし転倒混和する。または、5.96 g の HEPES と6.51 g の HEPES-Na を天秤ではかり取り、純水で溶解し 50 mL にメスアップし転倒混和する。
- 6.06 g の Tris を天秤ではかり取り、塩酸で pH を8.8に調整しながら純水で溶解し、50 mL にメスアップし転倒混和する。
- それぞれ、50 mL 程度のポリプロピレンまたはポリエチレン容器に保存する。
2) 沈殿剤溶液の調製
2-1) 表2の容量で、1) で調製した原液(緩衝液、PEG 溶液、塩溶液)および純水を96穴のディープウェルプレートまたはクラスターチューブに入れる。PEG 溶液は全て 500 μL、緩衝液は全て 50 μLのため、分注機または分注ができる電動ピペットがあると省力化できる(表2はエクセルファイルを用意しており合計容量等を変えて再計算可能である)。
2-2) 全て入れた後にピペッティングなどで混合する。ここでも 1 mL の電動ピペットがあると省力化できる。
2-3) 容器に合うフタをして使用時まで冷蔵庫等で保存する。PEG 溶液にアジ化ナトリウムを加えていると腐敗しないが、96穴保存容器は乾燥しやすいためなるべく早く使用する。
3) 結晶化スクリーニング
3-1) ザルトリウス社の各種 Vivaspin 等の限外ろ過ユニットで目的タンパク質の濃度を 10–20 mg/mL にする。緩衝液はあらかじめゲルろ過や透析等で交換しておくか、限外ろ過ユニット上で濃縮、緩衝液添加を繰り返して交換する。本スクリーニングキットの緩衝液が 50 mM であるため、タンパク質サンプルの緩衝液は 20 mM 以下(5–20 mM)が望ましい。
3-2) シッティングドロップ用96穴結晶化プレートを用意し、200 μL の8連ピペットで下段ウェルにスクリーニングキットの溶液を 50–100 μL ずつ移す。
3-3) 結晶化プレートの上段ウェルにタンパク質溶液を 0.4–1.0 μL ずつ入れる。この際、電動ピペットがあれば素早く正確な操作が可能になる。10 μL の電動ピペットを分注モードにし 0.4 μL×24 に設定すれば縦に3列ずつタンパク質サンプルを入れていくことが可能である。
3-4) 続いて下段ウェルの溶液を 10 μL の8連ピペットでタンパク質と同じ容量だけ取り、上段ウェルのタンパク質サンプルに加える。
- 10 μL ピペット(電動ピペット、シングルチャネルピペット、8連ピペット)は、仕様で 0.5 μL までになっている場合が多いが、ほとんどは 0.4 μL に設定でき概ね正確に計量することが可能である。
- 200 μL の8連ピペット、10 μL の8連ピペット共に毎回チップを付け替えてもよいが、大きめのビーカーやトレイに入れた純水ですすぎ(200 μL では他の容器に吐出、10 μL ではろ紙やキムワイプに吐出)、先端付近をろ紙やキムワイプで拭いても構わない。8連ピペットにチップを正確に付けるのは意外に難しく、付け替えるより洗った方が早い場合もあり、コストと資源消費を削減できる。
3-5) 全ての操作が終わったら、透明な結晶化プレート用シールをしっかりと貼り付ける。シーリングパッドで押さえつけるとよい。
3-6) シールをした結晶化プレートを20℃または4℃の冷凍機付インキュベーターに入れ静置する。
- 通常は20℃でよいが、20℃でうまくいかない場合、タンパク質が不安定である事が分かっている場合、プレートごと輸送する場合(20℃で輸送することは難しいため)等は、4℃での結晶化を行う。4℃で作製した結晶を室温で観察すると観察中に結晶が溶解することがあるので、その場合は観察等もなるべく4℃で行うこと。
3-7) 数日ごとに実体顕微鏡で観察し結晶の生成を確認する。結晶化プレート内の溶液が乾燥するため、数か月程度で結晶が得られない場合は別の条件を検討する。
- 実体顕微鏡を新たに購入する場合、透明で立体的な結晶が極度に見にくいため薄型LED透過照明を避けること。厚型で偏光板を挿入でき簡易偏光観察ができる透過照明が好ましい。
3-8) 生成した結晶は充分な大きさがあれば、そのまま X 線回折データを収集し構造解析を行うことが可能である。下記のメダカαアミラーゼは1度の結晶化スクリーニングで生成した結晶のみで構造解析を行った。
- 通常は、24穴結晶化プレートなどでややスケールを大きくして、結晶化を再現、改良する。より良質の結晶を得るために、pHや塩濃度をより細かく変更したり、シーディングを行ったりするとよい。
3-9) 既に X 線結晶構造解析に成功したものから本キットを用いた結晶化スクリーニングの実例を紹介する。
- 25% PEG4000(またはPEG3350)の条件による成功例(一部22.5% PEG、全て20℃)
- メダカαアミラーゼ(2)
- pH8.8、0.2 M 硝酸ナトリウム
- pH8.8、0.4 M 酢酸ナトリウム
- メダカリゾチーム・キトビオース複合体(論文作成中)
- pH6.5、0.2 M 硫酸リチウム
- pH7.5、0.2 M、0.4 M 硫酸リチウム
- pH8.8、0.2 M、0.4 M 硫酸リチウム
- メダカリゾチーム L31A 変異体・キトビオース複合体(論文作成中)
- pH6.5、0.4 M 硫酸リチウム
- pH7.5、0.2 M 硫酸リチウム
- pH8.8、0.2 M 硫酸リチウム
- pH6.5、0.4 M 硝酸ナトリウム
- pH7.5、0.4 M、0.6 M硝酸ナトリウム
- pH8.8、0.2 M、0.4 M、0.6 M硝酸ナトリウム
- 巻貝セルラーゼ EG27II(3)
- pH6.5、0.2 M、0.4 M 塩化カリウム
- 巻貝セルラーゼ EG27II・セロビオース複合体(3)
- pH6.5、0.2 M 硫酸リチウム
- pH6.5、0.2 M 塩化カリウム
- メダカαアミラーゼ(2)
- 30% PEG400の条件による成功例(全て20℃)
- オボトランスフェリンN半分子ホロ型(鉄結合型)
- pH6.5、塩なし
- pH7.5、塩なし
- オボトランスフェリンN半分子ホロ型(鉄結合型)
二枚貝セルラーゼ CjCel45A については良好な結晶が得られなかった。結合する糖鎖が均一でなかったためであると思われる。現状では、成功率の統計を示すほどのデータ数がないため、利用者からの情報提供により改訂を加えたい。
工夫とコツ
結晶化がうまくいかなかった場合は、本スクリーニングキットと性格が異なるスパースマトリックス法によるキットを1種類用いるとよい。それでも結晶が出ない場合は、むやみにスクリーニングキットを変えるのではなく、結晶化サンプルを改変することが好ましい。例えばリガンドを予め結合させておくことで、結晶化に成功することがある。本スクリーニングキットは pH や塩濃度などで穏やかな条件であるため、リガンドの結合を阻害する(解離を促進する)ことが少なく、実例で紹介したようにタンパク質・リガンド複合体の結晶化スクリーニングにも成功した。メダカリゾチームの結晶化では、キトビオース複合体の結晶化に成功した。
目的タンパク質の安定な pH 領域が本プロトコルで紹介したもの(pH6.5-8.8)と異なる場合は、適宜 pH の範囲を変更するとよい。塩の種類についても、好ましいと分かっているものがある、逆に好ましくないと分かっているものがある場合は変更するとよい。特にキレートとして働くクエン酸ナトリウムについては検討の余地がある。先に挙げた2005年の統計で塩として多用されたもの16種類のうち、今回採用しなかった塩の多くはリン酸塩である。金属の持ち込みなどにより沈殿を生じることが多いので除いたが、採用を検討する余地はある。PEG については多少の分子量や濃度の違いに影響されることが少なく、変更する必要はあまりないと思われる。逆に手元にある高分子、低分子2種類のPEGでキットを作製してもよい。
結晶化スクリーニングでは根性論のようなものがまかり通っており、実際にスクリーニングを繰り返すことで結晶が生成することがあるが、これは手技の不正確さにより結晶化条件がばらつくことにもよると考えられる。本スクリーニングキットでは塩の濃度を変えることで、手技が正確である場合でも一度に結晶化条件に細かなばらつきを与えている。結晶化に再現性の無い原因の一つに結晶の核形成が遅い場合があり、この対策としてはミクロシーディングがある。
スクリーニングキットを通常の研究室で簡単に作製できるように工夫した。コストを大きく削減できるだけでなく、実際に手元にある試薬でキットを作ることによりスクリーニングで生じた結晶化を(同じ試薬を用いることができるため)再現することが容易になる。
これまでの結晶化例に合わせる、相分離を避ける、条件の多様性を増す等の目的で、PEG4000 と PEG400 で組み合わせる塩をあえて少し変えている部分(硫酸リチウムと硫酸アンモニウム、塩化カリウムと塩化ナトリウム)があるが PEG4000 側の条件に合わせることは可能である。その場合は、用意する試薬が2種類少なくなる(PEG4000 と硫酸アンモニウムの併用は沈殿剤溶液が2相に分離することがある)。
構造解析に成功した実例は可溶性タンパク質のみであるが、膜タンパク質用の結晶化キット MemGold など(5)の組成も参考にしたため、膜タンパク質の結晶化スクリーニングにも応用可能である。本スクリーニングキットに含まれる条件で、ヒト苦味受容体の結晶化に成功した(データ非公開)。
塩化カルシウム、塩化マグネシウム、硫酸亜鉛を含む条件では(本キットではなるべく濃度を抑えているものの)、サンプルからの微量のリン酸塩の持ち込み等により塩の結晶が析出しやすいとされているので注意すること。
実験の安全
硫酸亜鉛が劇物であるため取り扱いに注意する。固体または高濃度の水酸化ナトリウムを使う場合は、劇物であるため取り扱いに注意する。防腐剤としてアジ化ナトリウムを使用する場合は、毒物であるため取り扱いに注意する。組成を改変した場合は、使用する試薬に適宜注意する。
文献
- Mizutani, K., Toyoda, M., & Mikami, B., Biochim. Biophys. Acta., 1820, 203–211 (2012)
- Mizutani, K., Toyoda, M., Otake, Y., Yoshioka, S., Takahashi, N., & Mikami, B., Biochim. Biophys. Acta., 1824, 954–962 (2012)
- Nomura, T., Iwase, H., Saka, N., Takahashi, N., Mikami, B., & Mizutani, K., Acta Crystallogr. D Struct. Biol., 75, 426–436 (2019)
- Yamanaka, M., Inaka, K., Furubayashi, N., Matsushima, M., Takahashi, S., Tanaka, H., Sano, S., Sato, M., Kobayashi, T., & Tanaka, T., J. Synchrotron Radiat., 18, 84–87 (2011)
- Peat, T. S., Christopher, J. A., & Newman, J. Acta Crystallogr. D Biol. Crystallogr. 61, 1662–1669 (2005)
- Kirkwood, J., Hargreaves, D., Simon, O’Keefec, S., Wilson, J., Acta Crystallogr. F Struct. Biol. Commun. 71, 1228–1234 (2015)
- Newstead, S., Ferrandon, S., Iwata, S., Protein Science, 17, 466–472 (2008)
- Mizutani, K., Mikami, B., Aibara, S., & Hirose, M., Acta Crystallographica D Biological Crystallography, 61, 1636–1642 (2005)
-
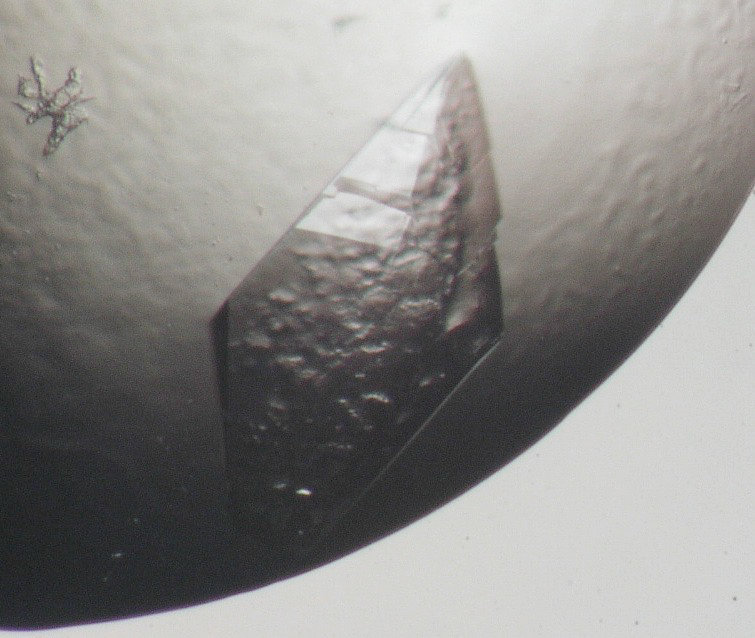
図1:本スクリーニングキットで結晶化に成功したメダカαアミラーゼの写真。スクリーニングで得られたこの結晶で X 線結晶構造解析に成功した。結晶化条件は、タンパク質濃度が 24 mg/mL(20 mM Tris-HCl、pH8.0) 、沈殿剤溶液が 22.5% PEG3350、0.2 M 硝酸ナトリウム、50 mM Tris-HCl、 pH8.8、結晶化温度が20℃であった。 -

表1:SCO-PEG screen 5 の組成(網掛け部分が PEG400、その他は PEG4000 の条件) -

表2:沈殿剤溶液の調製方法(各原液と純水の量の一覧、単位は μL、網掛け部分が PEG400、その他は PEG4000 の条件)
概要
X 線結晶構造解析において、目的タンパク質の結晶化スクリーニングを効率的に行うことが必要である。かつては塩のみを沈殿剤として用いる結晶化条件が多用されたが、温度、塩濃度に非常に敏感でありスクリーニングの段階では使いにくい。一方、高分子量ポリエチレングリコール(PEG)は塩とは異なり、広い濃度範囲で結晶化が可能なことからスクリーニングに不可欠な沈殿剤である。近年、高分子量ポリエチレングリコール(PEG)と塩を組み合わせた結晶化が多用されるようになっている。その場合に最適な pH、最適な塩濃度があることが知られているが、高分子量 PEG と pH、塩濃度を適切に組み合わせたスクリーニングキットが存在しなかった。本プロトコルでは、筆者が開発した塩濃度の最適化を利用した PEG ベースの新しい結晶化スクリーニングキットの組成、調製方法、使用例について紹介する。さらに、他のスクリーニングキットにも応用可能な、小容量、手動での結晶化スクリーニング方法を記す。
イントロダクション
構造生物学は、生命科学の発展に欠くことのできない分野となった。筆者は、これまで一貫してX線結晶構造解析を手法とするタンパク質の構造と機能の研究に取り組んできた。特に、鉄を結合輸送するタンパク質であるトランスフェリンのX線結晶構造解析を中心として行い、鉄結合に伴うドメインの大きな動きのしくみ、鉄放出のしくみの詳細などを解明した(1)。このような構造生物学的研究において、目的タンパク質の結晶化スクリーニングを効率的に行う必要から、筆者は新しい結晶化スクリーニングキットを開発し、トランスフェリンの結晶化などに用いてきた。また、メダカのα-アミラーゼ、巻貝のセルラーゼなどの結晶化、X線結晶構造解析にも成功し、本スクリーニングキットがタンパク質の結晶化に広く応用可能であることを示した(2, 3)。
一般的に結晶化スクリーニングには、A: 様々な条件を含むスパースマトリックス法(これまでの結晶化に成功した条件を抽出して設計されていることが多く、pH、沈殿化剤濃度を系統的に変化させてはおらず条件がまばら“sparse”になっている)、B: 条件を系統的に変化させる方法、C: ポリエチレングリコールと様々な塩(固定濃度)の組み合わせ、の概ね3タイプのキットが用いられる。A では、Hampton Research 社の Crystal Screen や Crystal Screen 2、Molecular Dimensions 社の JCSG+、Jena Bioscience 社の Wizard 1 や Wizard 2 が古くから使われている。B では Hampton Research 社の各種 Grid Screen、Molecular Dimensions 社の PACT premier が知られ、C では Hampton Research 社の PEG/Ion Screen、PEG/Ion 2 Screen などがある。
筆者も様々な結晶化スクリーニングキットを用いてきたが、前述のトランスフェリンの結晶化において様々な困難があった。アポ型(鉄非結合型)トランスフェリンの結晶化においては(主にA、B のタイプの)スクリーニングキットに含まれる金属等が障害になり、逆にホロ型(鉄結合型)の結晶化では鉄を放出する pH5 以下の条件等が障害になった(1)。また、(A のタイプの条件に多く含まれ、かつて多用された)塩のみを沈殿剤として用いる結晶化は、温度や塩濃度の変化に非常に敏感であり特にスクリーニング段階では使いにくい。一方、高分子量ポリエチレングリコール(PEG)は塩とは異なり、広い濃度範囲で結晶化が可能なことからスクリーニングに不可欠な沈殿剤である。塩はタンパク質の電荷を抑え分子間の反発を抑制し、PEG との併用でも沈殿剤として相乗効果があると考えられている(4)。近年では、高分子量PEGと塩を組み合わせた結晶化条件が広く使われ、市販の結晶化スクリーニングキットでも前述の様に高分子量 PEG と様々な塩(固定濃度)の組み合わせによるものがある。そのタイプの Hampton Research 社の PEG/Ion Screen は緩衝液が含まれないキットであるため、サンプル側の pH を変化させる必要があり、スクリーニングの操作が比較的煩雑となりがちである。そのため、pH を変えた緩衝液、PEG、塩を組み合わせたスクリーニングキットを新たに作製することにした。一方、(宇宙実験で使われるカウンターディフュージョン法によるタンパク質結晶生成キットなどで知られる)コンフォーカルサイエンス社の山中らが、pH、PEG4000、塩の組み合わせでの結晶化で塩濃度を変化させ最適化することで結晶化を効率的に行えるという論文を発表した(4)。そこで筆者はpH、PEG(主に PEG4000)、塩の組み合わせで塩の濃度を数種類変化させる結晶化スクリーニングキットを作製した(既に販売されている Hampton Research 社の PEG/Ion 400 が PEG 濃度を固定し、塩濃度が2種類になっているが、このキットの場合は PEG が低分子量で液体の PEG400 であり有機溶媒としての性質が強く一般的な高分子量 PEG とは性質が異なる)。
PDB に登録されたデータに記載された結晶化条件(5, 6)、これまで報告されているトランスフェリンの結晶化条件、市販の結晶化スクリーニングキットPACT premier、MemGold などの組成(7)、予備実験(データ非公開)により、緩衝液、PEG、塩の種類を決定した。2005年の PDB データから抽出した結晶化条件の論文(5)によると、緩衝液として Tris、HEPES、MES が最も多用されていた(塩としても使われる酢酸、クエン酸を除く)。また、PEG として PEG4000、PEG8000、PEG3350 の順で多用されていた。2015年の統計(6)では PEG3350、PEG4000、PEG8000 の順になっているが、これは市販のスクリーニングキットで PEG3350 が多用され、Hampton Research 社から PEG3350 が販売されているためではないかと思われる。ただ、市販のPEG4000(ナカライテスクや和光純薬)の平均分子量は3500程度までであり、経験上どちらでも同様に結晶化が進むことが多いため厳密に使い分ける必要はないと思われる。前述の2005年の論文では、塩として多用されたもの16種類(HEPES など明らかに緩衝液の成分であるものを除く)が挙げられており、この中から9種類の塩(酢酸ナトリウム、硫酸リチウム、ギ酸ナトリウム、クエン酸ナトリウム、塩化カリウム、硫酸アンモニウム、塩化ナトリウム、塩化カルシウム、塩化マグネシウム)を選択した。2015年の論文では、塩として多用されたものが4種類挙げられており全て採用したものに含まれる。さらに市販のスクリーニングキットを参考に、硝酸ナトリウム、硫酸亜鉛を追加した。スクリーニングキット MemGold でも同様に、緩衝液として Tris、HEPES、MES の順で、高分子量 PEG として PEG3350、PEG4000 の順で多用され、塩の種類も選択したものと概ね重なる。MemGold ではバリウム塩、カドミウム塩なども含まれるが、廃液処理が煩雑になること、トランスフェリンなど金属結合タンパク質の構造を変える可能性があることから採用しなかった。
最終的に、表1のように緩衝液に MES-Na pH6.5、HEPES-Na pH7.5、Tris-HCl pH8.8、PEG に PEG4000(またはPEG3350)、塩として 0.2 M、0.4 M、0.6 M の酢酸ナトリウム、硝酸ナトリウム、硫酸リチウム、ギ酸ナトリウム、クエン酸ナトリウム、塩化カリウム、0.1 M の塩化カルシウム、塩化マグネシウム、0.01 M の硫酸亜鉛を採用した。低分子量の PEG400 でトランスフェリンの結晶が出る事例も見られること(8)、前述の2005年の統計で使用例が多いこと、MemGold などのスクリーニングキットで多用されていることから採用し、同じ緩衝液、PEG400、0.2 M、0.4 M、0.6 M の硫酸アンモニウム、塩化ナトリウム、0.1 M の塩化カルシウム、塩化マグネシウム、0.01 M の硫酸亜鉛を組み合わせた溶液も用意した。低濃度で沈殿を生成させる塩化カルシウム、塩化マグネシウム、硫酸亜鉛は、固定濃度にした。さらに PEG4000、PEG400 について塩を含まない溶液も加えて、表1の96種類の溶液を用意した。2011年7月に開発が終了しトランスフェリン用の5番目の結晶化スクリーニングキットということで screening-tf5 と 名づけられたが(3)、本発表に伴い塩濃度最適化(salt concentration optimization)が分かりやすいように SCO-PEG screen 5 と名称を変更する。
本プロトコルでは、この結晶化スクリーニングキットの組成、調製方法、使用例について詳細に紹介する。さらに、他のスクリーニングキットにも応用可能な、小容量、手動での結晶化スクリーニング方法を書置きとして記す。
装置・機器・試薬
装置
- 冷凍機付インキュベーター(PHC 社の MIR-154-PJ 等)
- 実体顕微鏡(オリンパス社の SZX7、SZ61 等)
- 緩衝液、沈殿剤溶液の作製に必要な天秤、pH メーター等
器具
- 1 mL、200 μL、10 μL のマイクロピペット(ニチリョー社のニチペット EX II 等)
- 200 μL、10 μL の8連ピペット(ニチリョー社のニチペット EX II MULTI 等)
- 用意できれば、10 μL の電動マイクロピペット(分注操作ができるもの)
- 用意できれば、1000 μL の電動マイクロピペット
- マイクロピペット用の各チップ(各社、10 μL 用は短いものにすること)
- 用意できれば、連続分注機とチップ(ギルソン社の DISTRIMAN と DistriTip 12.5 mL 等)
- 96穴 2 mL のディープウエルプレートとカバー(MATRIX ScreenMates MT4221 と MT4421 等)または96穴 1.2 mL クラスターチューブとキャップ(Corning 社の4412と4418等)
- 50-200 mL のポリエチレンまたはポリプロピレン容器(Nalgene ボトル等)
- 15 mL の遠心チューブ(Greiner 社の188261や188271等)
- 96穴結晶化プレート(Hampton Research 社の Intelli-Plate 96-2 Original 等)
- 結晶化サンプルを調製する場合、限外ろ過ユニット(ザルトリウス社の各種 Vivaspin 等)
- 透明な結晶化プレート用シール(カジックス社のタイタースティック HC 等)
- シーリングパッド(Hampton Research 社の 3M Sealing Paddle Gold 等)
- 緩衝液、沈殿剤溶液の作製に必要なビーカー、メスシリンダー、秤量皿、薬さじ等
試薬
- 各種のポリエチレングリコール
PEG4000(和光純薬等)または PEG3350(Hampton Research 等)、PEG400(ナカライテスク等) - 各種の塩
硫酸亜鉛・七水和物、塩化カルシウム・二水和物、塩化マグネシウム・六水和物、酢酸ナトリウム・三水和物、硝酸ナトリウム、硫酸リチウム、ギ酸ナトリウム、クエン酸ナトリウム・二ナトリウム1.5水和物、塩化カリウム、硫酸アンモニウム、塩化ナトリウム(各社) - 緩衝液用の試薬
MES、HEPES、HEPES-Na、Tris、水酸化ナトリウム、塩酸(各社) - 防腐剤(必須ではない)
アジ化ナトリウム(各社)
実験手順
- 下記に示す各種の原液(2種類の PEG 溶液、11種類の塩の溶液、3種類の緩衝剤溶液)を作製する。
- これらを混ぜ合わせて96種類の沈殿剤溶液を作製する。
- 別途結晶化サンプル溶液を準備し、通常の結晶化スクリーニングの操作を行う。全てを1日で行うことが可能であるが、それぞれ別の日に行っても構わない。
実験の詳細
1) 原液の調製
1-1) 60%(v/v) PEG400、50%(w/v) PEG4000(またはPEG3350)の各溶液を調製する。
- 30 mL の PEG400 を 50 mL のメスシリンダーではかり取り、純水で 50 mLにメスアップし転倒混和する。
- 30 g の PEG4000 または PEG3350 を天秤ではかり取り、50 mL のメスシリンダーに移し純水を 50 mL の線付近まで入れる。メスシリンダーごと緩やかに揺り動かすことで溶解し 50 mL にメスアップし転倒混和する。かなり溶けにくいため(PEG を 25 g にして)50%濃度の原液を作製し、スクリーニングキットでの最終濃度22.5%にしてもよい。
- 通常の容器ではフタが傷みやすいため、Nalgene の高密度ポリエチレン(HDPE)ボトルに保存するのが好ましい。最終濃度0.02%になるようにアジ化ナトリウムを入れると腐敗しない(20%アジ化ナトリウム溶液なら 50 μL 加える)。
1-2) 1 M 硫酸亜鉛、塩化カルシウム、塩化マグネシウムの各溶液を調製する。
- 下記の重さの各試薬を天秤ではかり取り、純水で溶解し 10 mL にメスアップし転倒混和する。15 mL の遠心管に保存すると沈殿剤溶液の調製時に並べて置きやすい。
- 2.88 g の硫酸亜鉛・七水和物(分子量287.56)
- 1.47 g の塩化カルシウム・二水和物(147.02)
- 2.03 g の塩化マグネシウム・六水和物(203.30)
1-3) 各 2 M の酢酸ナトリウム、硝酸ナトリウム、硫酸リチウム、ギ酸ナトリウム、クエン酸ナトリウム(2Na)、塩化カリウム、硫酸アンモニウム、塩化ナトリウムの各溶液を調製する。
- 下記の重さの各試薬を天秤ではかり取り、純水で溶解し10 mLにメスアップし転倒混和する。15 mLの遠心管に保存すると沈殿剤溶液の調製時に並べて置きやすい。
- 2.72 g の酢酸ナトリウム・三水和物(分子量136.08)
- 1.70 g の硝酸ナトリウム(84.99)
- 2.56 g の硫酸リチウム(127.95)
- 1.36 g のギ酸ナトリウム(68.01)
- 5.26 g のクエン酸ナトリウム・二ナトリウム1.5水和物(263.11)
- 1.49 g の塩化カリウム(74.55)
- 2.64 g の硫酸アンモニウム(132.14)
- 1.4 の塩化ナトリウム(58.44)
1-4) 各 1 M の MES-Na(pH6.5)、HEPES(pH7.5)、Tris-HCl(pH8.8)の各緩衝液を調製する。
- 10.6 g の MES を天秤ではかり取り、2.0 M の水酸化ナトリウム水溶液で pH を6.5に調整しながら純水で溶解し、50 mL にメスアップし転倒混和する。
- 11.9 g の HEPES を天秤ではかり取り、2.0 M の水酸化ナトリウム水溶液で pH を7.5に調整しながら純水で溶解し、50 mL にメスアップし転倒混和する。または、5.96 g の HEPES と6.51 g の HEPES-Na を天秤ではかり取り、純水で溶解し 50 mL にメスアップし転倒混和する。
- 6.06 g の Tris を天秤ではかり取り、塩酸で pH を8.8に調整しながら純水で溶解し、50 mL にメスアップし転倒混和する。
- それぞれ、50 mL 程度のポリプロピレンまたはポリエチレン容器に保存する。
2) 沈殿剤溶液の調製
2-1) 表2の容量で、1) で調製した原液(緩衝液、PEG 溶液、塩溶液)および純水を96穴のディープウェルプレートまたはクラスターチューブに入れる。PEG 溶液は全て 500 μL、緩衝液は全て 50 μLのため、分注機または分注ができる電動ピペットがあると省力化できる(表2はエクセルファイルを用意しており合計容量等を変えて再計算可能である)。
2-2) 全て入れた後にピペッティングなどで混合する。ここでも 1 mL の電動ピペットがあると省力化できる。
2-3) 容器に合うフタをして使用時まで冷蔵庫等で保存する。PEG 溶液にアジ化ナトリウムを加えていると腐敗しないが、96穴保存容器は乾燥しやすいためなるべく早く使用する。
3) 結晶化スクリーニング
3-1) ザルトリウス社の各種 Vivaspin 等の限外ろ過ユニットで目的タンパク質の濃度を 10–20 mg/mL にする。緩衝液はあらかじめゲルろ過や透析等で交換しておくか、限外ろ過ユニット上で濃縮、緩衝液添加を繰り返して交換する。本スクリーニングキットの緩衝液が 50 mM であるため、タンパク質サンプルの緩衝液は 20 mM 以下(5–20 mM)が望ましい。
3-2) シッティングドロップ用96穴結晶化プレートを用意し、200 μL の8連ピペットで下段ウェルにスクリーニングキットの溶液を 50–100 μL ずつ移す。
3-3) 結晶化プレートの上段ウェルにタンパク質溶液を 0.4–1.0 μL ずつ入れる。この際、電動ピペットがあれば素早く正確な操作が可能になる。10 μL の電動ピペットを分注モードにし 0.4 μL×24 に設定すれば縦に3列ずつタンパク質サンプルを入れていくことが可能である。
3-4) 続いて下段ウェルの溶液を 10 μL の8連ピペットでタンパク質と同じ容量だけ取り、上段ウェルのタンパク質サンプルに加える。
- 10 μL ピペット(電動ピペット、シングルチャネルピペット、8連ピペット)は、仕様で 0.5 μL までになっている場合が多いが、ほとんどは 0.4 μL に設定でき概ね正確に計量することが可能である。
- 200 μL の8連ピペット、10 μL の8連ピペット共に毎回チップを付け替えてもよいが、大きめのビーカーやトレイに入れた純水ですすぎ(200 μL では他の容器に吐出、10 μL ではろ紙やキムワイプに吐出)、先端付近をろ紙やキムワイプで拭いても構わない。8連ピペットにチップを正確に付けるのは意外に難しく、付け替えるより洗った方が早い場合もあり、コストと資源消費を削減できる。
3-5) 全ての操作が終わったら、透明な結晶化プレート用シールをしっかりと貼り付ける。シーリングパッドで押さえつけるとよい。
3-6) シールをした結晶化プレートを20℃または4℃の冷凍機付インキュベーターに入れ静置する。
- 通常は20℃でよいが、20℃でうまくいかない場合、タンパク質が不安定である事が分かっている場合、プレートごと輸送する場合(20℃で輸送することは難しいため)等は、4℃での結晶化を行う。4℃で作製した結晶を室温で観察すると観察中に結晶が溶解することがあるので、その場合は観察等もなるべく4℃で行うこと。
3-7) 数日ごとに実体顕微鏡で観察し結晶の生成を確認する。結晶化プレート内の溶液が乾燥するため、数か月程度で結晶が得られない場合は別の条件を検討する。
- 実体顕微鏡を新たに購入する場合、透明で立体的な結晶が極度に見にくいため薄型LED透過照明を避けること。厚型で偏光板を挿入でき簡易偏光観察ができる透過照明が好ましい。
3-8) 生成した結晶は充分な大きさがあれば、そのまま X 線回折データを収集し構造解析を行うことが可能である。下記のメダカαアミラーゼは1度の結晶化スクリーニングで生成した結晶のみで構造解析を行った。
- 通常は、24穴結晶化プレートなどでややスケールを大きくして、結晶化を再現、改良する。より良質の結晶を得るために、pHや塩濃度をより細かく変更したり、シーディングを行ったりするとよい。
3-9) 既に X 線結晶構造解析に成功したものから本キットを用いた結晶化スクリーニングの実例を紹介する。
- 25% PEG4000(またはPEG3350)の条件による成功例(一部22.5% PEG、全て20℃)
- メダカαアミラーゼ(2)
- pH8.8、0.2 M 硝酸ナトリウム
- pH8.8、0.4 M 酢酸ナトリウム
- メダカリゾチーム・キトビオース複合体(論文作成中)
- pH6.5、0.2 M 硫酸リチウム
- pH7.5、0.2 M、0.4 M 硫酸リチウム
- pH8.8、0.2 M、0.4 M 硫酸リチウム
- メダカリゾチーム L31A 変異体・キトビオース複合体(論文作成中)
- pH6.5、0.4 M 硫酸リチウム
- pH7.5、0.2 M 硫酸リチウム
- pH8.8、0.2 M 硫酸リチウム
- pH6.5、0.4 M 硝酸ナトリウム
- pH7.5、0.4 M、0.6 M硝酸ナトリウム
- pH8.8、0.2 M、0.4 M、0.6 M硝酸ナトリウム
- 巻貝セルラーゼ EG27II(3)
- pH6.5、0.2 M、0.4 M 塩化カリウム
- 巻貝セルラーゼ EG27II・セロビオース複合体(3)
- pH6.5、0.2 M 硫酸リチウム
- pH6.5、0.2 M 塩化カリウム
- メダカαアミラーゼ(2)
- 30% PEG400の条件による成功例(全て20℃)
- オボトランスフェリンN半分子ホロ型(鉄結合型)
- pH6.5、塩なし
- pH7.5、塩なし
- オボトランスフェリンN半分子ホロ型(鉄結合型)
二枚貝セルラーゼ CjCel45A については良好な結晶が得られなかった。結合する糖鎖が均一でなかったためであると思われる。現状では、成功率の統計を示すほどのデータ数がないため、利用者からの情報提供により改訂を加えたい。
工夫とコツ
結晶化がうまくいかなかった場合は、本スクリーニングキットと性格が異なるスパースマトリックス法によるキットを1種類用いるとよい。それでも結晶が出ない場合は、むやみにスクリーニングキットを変えるのではなく、結晶化サンプルを改変することが好ましい。例えばリガンドを予め結合させておくことで、結晶化に成功することがある。本スクリーニングキットは pH や塩濃度などで穏やかな条件であるため、リガンドの結合を阻害する(解離を促進する)ことが少なく、実例で紹介したようにタンパク質・リガンド複合体の結晶化スクリーニングにも成功した。メダカリゾチームの結晶化では、キトビオース複合体の結晶化に成功した。
目的タンパク質の安定な pH 領域が本プロトコルで紹介したもの(pH6.5-8.8)と異なる場合は、適宜 pH の範囲を変更するとよい。塩の種類についても、好ましいと分かっているものがある、逆に好ましくないと分かっているものがある場合は変更するとよい。特にキレートとして働くクエン酸ナトリウムについては検討の余地がある。先に挙げた2005年の統計で塩として多用されたもの16種類のうち、今回採用しなかった塩の多くはリン酸塩である。金属の持ち込みなどにより沈殿を生じることが多いので除いたが、採用を検討する余地はある。PEG については多少の分子量や濃度の違いに影響されることが少なく、変更する必要はあまりないと思われる。逆に手元にある高分子、低分子2種類のPEGでキットを作製してもよい。
結晶化スクリーニングでは根性論のようなものがまかり通っており、実際にスクリーニングを繰り返すことで結晶が生成することがあるが、これは手技の不正確さにより結晶化条件がばらつくことにもよると考えられる。本スクリーニングキットでは塩の濃度を変えることで、手技が正確である場合でも一度に結晶化条件に細かなばらつきを与えている。結晶化に再現性の無い原因の一つに結晶の核形成が遅い場合があり、この対策としてはミクロシーディングがある。
スクリーニングキットを通常の研究室で簡単に作製できるように工夫した。コストを大きく削減できるだけでなく、実際に手元にある試薬でキットを作ることによりスクリーニングで生じた結晶化を(同じ試薬を用いることができるため)再現することが容易になる。
これまでの結晶化例に合わせる、相分離を避ける、条件の多様性を増す等の目的で、PEG4000 と PEG400 で組み合わせる塩をあえて少し変えている部分(硫酸リチウムと硫酸アンモニウム、塩化カリウムと塩化ナトリウム)があるが PEG4000 側の条件に合わせることは可能である。その場合は、用意する試薬が2種類少なくなる(PEG4000 と硫酸アンモニウムの併用は沈殿剤溶液が2相に分離することがある)。
構造解析に成功した実例は可溶性タンパク質のみであるが、膜タンパク質用の結晶化キット MemGold など(5)の組成も参考にしたため、膜タンパク質の結晶化スクリーニングにも応用可能である。本スクリーニングキットに含まれる条件で、ヒト苦味受容体の結晶化に成功した(データ非公開)。
塩化カルシウム、塩化マグネシウム、硫酸亜鉛を含む条件では(本キットではなるべく濃度を抑えているものの)、サンプルからの微量のリン酸塩の持ち込み等により塩の結晶が析出しやすいとされているので注意すること。
実験の安全
硫酸亜鉛が劇物であるため取り扱いに注意する。固体または高濃度の水酸化ナトリウムを使う場合は、劇物であるため取り扱いに注意する。防腐剤としてアジ化ナトリウムを使用する場合は、毒物であるため取り扱いに注意する。組成を改変した場合は、使用する試薬に適宜注意する。
文献
- Mizutani, K., Toyoda, M., & Mikami, B., Biochim. Biophys. Acta., 1820, 203–211 (2012)
- Mizutani, K., Toyoda, M., Otake, Y., Yoshioka, S., Takahashi, N., & Mikami, B., Biochim. Biophys. Acta., 1824, 954–962 (2012)
- Nomura, T., Iwase, H., Saka, N., Takahashi, N., Mikami, B., & Mizutani, K., Acta Crystallogr. D Struct. Biol., 75, 426–436 (2019)
- Yamanaka, M., Inaka, K., Furubayashi, N., Matsushima, M., Takahashi, S., Tanaka, H., Sano, S., Sato, M., Kobayashi, T., & Tanaka, T., J. Synchrotron Radiat., 18, 84–87 (2011)
- Peat, T. S., Christopher, J. A., & Newman, J. Acta Crystallogr. D Biol. Crystallogr. 61, 1662–1669 (2005)
- Kirkwood, J., Hargreaves, D., Simon, O’Keefec, S., Wilson, J., Acta Crystallogr. F Struct. Biol. Commun. 71, 1228–1234 (2015)
- Newstead, S., Ferrandon, S., Iwata, S., Protein Science, 17, 466–472 (2008)
- Mizutani, K., Mikami, B., Aibara, S., & Hirose, M., Acta Crystallographica D Biological Crystallography, 61, 1636–1642 (2005)


